双功能RGD-TAT肽修饰脂质体的构建及其脑胶质瘤靶向性研究
2014-09-18黄吉春蔡华荣江跃全
黄吉春,蔡华荣,江跃全Δ
(1.重庆医药高等专科学校 护理学院,重庆 404100;2.重庆市肿瘤研究所,重庆 404000)
双功能RGD-TAT肽修饰脂质体的构建及其脑胶质瘤靶向性研究
黄吉春1,蔡华荣2,江跃全2Δ
(1.重庆医药高等专科学校 护理学院,重庆 404100;2.重庆市肿瘤研究所,重庆 404000)
目的制备双功能RGD-TAT肽修饰的脂质体(RGD-TAT peptidemodified liposomes,RGD-TAT-LPs),并对其脑胶质瘤靶向性进行研究。方法采用薄膜分散法制备双功能RGD-TAT-LPs并进行表征;细胞摄取实验研究脑胶质瘤C6细胞对普通脂质体(liposomes,LPs)、RGD修饰脂质体(RGD-LPs)、TAT修饰脂质体(TAT-LPs)和RGD-TAT-LPs的摄取效率。构建脑胶质瘤原位肿瘤模型,研究不同脂质体在荷瘤裸鼠的体内分布。结果RGD-TAT-LPs的粒径为(116.5±11.3)nm,电位为(23.2±3.5)mV。细胞摄取实验结果显示:C6细胞对RGD-TAT-LPs的摄取效率分别是LPs、TAT-LPs和RGD-LPs的4.7倍、2.3倍和2.9倍,差异有统计学意义(P<0.01)。脂质体体内分布实验结果显示RGD-TAT修饰脂质体组荷瘤小鼠脑部荧光最强。结论RGD-TAT-LPs是一种潜在高效的肿瘤靶向给药系统。
整合素受体;细胞穿膜肽;药物靶向
1 材料与方法
1.1 材料与仪器 SizerNano ZS90型激光粒度仪及ZETA电位分析仪(英国Malvern instruments Ltd)。大豆磷脂(soya bean lecithin,SPC,上海太伟药业有限公司,批号:130108);胆固醇(cholesterol,Chol,美国 Sigma公司,批号:C110923);DSPEPEG2000(美国 Avanti polar lipids,批号:P102182);FITC标记磷脂(FITC-PE,美国 sigma公司,批号:F130010);RGD-TAT肽(上海吉尔生化公司);DMEM高糖培养基和胎牛血清(美国GIBCO公司);其余试剂为分析纯。小鼠脑胶质瘤细胞(C6,美国菌种库)。雄性小鼠4只(购自重庆医科大学实验动物中心,动物许可证号:CQYKDX109283)。
1.2 方法
1.2.1 RGD-TAT-LPs的制备及其表征 参照文献方法[17]合成 DSPE-PEG2000-TAT-RGD。使用薄膜分散法制备 RGDTAT-LPs。将 处 方 量 的 SPC,Cho,DSPE-PEG2000-TAT-RGD,DSPE-PEG-OMe[总磷脂∶胆固醇 =75∶25(摩尔比)],分别溶于氯仿,置50m L茄形瓶中旋转蒸发成膜后,再置真空干燥器中过夜。加入2.5 mL PBS缓冲液(pH 7.4),置空气浴摇床中,37℃,180 r/min,20min水化,水浴超声 5min,脱膜,探头超声制备得到RGD-TAT-LPs。
1.2.2 C6细胞对FITC标记脂质体的摄取 将对数生长期的细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后,每孔加入适量FITC标记的LPs、TAT-LPs、RGD-LPs和RGDTAT-LPs,使孔中FITC浓度为20 nmol/mL,37℃分别孵育2 h和4 h后除去含脂质体培养基,冷PBS清洗3次,0.25%胰酶消化后离心,PBS清洗3次,流式细胞仪测定细胞荧光值。
为了定性观察脂质体被细胞摄取后在细胞内的分布,将脂质体与细胞共同孵育6 h,加入100 nM LysoTracker,于无血清培养基中孵育1 h,冷PBS清洗2次后4%多聚甲醛室温固定30min,PBS清洗3次,DAPI孵育5min使细胞核染色,冷PBS洗涤3次后甘油封片,激光共聚焦显微镜下观察。
1.2.3 小鼠C6胶质瘤模型的建立以及活体成像 C6细胞经胰酶消化,离心后将其悬浮于DMEM培养液中,计数调节浓度至5×107/mL。4只小鼠(约25 g,雄性)静脉注射0.4 g/kg水合氯醛麻醉,内毗连线与头部矢状中线交汇处纵向1 cm长头皮切口,分离暴露颅骨,于前囱旁开3mm,向后1mm处颅骨钻孔。微量注射器吸入10μL上述细胞悬液,固定于立体定位仪上,沿钻孔垂直进针深6mm(右侧大脑纹状体区),后退1mm注射U87细胞悬液10μL,留针5min,缓慢拔针,以生理盐水冲洗,切口用线缝合打结。
按照1.2.1中方法制备载近红外荧光染料DIR的不同脂质体,荷瘤小鼠尾静脉注射12 h后,将小鼠用10%水合氯醛麻醉,于荧光活体成像系统下观察并拍照(Ex=730 nm,Em=790 nm)。
2 结果
2.1 脂质体的表征 取制备得到的RGD-TAT-LPs用马尔文激光粒度仪测定粒度和Zeta电位,平行测定3次。结果显示RGD-TAT-LPs的粒径在(116.5±11.3)nm,电位为(23.2±3.55)mV。取适量脂质体用磷钨酸染色,采用透射电镜观察形态(见图1),镜下可见制备的脂质体成球状,形态均一。
2.2 C6细胞对脂质体的摄取 不同脂质体的摄取实验结果见表1:细胞对脂质体的摄取量随着孵育时间的延长而增加,RGD-TAT-LPs在4 h摄取效率是2 h的1.9倍,差异有统计学意义(P<0.05);C6细胞在2 h对RGD-TAT-LPs的摄取效率分别是LPs、TAT-LPs和RGD-LPs的4.7倍、2.3倍和2.9倍,差异均有统计学意义(P<0.01)。

图1 透射电镜下观察RGD-TAT-LPsFig.1 Transmission electronmicroscopy image of RRGD-TAT-LPs
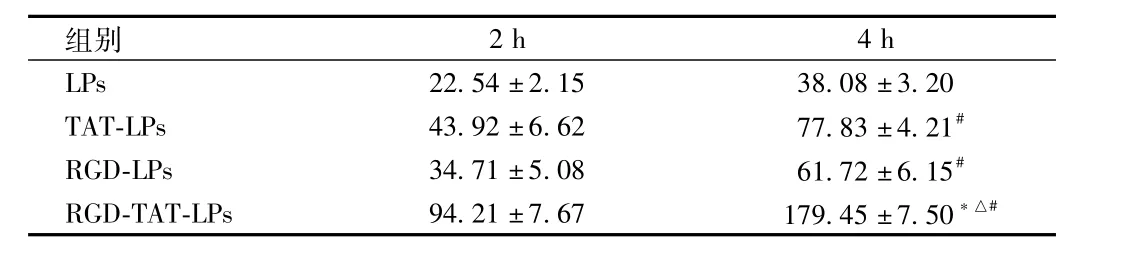
表1 C6细胞对不同脂质体的摄取效率Tab.1 Uptake of different liposomes by C6 cells
脂质体的细胞内分布如图2所示:RGD-LPs入胞后大量分布于溶酶体中。TAT-LPs脂质体摄取入胞后少量分布于溶酶体中,主要分布于细胞质中,表明TAT-LPs脂质体具有较强的溶酶体逃逸效应。RGD-TAT-LPs脂质体入胞能力较强,其中部分分布于溶酶体中部分存在于细胞质中。
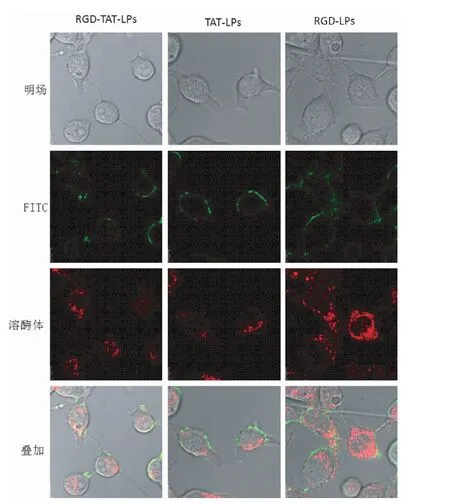
图2 不同脂质体在细胞内的分布Fig.2 The distribution of liposomes in cells
2.3 RGD-TAT-LPs的体内分布 荷瘤小鼠活体成像实验结果如图3所示,红色荧光越强,则DIR浓度越高,说明载DIR的脂质体在脑部蓄积量越大。RGD-TAT-LPs组的小鼠肿瘤组织红色荧光最强,其次是RGD修饰脂质体和TAT修饰脂质体,这说明RGD-TAT-LPs在脑部蓄积能力最强。
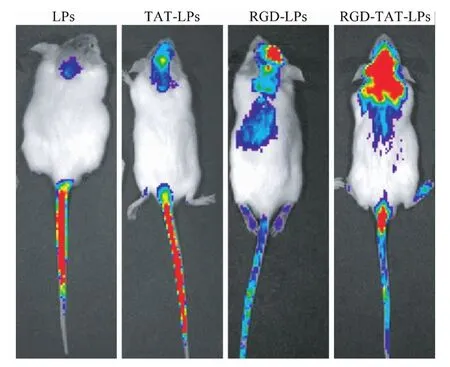
图3 载DIR的不同类型的脂质体在小鼠体内的分布Fig.3 EX vivo images of given various DIR loaded liposomes
3 讨论
本研究将RGD与TAT通过一个半胱氨酸连接成序列为RGDCRKKRRQRRR的短链多肽,将RGD-TAT连接到脂质体表面,首先利用RGD的识别能力与肿瘤细胞结合,再利用穿膜肽TAT的高效穿膜作用介导脂质体进入肿瘤细胞。
结果显示,制备得到的脂质体的粒径为115 nm左右。有研究显示纳米载体的粒径范围在10~150 nm能够有效避开网状内皮系统的吞噬,通过EPR效应到达肿瘤组织[18]。在细胞摄取试验中,与其他脂质体组比较,经过RGD或者TAT修饰都能够显著增强脑胶质瘤细胞对脂质体的摄取,RGD-TAT修饰脂质体的摄取效率显著高于RGD或者TAT修饰的脂质体,这说明将RGD肽和TAT肽串联后能够发挥协同作用,共同促进入胞。本实验研究了脂质体进入细胞后在细胞内的分布情况,结果显示,TAT修饰脂质体和RGD-TAT修饰脂质体在溶酶体部位荧光最弱,说明RGD-TAT修饰的脂质体能够和TAT修饰脂质体一样发挥溶酶体逃逸作用[19]。本实验还构建了脑胶质瘤原位肿瘤模型,通过近红外成像实验研究共修饰脂质体的体内分布。结果与体外研究结果一致,RGD-TAT修饰脂质体在小鼠脑部的荧光强度显著强于其他脂质体组。综上,RGD-TAT修饰脂质体是一种潜在的高效肿瘤靶向给药系统。
[1]Yao Q,Chen H,Zhang Q,et al.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeutic efficacy on brain glioma in animals[J].Int JPharm,2011,420(2):304-312.
[2]Shah N,Chaudhari K,Dantuluri P,et al.Paclitaxel-loaded PLGA nanparticles surfacemodified with transferrin and Pluronic-P85,an in vitro cell line and in vivo biodistribution studies on rat model[J].J Drug Target,2009,17(7):533-542.
[3]Raymond M,Molema G,ten Hagen TL,etal.Ligand-targeted liposomes directed against pathological vasculature[J].JLiposome Res,2002,12(8):129-135.
[4]Xiao BX,Huang Y,Lu WL,et al.Enhanced Intracellular Uptake of Sterically Stabilized Liposomal Doxorubicin[J].Pharma Res,2005,6(5):933-939.
[5]Oba M,Fukushima S,Kanayama N,et al.Cyclic RGD peptideconjugated polyplex micelles as atargetable gene delivery system directed to cells possessingαvβ3 andαvβ5 integrins[J].Bioconjug Chem 2007,18(5):1415-1423.
[6]Ying X,Wen H,Lu WL,et al.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].J Controlled Release,2010,141(2):183-192.
[7]Chee WG,Feng SS.Transferrin-conjugated nanoparticles of Poly(lactide)-D-a-Tocopheryl polyethylene glycol succinate diblock copolymer for targeted drug delivery across the blood-brain barrier[J].Biomaterials,2010,31(30):7748-7757.
[8]Ulbrich K,Hekmatara T,Herbert E,et al.Transferrin-and transferrin receptor-antibody-modified nanoparticles enable drug delivery across the blood-brain barrier(BBB)[J].Eur JPharm Biopharm,2009,71(2):251-256.
[9]Kuai R,Yuan W,Li W,et al.Targeted Delivery of Cargoes into a Murine Solid Tumor by a Cell-Penetrating Peptide and Cleavable Poly(ethylene glycol)Comodified Liposomal Delivery System via Systemic Administration[J].Mol.Pharm,2011,8(6),2151-2161.
[10]Kuai R,Yuan W,Qin Y,et al.Efficient Delivery of Payload into Tumor Cells in a Controlled Manner by TAT and Thiolytic Cleavable PEG Co-Modified Liposomes[J].Mol Pharm,2010,7(5),1816-1826.
[11]Li Z.Lipid-polymer hybrid nanoparticles:synthesis,characterization and applications[J].Nano LIFE,2010,1(1):163-173.
[12]Vladimir T.Tumor delivery ofmacromolecular drugs based on the EPR effect[J].Adv Drug Deliv Rev,2011,63(3),3131-135.
[13]Gao HL,ShuaiQP,Zhi Y,et al.A cascade targeting strategy for brain neuroglial cells employing nanoparticles modified with angiopep-2 peptide and EGFP-EGF1 protein[J].Biomaterials,2011,32(33):8669-8675.
[14]R.K.Jain.Angiogenesis in brain tumors[J].Nat.Rev.Neurosci,2007,8(8):610-622.
[15]Tamara M,Patil ML,Zhang M,et al.LHRH-Targeted Nanoparticles for Cancer Therapeutics[J].MethodsMol Biol,2010,624(281):281-294.
[16]Chang SF,Guo J,Sun J,et al.Targeted microbubbles for ultrasound mediated gene transfection and apoptosis induction in ovarian cancer cells[J].Ultrason Sonochem,2013,20(1):171-179.
[17]Jiang X,Xin H,Gu J,et al.Solid tumor penetration by integrinmediated pegylatedoly(trimethylene-carbonate)nanoparticles loaded with paclitaxel[J].Biomaterials,2013,34(6):1739-1746.
[18]M.Al Soraj,He L,Peynshaert K,et al.siRNA and pharmacological inhibition of endocytic pathways to characterize the differential role of macropinocytosis and the actin cytoskeleton on cellular uptake of dextran and cationic cell penetrating peptides octaarginine(R8)and HIV-Tat[J].JControlled Release,2012,161(1):132-141.
[19]Zhang QY,Tang J,Fu L,et al.A pH-responsive a-helical cell penetrating peptide-mediated liposomal delivery system[J].Biomaterials,2013,34(32):7980-7993.
(编校:李璐璐)
Construction of RGD-TAT modified liposomes and evaluation of its targeting on glioma
HUANG Ji-chun1,CAIHua-rong2,JIANG Yue-quan2Δ
(1.Department of Nursing,Chongqing Medical and Pharmaceutical College,Chongqing 401331,China;2.Chongqing Cancer Institute,Chongqing 404000,China)
ObjectiveTo construct RGD-TATmodified liposomes(RGD-TAT-LPs)and evaluate its glioma targeting efficiency.MethodsRGDTAT-LPswas constructed by film-ultrasonicmethod,its appearance,particle size and Zeta potentialweremearsured.Cellular uptake of LPs,TAT-LPs,RGD-LPs and RGD-TAT-LPswas used to evaluate the affinity to C6 cells.C6 cellswere xenografted in athymicmice to establish the animalmodel,which were used to evaluate the distribution of liposomes in vivo.ResultsThe particle diameter of RGD-TAT-LPs was(116.5±11.3)nm,and its Zeta potentialwas(23.2±3.5)mV.Cellular uptake experiments demonstrated the cell uptake efficiency of RGD-TAT-LPs by C6 cellswere 2.9-fold,2.3-fold and 4.7-fold than that of RGD-LPs,TAT-LPs and LPs respectively.The in vivo imaging showed that RGD-TAT-LPs had the strongest fluorescence intensity in brain.ConclusionThe RGD-TAT-LPsmight serve as a promising delivery system of antitumor drugs.
integrins receptor;cell-penetrating peptides;drug targeting
R73-3
A
1005-1678(2014)03-0001-03
过去几十年,随着现代生物研究的发展,肿瘤疾病的治疗手段日益丰富。探寻新型肿瘤主动靶向治疗载体成为了当前研究的热点[1-2]。有研究表明,肿瘤细胞表面整合素受体高度表达[3-4],且这些整合素受体被广泛用于肿瘤的靶向治疗靶点[5]。由于RGD与肿瘤细胞表面的整合素受体结合具有饱和效应[6],因此脂质体入胞效率受到一定的限制。TAT是一种细胞穿膜肽,能够高效穿过所有细胞膜,但是对肿瘤细胞无选择性[7-8]。在脂质体上连接TAT肽后可以促进脂质体高效入胞[9-11],但由于TAT入胞的非特异性,其可以穿透任何细胞,缺乏选择性,且修饰了TAT的脂质体在血液循环中会迅速被网状内皮系统(reticuloendothelial system,RES)摄取,导致其肿瘤蓄积较低[12]。RGD肽是一种能够特异性识别肿瘤细胞表面整合素受体的环状三肽[13]。已经被广泛用于肿瘤靶向治疗研究[14-16]。本研究旨在将RGD与TAT串联成一条直链多肽,共同发挥RGD对肿瘤细胞的识别能力和TAT的穿膜作用,实现高效的靶向给药。
国家自然科学基金(30970843)
黄吉春,女,硕士,讲师,研究方向:肿瘤的靶向治疗,E-mail:jjichun2000@126.com;江跃全,通信作者,男,博士,主任医师,研究方向:肿瘤的靶向治疗,E-mail:caihuarong1977@163.com。
