单药希罗达治疗晚期结直肠癌的临床疗效及相关因素分析
2014-09-18韩利江宋新江
韩利江,宋新江
(绍兴第二医院 肛肠外科,浙江 绍兴 312000)
单药希罗达治疗晚期结直肠癌的临床疗效及相关因素分析
韩利江,宋新江
(绍兴第二医院 肛肠外科,浙江 绍兴 312000)
目的观察希罗达单药治疗晚期结直肠癌的临床疗效,探讨影响近期疗效的相关因素。方法78例晚期结直肠癌患者予以口服希罗达每日2500 mg/m 2,分早晚各1次,餐后服用,连续服用14天后停药7天。治疗周期为21天,至少治疗2个周期。观察患者近期疗效,采用Logistic回归分析影响疗效的因素。结果本组完全缓解(complete response,CR)5例,部分缓解(partial response,PR)20例,病情稳定(stable disease,SD)31例,病情进展(progress disease,PD)22例,总有效率32.05%。Logistic回归分析显示希罗达治疗无效的独立危险因素有年龄(OR=1.52,95%CI 1.015~2.319)、空腹血糖(OR=1.30,95%CI 1.483~3.677)、白蛋白(OR=1.98,95%CI 1.526~2.572)、丙氨酸氨基转移酶(OR=2.37,95%CI 1.621~3.509)、门冬氨酸氨基转移酶(OR=2.21,95%CI 1.526~2.572)。结论希罗达单药治疗晚期结直肠癌疗效确切,但治疗无效率也较高,与多种因素有关,应对患者病情进行综合评估,采用有效的治疗方法,以提高近期临床疗效。
希罗达;晚期结直肠癌;临床疗效
结直肠癌是消化道常见恶性肿瘤之一,位列我国癌症发病第4位,死亡率位列第5位,且仍处于逐年上升趋势[1-2]。尽管本病的化疗方案很多,但疗效不确切[3],尤其是晚期癌症患者对传统化疗方案不良反应强,难以耐受。希罗达(卡培他滨)一种新型口服氟嘧啶氨基甲酸酯,通过其独特的作用机制在多种肿瘤细胞中优先活化为5-氟尿嘧啶(5-Fu),一方面提高了肿瘤内的药物浓度,发挥杀伤肿瘤细胞作用;另一方面明显降低正常组织中的药物浓度,减少毒副作用[4],是治疗结直肠癌安全、有效的化疗药物[5-6]。本研究目的是观察单药希罗达治疗晚期结肠癌患者的临床疗效及影响其治疗功效的相关因素。
1 研究对象与方法
1.1 一般资料 经伦理委员会批准,入选78例晚期结直肠癌患者,均经病理学明确诊断,其中75例出现多脏器转移(肝脏、肺、淋巴结、肋骨等)。男性41例,女性37例,年龄30~75岁,平均年龄(55±8.6)岁。所有患者Kamofsky评分≥60分,至少有一个可测量病灶,1个月内未接受其他抗肿瘤治疗,骨髓造血功能、肝肾功能基本正常,预计生存期≥3个月。
1.2 排除标准 中枢神经系统转移者;未控制的急性感染;合并其他恶性肿瘤;合并心力衰竭;对氟尿嘧啶过敏或代谢障碍者;有神经或精神病史不能合作者;妊娠或哺乳期妇女。
1.3 治疗方法 所有入选的晚期结直肠癌患者均采用希罗达单药治疗,每日2500 mg/m2,分早晚各1次,餐后服用,连续服用14 d后停药7 d。治疗周期为21 d,一般至少治疗2个周期。如患者出现不良反应,应暂时停药并及时到医院就诊。4个治疗周期后评价疗效。
1.4 疗效与不良反应判断标准 按WHO实体瘤近期客观疗效评价标准,分完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和病情进展(progress disease,PD),有效为CR+PR,并且在间隔至少4周后复查证实;不良反应按NCICTC分级系统。治疗前后记录所有患者血常规、尿常规、血糖、血脂、心电图(ECG)、CT 或MRI衡量靶病灶情况及 Kamofsky 评分。
1.5 影响疗效相关因素分析 将治疗后SD和PD患者作为治疗无效组,将CR和PR者作为治疗有效组,比较两组的相关暴露因素,包括年龄、性别、血糖、血脂、总蛋白、白蛋白、白细胞数、红细胞数、血红蛋白、肝肾功能等。
1.6 统计学方法 所有数据采用SPSS 16.0统计学软件进行统计分析,临床疗效以率表示,采用χ2检验;治疗无效组和治疗有效组的相关暴露因素采用单因素χ2检验或t检验,然后进行多因素 Logistic回归分析。P<0.05表示差异有统计学意义。
2 结果
2.1 近期疗效及不良反应 所有78例患者均顺利完成化疗方案,并完成临床疗效评估,其中CR5例,PR 20例,SD 31例,PD 22例,总有效率为32.05%(25/78)。不良反应见表1。

表1 希罗达单药治疗78例晚期结直肠癌患者后不良反应(n=78)Tab.1 Xeloda (Capecitabine) Single drug adverse reactions after treatment of 78 cases of patients with advanced colorectal cancer(n=78)
2.2 治疗无效组和治疗有效组之间的相关因素分析 4个治疗周期结束后,将31例SD和22例PD作为治疗无效组(53例),5例CR和20例PR(25例)作为治疗有效组,对2组的相关暴露因素进行分析。结果显示(见表2):2组的年龄、空腹血糖、白蛋白、血红蛋白、丙氨酸氨基转移酶、门冬氨酸氨基转移酶和血肌酐比较差异具有统计学意义(P<0.05),但2组的性别、血脂、总蛋白、细胞计数及尿素氮比较差异无统计学意义。
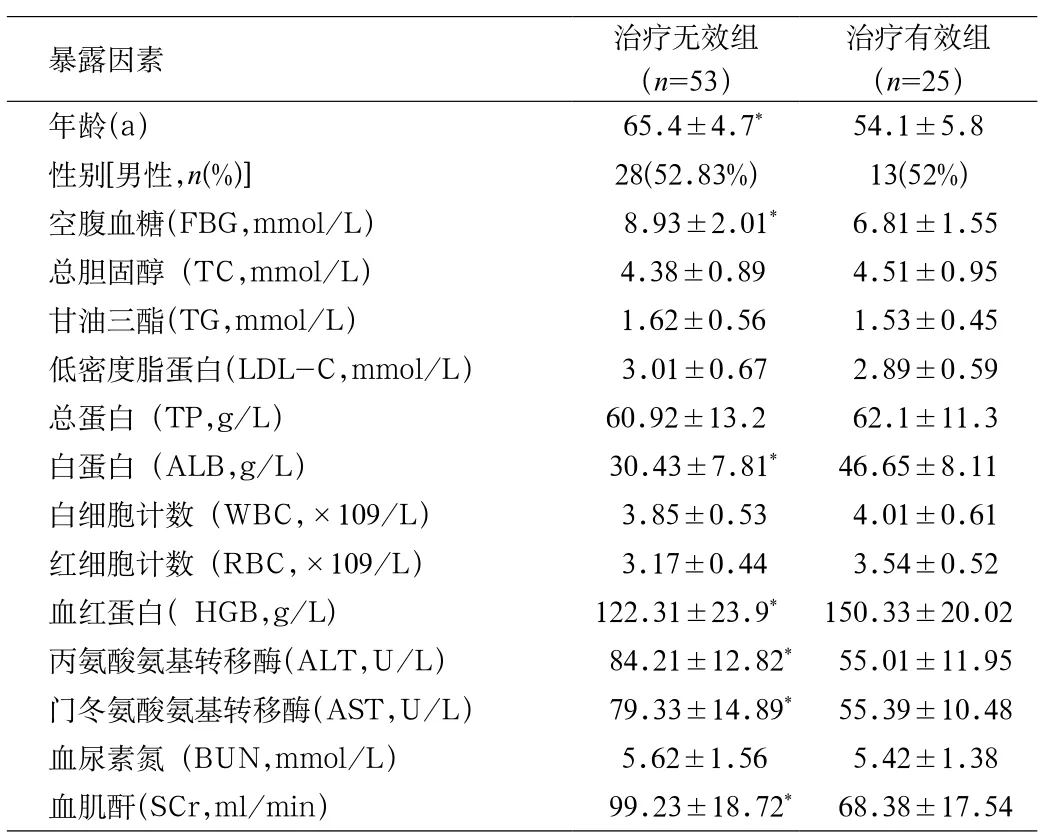
表2 希罗达治疗无效组合治疗有效组直接的相关因素分析Tab.2 Xeloda (Capecitabine) Invalid combination of effective treatment group of relevant factors analysis directly
2.3 希罗达治疗无效相关因素的Logistic回归分析Logistic回归分析显示希罗达治疗无效的独立危险因素有年龄、空腹血糖、白蛋白、ALT及AST(P<0.05,见表3)。

表3 希罗达治疗无效相关因素的 Logistic 回归分析(n=78)Tab.3 Xeloda (Capecitabine)Logistic regression analysis for the treatment of invalid related factors(n=78)
3 讨论
晚期结直肠癌侵及附近组织器官,出现相应的临床表现,如侵犯前列腺及膀胱组织,可致排尿困难、尿急、尿频等;如侵及骶前神经丛,则出现腰和骶尾部疼痛;若癌细胞转移至肝脏,可引起肝脏肿大、黄疸和腹水,最终导致恶病质的发生[2],加之广泛放疗与大剂量化疗药物的毒副作用,使晚期结直肠癌患者痛不欲生,严重影响患者的生活质量和治疗依从性。
希罗达(卡培他滨)是新一代口服选择性氟化嘧啶类抗肿瘤药,口服后,药物以原药形式经胃肠道吸收,在肝脏内被羧酸酯酶代谢成为脱氧氟胞苷,然后经肝脏和肿瘤组织内的胞苷脱氨基酶代谢为脱氧氟尿苷,最后选择性地在肿瘤组织中通过胸腺嘧啶磷酸化酶促反应由脱氧氟尿苷代谢为 5-氟尿嘧啶(5-FU)[7]从而影响肿瘤细胞DNA及RNA合成,发挥抗肿瘤作用。研究表明[8-9],结直肠其患者服用希罗达后,癌组织中5-FU浓度是邻居正常组织的3倍,是血浆浓度的20倍。是其他组织的8~10倍,因此希罗达具有靶向抗肿瘤作用。本研究78例患者中,CR5例,PR 20例,SD 31例,PD 22例,总有效率32.05%,与TrelvesC,Cox JV[10-11]报道相似。主要不良反应为手足综合征、过敏性皮炎、细胞减少、恶性呕吐及腹泻,发生率依次为37.18%、33.33%、29.48%、14.10%和14.10%。然而梁昱[12]报道希罗达治疗后的毒副反应可通过调整剂量及推迟给药可得到克服,且并不影响疗效。
为深入评价希罗达单药治疗晚期结直肠癌的近期疗效,本研究进一步分析治疗无效的可能相关因素。结果显示影响近期临床疗效的因素有年龄、空腹血糖、白蛋白、丙氨酸氨基转移酶及门冬氨酸氨基转移酶水平。随着年龄增长,患者胃肠道吸收能力及肝脏代谢作用均降低,引起药物吸收率和利用率下降[13];血糖升高、低蛋白血症以及肝功能异常亦对药物的吸收、转运和利用产生不利影响,甚至可能增加药物的不良反应。因此,对于结直肠癌晚期患者,改善自身代谢状况、保护肝功能可以有效提高希罗达治疗的有效率[14]。
综上所述,单药希罗达治疗晚期结直肠癌疗效显著,不良反应少[15]。治疗无效与有年龄、空腹血糖、白蛋白、丙氨酸氨基转移酶及门冬氨酸氨基转移酶水平有关。在化疗过程中,应结合患者的临床表现及实验室指标等,对其进行综合评估,适时调整化疗药物剂量及化疗方案,以提高临床疗效,降低不良反应发生,改善预后。
[1] Obrand DI,Gordon PH.Incidence and patterns of recurrence following curative resection for colorectal carcinoma [J].Dis Colon Retum,1997,40(1):15-24.
[2] 刘涛.希罗达联合奥沙利铂治疗32例老年晚期结直肠癌的疗效分析[J].中国医药指南,2013,13(11):200-201.
[3] 唐东霞,李庆云.希罗达联合奥沙利铂治疗晚期结直肠癌的临床观察[J].中国现代药物应用,2007,1(4):34.
[4] Miwa A,Ura M,Nishida M,et al.Design of a novel oral fluoropyrimidine carbamate,capecitabine,which generates 5-fluorouracil selectively in tumours by enzymes concentrated in human liver and caner tissue[J].Eur J Cancer,1998,34(8):1274-1281.
[5] Hoff PM,Ansari R,Batist G,et al.Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer:results of a randomized phase Ⅲ study[J].J Clin Oncol,2001,19(8):2282-2292.
[6] Van CE,Twelves C,Cassidy J,et al.Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer results of a randomized phase Ⅲ study[J].J Clin Oncol,2001,19(8):4097-4106.
[7] Ebi H,Sigeoka Y,Saeki T,et al.Pharmacokinetic and pharmacodynamic comparison of fluoropyrimidine derivatives capecitabine and 5’-deoxy-5-fluorouridine (5’-DFUR).Cancer Chemother Pharmacol,2005,(56):205-211.
[8] Schuller J,Cassidy J,Dumont E,et al.Preferential activation of Capecitabine in tumor following oral administration to colorectal cancer patients[J].Cancer Chemother Pharmacol,2000,45(4):291-297.
[9] Sauer R,Becker H,Hohenberger W,et al.Preoperative versus postoperative chemoradiotherapy for rectal cancer[J].M Engl J Med,2004,(351):1731-1740.
[10] Trelves C,Harper P,Vanvutsen E,et al.A phase Ⅲ trial (so 14796) of xeloda (Capecitabine) in previously untreated advanced/metastatic colorectal cancer[J]. Proc Am Soc Clin Oncol,1999,18(1):1010-1014.
[11] Cox JV,Pazdur R,Thibault A,et al.A phase Ⅲ trial of xeloda (Capecitabine) in previously untreated advanced/metastatic colorectal cancer[J].Proc Am Soc Clin Oncol,1999,18(1):1016-1018.
[12] 梁昱.单药口服希罗达对晚期转移性结直肠癌患者第一线化疗的临床研究[J].实验临床医学,2007,12(8):25-27.
[13] 王光华.希罗达治疗老年结直肠癌肝转移临床观察[J].中国中医药咨讯,2012,04(4):87.
[14] 梁显军,刘铜军,郭帅.希罗达在老年结直肠癌患者中的应用[J].中国老年学杂,2008,28(8):821.
[15] 魏燕,徐周敏,陈坚,等.结直肠癌肝转移围手术期化疗研究进展[J].实用医学杂志,2012,28(20):3481-3483.
The clinical effects of single-agent Xeloda (Capecitabine) and related risk factors in treatment of patients with advanced colorectal cancer
HAN Li-jiang,SONG Xin-jiang
(Department of Anorectal Surgery, The Second Hospital of Shaoxing, Zhejiang 312000,China)
ObjectiveTo explore the clinical effects of single-agent Xeloda (Capecitabine) therapy and the related risk factors in patients with advanced colorectal cancer。MethodSeventy-eight patients with advanced colorectal cancer were treated with oral Xeloda, 1250 mg/m 2 twice daily, on days 1-14 every 21 days. At least 2 cycles were administered. The short-term clinical effects were evaluated, and the related risk factors were tested by Logistic regression analysis。ResultsThe overall response rate was 32.05% with 5 cases complete response (CR), 20 cases partial response (PR), 31 cases stable disease (SD), 22 cases progress disease (PD). The Logistic regression analysis showed that the age (OR=1.52, 95%CI 1.015~2.319), fast blood glucose (OR=1.30, 95%CI 1.483~3.677), albumin (OR=1.98, 95%CI 1.526~2.572), ALT (OR=2.37, 95%CI 1.621~3.509) and AST (OR=2.21, 95%CI 1.526~2.572) were independent risk factors for inef fi cient treatment。ConclusionThe single-agent Xeloda (Capecitabine) is an ef fi cacious treatment for the patients with advanced colorectal cancer. However, the inef fi cient rate is also high and it relates to a variety of factors. We should comprehensively evaluate the patients to improve the short-term clinical effects.
Xeloda (Capecitabine); advanced colorectal cancer; clinical effects
R 735;R 735.3
B
1005-1678(2014)01-0111-03
韩利江,男,本科,主治医师,研究方向:肛肠外科疾病的防治,E-mail:76051228@qq.com。
