锌指转录因子Snail在喉癌中的表达及其与不同亚群喉癌细胞侵袭和转移的相关性研究
2014-09-18于丹刘岩赵雪程金章齐欣萌金春顺
于丹,刘岩,赵雪,程金章,齐欣萌,金春顺
(吉林大学 第二临床医院 耳鼻咽喉头颈外科,吉林 长春 130041)
锌指转录因子Snail在喉癌中的表达及其与不同亚群喉癌细胞侵袭和转移的相关性研究
于丹,刘岩,赵雪,程金章,齐欣萌,金春顺△
(吉林大学 第二临床医院 耳鼻咽喉头颈外科,吉林 长春 130041)
目的探讨锌指转录因子Snail在喉鳞状细胞癌中的表达情况及其与临床特征的关系,通过检测不同喉癌细胞亚群中Snail的表达研究其与喉癌侵袭转移的相关性。方法免疫组化法检测吉林大学第二医院耳鼻咽喉头颈外科48例喉癌组织和20例癌旁对照组织手术标本Snail蛋白的表达情况,并分析Snail与临床特征的相关性。采用RT-PCR及Western blot和细胞免疫化学染色检测CD 44+CD 133+、CD 44-和CD 133-不同亚群喉癌细胞中Snail和粘附分子E-cadherin的表达情况,并与侵袭及转移进行相关性探讨。结果Snail在喉癌组织中表达水平显著高于癌旁对照组织(P<0.01)。Snail的表达与喉癌的临床分期、淋巴结转移、肿瘤分化程度密切相关(P<0.05),而与患者的性别、年龄、临床分型等无关。RT-PCR及Western blot检测结果均证实,Snail在CD 44+CD 133+喉癌细胞中的表达水平明显高于CD 44-和CD 1333-喉癌细胞,而粘附分子E-cadherin在CD 44+CD 133+喉癌细胞中的表达水平明显低于CD 44-和CD 133-喉癌细胞,细胞免疫组化染色证实CD 44+CD 133+喉癌亚群细胞中Snail和E-cadherin的表达呈负相关。结论Snail的表达与喉癌的侵袭转移密切相关,且在高致瘤亚群CD 44+CD 133+喉癌细胞中呈显著高表达,与粘附分子E-cadherin的表达呈负相关,与喉癌细胞的侵袭和转移具有密切相关性。
喉癌;Snail;E-cadherin;肿瘤转移;上皮细胞-间质转化
1 资料和方法
1.1 一般资料 随机选取吉林大学第二医院2011年1月~2013年10月48例喉鳞状细胞癌患者癌组织和20例同期手术病例的癌旁组织进行SP染色,每例患者均有明确的临床分型、病理诊断及详细的病历资料(所有患者资料的选取已经过伦理委员会批准),临床分期采用2002年抗癌国际联盟(UICC)正式颁布的喉癌TNM分期法。患者术前均未接受放疗和化疗,男性33例,女性15例,年龄51~67岁,平均59.21±2.34岁。将Hep-2喉癌细胞应用带有荧光的细胞表面抗原CD 133和CD 44标记,应用流式细胞分选技术分选为CD 133+CD 44+细胞组、CD 44-细胞和CD 133-细胞组。
1.2 实验试剂及用品 SP免疫组化试剂盒购自长春百奥生物技术公司。Snail、E-cadherin和GAPDH引物均由上海生工生物技术有限公司合成。Snail和E-cadherin单克隆抗体购自SantaCruz公司。RPMI 1640培养基及胎牛血清购自美国Gibco公司。藻红蛋白(phycoerythrobilin,PE)抗鼠CD 133及异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)抗鼠CD 44购自美国 Gene Tex公司。
1.3 实验方法
1.3.1 免疫组化SP法 具体方法详见试剂盒说明书。结果判定:Snail阳性信号为细胞核及细胞质内棕黄色颗粒,每张切片高倍镜下随机选取10不同的视野,按阳性细胞数占视野中总细胞数的百分比计分。阳性细胞率<10%为1分,10%<阳性细胞率≤50%为2分,50%<阳性细胞率≤75%为3分,阳性细胞率>75%为4分;同时,根据染色的强弱程度计分:阴性1分,弱染色2 分,中等强度染色3分,强染色4分。通过二者的乘积来判断结果:≤4分为(-);5~8分为(+);9~12分为(++);13~16 分为(+++)。
1.3.2 逆转录聚合酶链反应(P T-P C R)和Western blot法检测Snail和E-cadherin基因在各亚群喉癌细胞中的表达:针对人 Snail基因的 cDNA序列(5’-AGAGTTTACCTTCCAGCCCCTACGACCAG GCCC-3’;5’-AAGGCCTTCAACTGCAAATACTG CAA-3’)片断长度为315 bp。针对人E-cadherin基因cDNA序列(5’-GGCATTGGGAAGAATCAGCC-3’;5’-ATTGATGTGTCCAATGGCCG-3’)片段长度:4 8 7 b p。以 GA P D H为内参基因,其上游引物序列为5’-CTGGGACGACATGGAGAAAA-3’,下游引物序列为 5’-AAGGAAGGCTGGAAGAGTGC-3’,片断长度为600 bp。PCR扩增条件为热变性94℃5 min;94℃30 s,56℃30 s,72℃1 min,30~35个循环,72℃4 min。取5µL反应产物进行2%琼脂糖凝胶电泳分析。Westernblot法常规提取蛋白,Bradford法进行蛋白定量。蛋白电泳,电转膜后用0.01 mol/L的 PBS洗膜3次,8%脱脂奶粉室温封闭2 h,加入一抗(1∶1000),4℃过夜,洗膜3次,加入二抗(1∶1000),37℃孵育1 h,洗膜3次,按化学发光(ECL)试剂盒说明操作,显影、定影、冲洗、晾干后进行灰度扫描。
1.3.3 细胞培养及流式细胞仪分选:应用含10%胎牛血清的1640培养基常规行Hep-2喉癌细胞培养,各个喉癌细胞亚群的流式细胞仪分选步骤详见参考文献[4]。
1.3.4 免疫细胞化学染色 将流式细胞仪分选得到的CD 44+CD 133+细胞常规培养并以1×104/孔密度接种于24孔板内的盖玻片上,待细胞生长至80%融合后,PBS冲洗盖玻片,4%多聚甲醛固定30 min,PBS洗涤3次后经3%过氧化氢孵育10 min,PBS冲洗3次后10%正常山羊血清室温封闭20 min,滴加一抗(1∶50鼠抗人Snail抗体和1∶100鼠抗人E-cadherin抗体)。4℃过夜后,按SP免疫组化染色试剂盒说明操作,DAB染色,苏木精复染,棕褐色为阳性显色。
1.4 统计学方法 各组正态计量资料均采用“x±s”表示,KS 400图像系统进行灰度分析,用SPSS 10.0统计学软件进行统计分析。所得数据百分率的比较用χ2检验。检验水准α=0.05。采用单因素方差分析及各组间比较。
2 结果
2.1 免疫组化分析Snail蛋白在喉癌组织中的表达 免疫组化染色结果:Snail蛋白在癌旁对照组织中染色呈阴性或弱阳性,Snail蛋白阳性表达主要集中在癌细胞核及细胞质内,镜下呈现棕黄色或者棕色颗粒。在高分化喉癌组织中表现为弱染色和或中等强度染色,在中低分化喉癌组织中,多表现为强染色(见图1)。

图1 免疫组化检测喉癌组织中Snail的表达1 a 癌旁组织中表达较少(×200);1 b.高分化喉癌组织中为弱染色(×200);1 c.中分化鳞状细胞癌中呈现较强染色(×200);1 d.低分化鳞状细胞癌中呈现强染色(×200)Fig.1 Analysis of Snail protein expression by immunohistochemistry in laryngeal carcinomas1 a Negative Snail staining in adjacent non-cancerous epithelial tissue sample (×200);1 b.weak positive Snail staining in well differentiated laryngeal carcinoma (×200);1 c.Positive Snail staining in moderately differentiated laryngeal carcinoma (×200);1 d.Strong Positive Snail staining in poorly differentiated laryngeal carcinoma (×200)
2.2 Snail因子在喉鳞状细胞癌中的表达与临床特征的相关性 Snail的表达与喉癌的临床特征的相关性见表1所示。
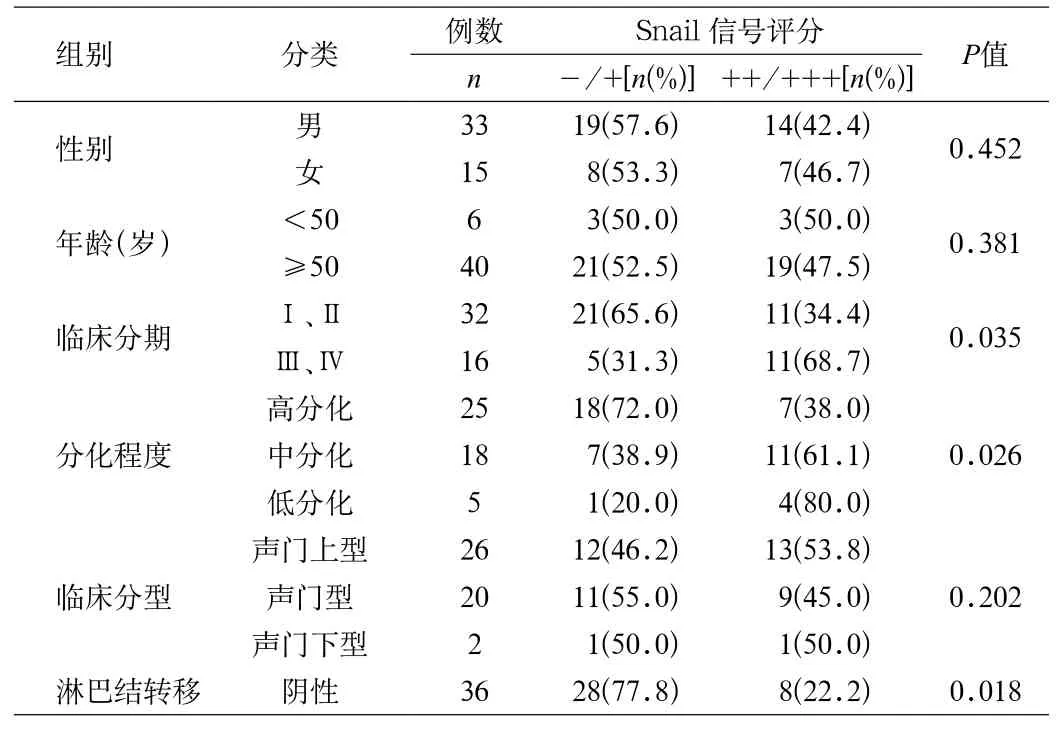
表1 Snail蛋白的表达与喉鳞状细胞癌临床特征的相关性Tab.1 The correlation between the Snail expression and clinical characteristics of laryngeal carcinoma
2.3 Snail和E-cadherin在各亚群喉癌细胞中的表达情况 RT-PCR及Western blot检测结果均证实,各亚群喉癌细胞中Snail和E-cadherin mRNA和蛋白质水平均有不同程度的表达(见图2及表2),Snail在CD 44+CD 133+喉癌细胞中的表达水平明显高于CD 44-和CD 1333-喉癌细胞,而粘附分子E-cadherin在CD 44+CD 133+喉癌细胞中的表达水平明显低于CD 44-和CD 133-喉癌细胞组(图2 a和图2 b),且差异均具有统计学意义(P<0.05)。

表2 各亚群细胞中Snail 和E-cadherin mRNA灰度值及蛋白表达量Tab 2. The expression of mRNA and protein of Snail and E-cadherinin in subgroups of laryngeal carcinoma cells
以GAPDH蛋白表达量为对照(设为1.000),在上样蛋白量基本一致的条件下,各亚群细胞中Snail和E-cadherin蛋白均有不同程度的表达。
2.4 细胞免疫化学染色检测CD 44+CD 133+喉癌细胞亚群中Snail和E-cadherin的表达情况 CD 44+CD 133+喉癌细胞亚群中Snail呈现高表达,胞浆和胞核被染成深浅不一的棕黄色;而E-cadherin呈弱阳性表达(见图3)。

图2 a 各亚群喉癌细胞中Snail 和E-cadherin mRNA的表达M.1 kb DNA Ladder;1.CD 44-喉癌细胞中Snail 和E-cadherin的表达;2.CD 133-喉癌细胞中Snail和E-cadherin 的表达;3.CD 44+CD 133+喉癌细胞中Snail和E-cadherin的表达Fig.2 a Snail and E-cadherin mRNA expression in different subgroup laryngeal carcinoma cellsM.1 kb DNA ladder;1.Snail and E-cadherin mRNA expression in CD 44- laryngeal carcinoma cells;2.Snail and E-cadherin mRNA expression in CD 133-laryngeal carcinoma cells;3.Snail and E-cadherin mRNA expression in CD 44+CD 133+laryngeal carcinoma cells
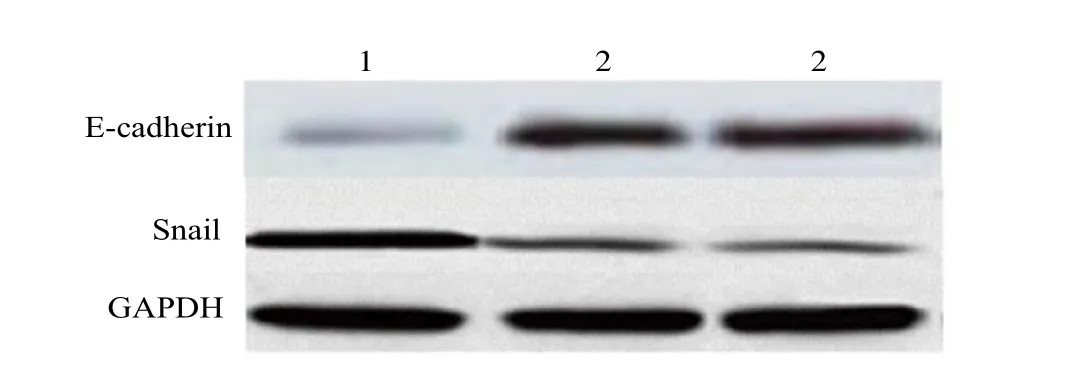
图2 b 各亚群喉癌细胞中Snail和E-cadherin蛋白的表达1.CD 44+CD 133+喉癌细胞中Snail和E-cadherin 蛋白质的表达;2.CD 44-喉癌细胞中Snail和E-cadherin的表达;3.CD 133-喉癌细胞中Snail和E-cadherin的表达Fig.2 b The expression of Snail and E-cadherin protein in different subgroup laryngeal carcinoma cells1.The expression of Snail and E-cadherin protein CD 44+ CD 133+inlaryngeal carcinoma cells;2.Snail and E-cadherin mRNA expression in CD 44- laryngeal carcinoma cells;3.Snail and E-cadherin mRNA expression in CD 133- laryngeal carcinoma cells

图3 CD 44+CD 133+喉癌细胞亚群中Snail和E-cadherin的表达情况3 a. Snail在胞核及胞质可见高表达,表现为棕黄色颗粒(×200);3 b.E-cadherin表达在细胞膜,呈弱阳性表达(×200);3 c.CD 44+CD 133+喉癌细胞阴性对照(×200)Fig.3 The expression of Snail and E-cadhein in CD 44+CD 133+ of laryngeal carcinoma cells3 a. Strong Positive Snail staining in cytoplasm and cell nucleus of CD 44+CD 133+ laryngeal carcinoma cells(×200);3 b.weak positive E-cadherin staining on the surface of cell membrane in CD 44+CD 133+ laryngeal carcinoma cells (×200);3 c.negtive control of CD 44+CD 133+ laryngeal carcinoma cells (×200)
3 讨论
喉癌是东北地区患病率较高的恶性肿瘤之一,占全身恶性肿瘤的5.7%~7.6%[5],其发病率居头颈部肿瘤第三位。随着临床医学的不断发展,喉癌的综合治疗方式(包括手术及放、化疗方案)得到不断改进,但局部复发和淋巴结转移仍是喉癌患者主要的死亡原因。因此,研究喉癌的转移机制并寻找新的治疗靶点是我们迫切需要解决的问题 。目前,“肿瘤干细胞”学说认为:肿瘤细胞具有异质性,具有肿瘤干细胞特性的细胞亚群有较强的侵袭和转移能力[6],是肿瘤复发和转移的根源所在,而EMT是肿瘤干细胞侵袭、转移早期的重要启动步骤。EMT过程中首先是与细胞粘附有关的细胞因子的表达下调使连续的上皮层细胞间作用变松散,从原发部位脱落,其次是上皮细胞分子构成改变,使细胞获得侵袭和运动能力。在此过程中,E-cadherin下调起到了关键作用。细胞黏附分子E-cadherin蛋白是一种钙依赖性细胞黏附分子[7],分布在上皮组织中,而锌指转录因子Snail则通过与E-cadherin上游启动子区结合而转录抑制其表达[8]。人们首先在果蝇中发现了锌指转录因子Snail的存在,在原肠胚形成中,可以通过转录抑制E-cadherin表达,促进细胞从相邻细胞脱落并迁移至远处[9-10]。由于在肿瘤转移中也存在癌细胞脱落、转移的事件发生,因此引起了广大肿瘤研究者对Snail/ E-cadherin通路在肿瘤转移中作用的研究兴趣。研究证实[11]:通过RT-PCR检测Snail的表达,证实在伴有淋巴结转移的乳腺癌组织中,Snail的表达明显增高,E-cadherin表达下降,二者呈负相关。卓文磊等[12]发现:高侵袭性人肺腺癌A 549细胞株高表达Snail,而E-cadherin呈低表达,提示Snail/E-cadherin通路与肿瘤侵袭和转移相关。研究证明在肝癌细胞中,Snail不仅通过抑制E-cadherin的表达来介导EMT的发生,还通过调控基质金属蛋白酶家族成员的表达来增加肝癌细胞的侵袭能力,在肝癌细胞的侵袭和转移中起重要作用[13]。夏曦等[14]研究表明:将PEGFPC 1/Snail转染入卵巢癌细胞株A 2780后,细胞内E-cadherin的表达明显下调,而转染Snail/siRNA入卵巢癌细胞株,则使E-cadherin表达明显上调,提示Snail因子的表达与卵巢癌细胞转移具有相关性。
在本项研究中,首先采用免疫组化SP方法检测喉癌组织中Snail的表达,并观察与喉癌临床病理参数之间的关系。结果表明:随着喉癌病理分级的增高,Snail的阳性表达强度随之增强,提示恶性程度较高的喉癌细胞更具有转移能力。Snail的表达与患者的年龄、性别及肿瘤的临床分型无相关性。而与淋巴结转移和临床分期具有相关性,在伴有淋巴结转移的喉癌组织中表达明显高于不伴有淋巴结转移者,提示Snail基因与喉癌细胞的淋巴结转移具有相关性,可以成为进一步研究的靶点。
研究表明:Snail和 E-cadherin在很多上皮性癌中存在明显的反向表达。在对鳞状细胞癌的研究中发现,E-cadherin阴性克隆细胞侵袭力强且高表达Snail因子,E-cadherin阳性克隆侵袭力弱,Snail的表达呈阴性或弱阳性[15]。本课题组在前期针对喉癌干细胞的初步研究中已经证实高致瘤细胞亚群(CD 44+CD 133+细胞)具有较强的局部侵袭能力[4],因此预通过此研究证实其侵袭能力是否与Snail 的表达具有相关性。应用RT-PCR、Western blot和细胞免疫化学染色,结果均证实在基因和蛋白质水平上Snail 在高致瘤亚群CD 44+CD 133+喉癌细胞中呈现高表达,且与E-cadherin表达呈负相关,笔者认为,Snail可能通过抑制E-cadherin的表达从而导致上皮间连接的破坏,使癌细胞间粘附松散则易于脱离原发灶而发生侵袭和远处转移。因此联合检测Snail与E-cadherin的表达可作为喉癌恶性程度及预后的参考指标。
肿瘤细胞的侵袭转移过程受多种因素的影响,而EMT参与肿瘤侵袭转移的复杂的调控机制,本实验证实了Snail的表达与喉癌临床分期及淋巴结转移具有相关性,同时亦初步证实了在具有较强的侵袭能力的喉癌细胞CD 44+CD 133+亚群细胞中Snail/E-cadherin通路可能在其中起到了重要的作用,相关的机制还有待于在进一步的实验中深入的研究和探讨。
[1] De Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat rev Cancer,2013,13(2):97-110.
[2] Acloque H,Adams MS,Fishwick K,et al.Epithelial-mesenchymal transitions;the importance of changing cell state in development and disease[J].J Clin Invest,2009,119(6):1438-1449.
[3] Thiery JP,Acloque H,Huang RY.et al.Epithelial-mesenchymal transisions in development and disease[J].Cell,2009,139(5):871-890.
[4] 于丹,金春顺,陈鸥,等.喉癌细胞CD 44+CD 133+高致瘤亚群生物学特性的实验研究[J].中华肿瘤杂志,2009,31(2):99-103.
[5] 吴一波,沈志森,余星,等.喉癌相关miRNA的研究进展[J].基础医学与临床,2012,32(5):583-586.
[6] Velasco-Velazquez MA,Homsi N,De La Fuente M,et al.Breast cancer stem cells[J].Int J Biochem Cell Biol,2012,44(4):573-576.
[7] Shibata T,Hirohashi S.E-cadherin cell adhesion system in human cancer.Seikagaku[J],2006,78(7):647-656.
[8] Blechschmidt K,Sassen S,Schmalfeldt B,et al.The E-cadherin repressor Snail is associated with lower overall survival of ovarian cancer patients[J].Br J Cancer,2008,98(2):489-495.
[9] Bao B,Azmi a S,Ali S,et al.The biological kinship of hypoxia with CSC and EMT and their relationship with deregulated expression of miRNAs and tumor aggressiveness[J].Biochim Biophys Acta,2012,1826(2):272-296.
[10] 张阿丽,王全胜,钟亚华,等.转录因子Snail调控上皮-间质转型及对肿瘤转移的逆转作用[J].癌症,2005,24(11) :1301-1305.
[11] Stoyianni A,Goussia A,Pentheroudakis G,et al.Immunohistochemical study of the epithelial-mesenchymal transition phenotype in cancer of unknown primary:incidence,correlations and prognositic utility[J].Anticancer Res,2012,32(4):1273-1281.
[12] 卓文磊,张云嵩,王彦等.RNA干扰抑制 Snail表达对 A 549 细胞上皮-间充质转分化及体外侵袭的影响[J].现代肿瘤学,2008,16(6): 889-893.
[13] Miyoshi A,Kitajima Y,Sumi K,et al.Snail and SIP 1 in crease cancer invasion by upregulating MMP family in hepatocellular cancer stem cells[J].B r J Cancer,2004,90(6):1265-1273.
[14] 夏曦,蒋学峰,纪腾,等.Snail 在卵巢癌细胞侵袭转移潜能方面的研究.医学分子生物学杂志[J].2013,10(1):21-25.
[15] Bruyere F,Namdarian B,Corcoran NM,et al.Snail expresstion is an independent predictor of tumor recurrence in superficial bladder cancers[J].Urol Oncol, 2010,28(6):591-596.
Expression of Snail in laryngeal carcinoma and its relationship with invasion and metastasis in subgroup laryngeal carcinoma cells
YU Dan, LIU Yan,ZHAO Xue,CHENG Jin-zhang,QI Xin-meng,JIN Chun-shun△
(Department of Otolaryngology-Head and Neck Surgery, The Second Hospital of Jilin University , Changchun 130041,China)
ObjectiveTo study the expression of Snail in laryngeal carcinoma and to explore its relationship with invasion and metastasis in subgroup laryngeal carcinoma cells。MethodThe expression of Snail protein was examined by immunohistochemistry staining in the tissue of laryngeal carcinoma. The statistical evaluation was performed to detect the correlation between the Snail protein expression and clinical features. In different subgroups of laryngeal carcinoma cells (CD 44+CD 133+cells, CD 44 and CD 133–cells), the expression of Snail and adhesion molecules E-cadherin were detected by RT-PCR,Western blot test and immunochemical staining which were studied in the correlation with invasion and metastasis。ResultsThe result of immunohistochemical staining revealed that Snail was moderately or highly expressed in the tissue of laryngeal carcinoma significantly and higher than those in adjacent non-cancerous tissues(P<0.01). Expression of Snail was highly correlated with lymph node metastasis, tumor differentiation and clinical classi fi cation(P<0.05).However, it was not related to the age , gender and clinical type. RT-PCR and Western blot test results con fi rmed that the expression level of Snail was signi fi cantly higher in CD 44+CD 133+laryngeal cancer cells than in CD 44-and CD 133-laryngeal cancer cells, otherwise the expression level of E-cadherin in CD 44+CD 133+laryngeal cancer cells was signi fi cantly lower than in the CD 44-and CD 133-laryngeal cancer cells. Cell immunohistochemical staining con fi rmed the expression of Snail and E-cadherin were negatively correlated in CD 44+CD 133+laryngeal cancer cells。ConclusionOver expression of Snail in laryngeal carcinoma is closely related to the development of laryngeal cancer and lymph node metastasis. The expression of Snail in the CD 44+CD 133+laryngeal cancer cell subgroup is negatively correlated with adhesion molecules E-cadherin, which is a close correlation with invasion and metastasis of laryngeal cancer cells.
laryngeal carcinoma;Snail;E-cadherin;tumor metastasis; epithelial-mesenchymal transition
R 739.91
A
1005-1678(2014)01-0001-05
上皮细胞-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在特定的生理及病理情况下向间充质细胞转化的现象,表现为上皮细胞失去极性,与周围细胞和基质间的黏附能力减小,迁移性和运动能力增强,EMT是肿瘤细胞侵袭、转移早期的重要启动步骤,与肿瘤细胞的原位侵袭和远处转移有着密切的关系[1]。研究表明:转录因子Snail可促进EMT的发生,并在多种肿瘤中呈高表达[2]。近年来Snail/E-cadherin信号通路在EMT中的作用越来越受到人们的关注[3]。本研究通过检测转录因子Snail在喉鳞状细胞癌中的表达,研究其与喉癌临床特征的关系,并通过检测不同生物学特性喉癌细胞亚群中Snail和E-cadherin的表达情况,评估其与喉癌细胞的侵袭和转移的关系。
吉林省自然科学基金项目(20130101151JC);教育部博士点新教师基金项目(20120061120092)
于丹,女,博士,主治医师,研究方向:喉癌干细胞的基础研究,E-mail:yudan 19792003@163.com;金春顺,通信作者,女,教授,博士生导师,研究方向:头颈肿瘤的基础及临床研究,Tel:0431-88796636,E-mail:chunshunjindan@163.com。
