R G D与细胞穿膜肽共修饰脂质体靶向抑制肺癌A 5 4 9细胞的研究
2014-09-18章卫华叶敏周荣伟孙坚
章卫华,叶敏,周荣伟,孙坚
(南昌大学第四附属医院 肿瘤科,江西 南昌 330003)
R G D与细胞穿膜肽共修饰脂质体靶向抑制肺癌A 5 4 9细胞的研究
章卫华,叶敏,周荣伟,孙坚△
(南昌大学第四附属医院 肿瘤科,江西 南昌 330003)
目的制备整合素受体精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)和细胞穿膜肽(transcriptional actirator protein,TAT共修饰载紫杉醇(paclitaxel,PTX)脂质体(liposomes,LP)(RGD/TAT-LP-PTX),对其理化性质进行表征,并考察脂质体与肺癌A549细胞的亲和力以及对A549细胞增殖的抑制作用。方法采用薄膜分散法制备RGD/TAT-LP-PTX,考察脂质体的粒径,电位以及包封率;通过定量细胞摄取实验考察肺癌A549细胞对RGD/TAT-LP的摄取效率。构建A549肿瘤球模型,定性共聚焦实验观察肿瘤细胞和肿瘤球对脂质体的摄取。噻唑蓝实验考察RGD/TAT-LP-PTX对肺癌A549细胞的增殖抑制作用。结果RGD/TAT-LP-PTX的粒径在(118.5±11.4)nm,电位为(21.58±2.42)mV,紫杉醇的包封率为86.5%。细胞摄取实验结果显示,RGD/TAT-LP在4h摄取效率是2h的1.88倍,差异具有统计学意义(P<0.05);肺癌A 549细胞在与脂质体共同孵育4 h后对RGD/TAT-LP的摄取效率分别是TAT-LP、RGD-LP和LP的2.1倍、2.8倍和5.1倍,差异具有统计学意义(P<0.01);MTT实验结果显示,在相同给药浓度下,不同脂质体组间细胞存活率有显著性差异(P<0.01)。结论整合素受体RGD和细胞穿膜肽TAT共修饰载紫杉醇(PTX)脂质体能够有效识别高表达整合素受体的肿瘤细胞,穿透肿瘤细胞膜进入肿瘤细胞,是一种潜在高效的肿瘤靶向给药系统。
整合素受体;细胞穿膜肽;脂质体;肺癌
肺癌是全球最普遍发生的恶性肿瘤之一,其发病率和病死率居全球恶性肿瘤之首[1]。近年来,我国肺癌的发病率呈急剧上升趋势。手术和化疗是当前肺癌治疗的两种主要手段,目前,肺癌的治疗以手术为主,联合化疗为辅。然而,以细胞毒为主的化学治疗缺乏选择性,难免产生许多不良反应和毒性,病人耐受性较差。肺癌的治疗迫切需要新的手段。肿瘤靶向给药系统是指借助载体、配体或抗体将药物选择性地浓集定位于靶组织、靶器官、靶细胞或细胞内结构的给药系统[2]。脂质体是靶向给药系统的代表,它是由磷脂组成的具有双层膜结构的球形结构。脂质体具有良好的生物相容性,能够通过内核包载亲脂性药物和亲水性药物,脂质体还能够进行表面修饰,实现主动靶向[3]。TAT作为一种强效的细胞穿膜肽(Cell penetrating peptides,CPP)被广泛应用于纳米载体的研发中,以提高纳米载体的入胞能力[4]。有研究表明,肺癌细胞表面有整合素受体高度表达[5]。因此本研究以脂质体为载体,制备了整合素受体精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)和细胞穿膜肽TAT共修饰紫杉醇脂质体,并对其理化性质和体外活性进行评价。
1 资料与方法
1.1 材料与仪器 Sizer Nano ZS 90型激光粒度仪及ZETA电位分析仪(英国Malvern instruments Ltd)。大豆磷脂(SPC,上海太伟药业有限公司);胆固醇(Chol,美国sigma公司);DSPE-PEG 2000和DSPE-PEG 3500(美国Avanti polar lipids);香豆素-6(coumarin-6,美国sigma公司);DMEM高糖培养基和胎牛血清(美国GIBCO公司);其余试剂为分析纯。人肺癌细胞(A 549,ATCC)。
1.2 方法
1.2.1 RGD/TAT-LP-PTX的制备及其表征 参照文献方法[6-7]合成DSPE-PEG 3500-RGD和DSPE-PEG 2000-TAT。使用薄膜分散法制备RGD与TAT共修饰脂质体。将处方量的紫杉醇,SPC,Cho,DSPE-PEG 3500-RGD,DSPEPEG 2000-TAT,DSPE-PEG-OMe(保证总磷脂∶胆固醇=73∶27(摩尔比),分别溶于氯仿,置50 mL茄形瓶中旋转蒸发成膜后,再置真空干燥器中过夜。加入2.5 mLPBS缓冲液(pH 7.4),置空气浴摇床中,37℃,180 r/min,20 min水化,水浴超声5 min脱膜,探头超声制备得到RGD与TAT共修饰的紫杉醇脂质体或者载香豆素-6脂质体。
取适量制备得到的脂质体样品,用激光粒度仪测定其粒径和电位。采用葡萄糖凝胶柱色谱法分离脂质体与未包载的紫杉醇,将过柱后的脂质体采用甲醇破乳,用HPLC法在228 nm检测紫杉醇含量。按照EE%=W包/W投×100%计算包封率。W包:脂质体中包载的药物量。W投:制备脂质体的投药量。
1.2.2 A549细胞对载香豆素-6脂质体的摄取 将对数生长期的细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后,每孔加入适量FITC标记的LP、TAT-LP、RGD-LP和RGD/TAT-LP,使孔中脂质体浓度为0.20µg/mL,37℃分别孵育2 h和4 h后除去含脂质体培养基,冷PBS清洗3次,0.25%胰酶消化后离心,PBS清洗3次,流式细胞仪测定细胞荧光值。
为了定性观察细胞对脂质体的摄取情况,将脂质体与细胞共同孵育4 h后,将细胞用PBS漂洗3次;加入2µg/mL DAPI溶液,室温孵育20 min,加冰PBS漂洗三次;加4%多聚甲醛固定15 min,弃去多聚甲醛,置激光共聚焦显微镜观察细胞摄取情况。
1.2.3 肿瘤球的构建 取对数生长期的A549细胞用0.125% 胰酶消化后,用含血清的培养基中和胰酶,并将细胞吹打下来后离心,弃去上清液用培养基重悬细胞后接种于用低熔点琼脂糖预处理的96孔板中,将96孔板移入37℃CO2孵箱中培养。7 d后成长为肿瘤球。按照“1.2.2”项下处理,置激光共聚焦显微镜观察脂质体的肿瘤球穿透能力。
1.2.4 细胞毒性实验 培养A549细胞并接种于96孔板中,当孔板中细胞完全贴壁且处于对数生长期时加入无菌过滤后的紫杉醇浓度分别为0.25、2.5、10、25µg/mL的脂质体。将孔板移入37℃或4℃CO2孵箱中培养24 h后取出,每孔加入20µL 5 mg/mL MTT溶液,再放回孵箱中继续孵育4 h,将孔板中液体倒出,每孔加入200µL DMSO,37℃避光振摇15 min,用酶标仪在490 nm处测定各孔的光密度值(OD)。
1.2.5 统计学方法 正态计量数据以“x±s”表示,SPSS 21.0统计软件进行数据分析,两组间比较用t检验,多组间比较用方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 脂质体的表征 取适量样品用马尔文激光粒度仪测定粒径以及电位,结果如表1所示,RGD/TAT-LP-PTX的粒径在(118.5±11.4)nm,电位为(21.58±2.42)mV,紫杉醇的包封率为86.5%。

表1 不同脂质体的粒径与电位(n=3)Tab.1 Characteristics of RGD-LP-PTX, TAT-LP and RGD/ TAT-LP: particle size, size distribution, zeta-potential(n=3)
2.2 A549细胞对脂质体的摄取 在A549细胞表面整合素受体高度表达。不同脂质体的摄取实验结果见图1所示,细胞对脂质体的摄取量随着孵育时间的延长而增加,RGD/ TAT-LP在4 h摄取效率是2 h的1.88倍,差异具有统计学意义(P<0.05);肺癌A549细胞在与脂质体共同孵育4 h后对RGD/TAT-LP的摄取效率分别是TAT-LP、RGD-LP和LP的2.1倍、2.8倍和5.1倍,差异具有统计学意义(P<0.01)。定性的激光共聚焦显微镜观察结果如图2所示,RGD/TAT-LP组荧光强度显著强于其他组,这与定量的实验结果相一致。

图1 A 549细胞不同孵育时间对不同脂质体的摄取效率(n=3)*P<0.01,与TAT-LP和RGD-LP比较;#P<0.01,与RGD/TAT-LP在2 h摄取比较Fig.1 Uptake of different liposomes by A 549 cells (n=3)#P<0.01,compared with TAT-LPandRGD-LP;#P<0.01,compared with RGD/TAT-LP in 2 h
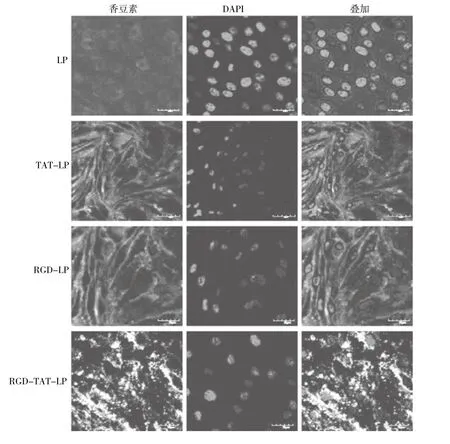
图2 激光共聚焦观察A549细胞对香豆素-6标记脂质体的摄取Fig.2 Uptake of coumarin-6 loaded liposomes by A 549 cells based on confocal laser scanning microscopy
2.3 脂质体的肿瘤球穿透能力考察 本实验采用体外肿瘤球模型来模拟脂质体进入体内后在肿瘤组织的摄取以及分布情况,结果见图3。单独修饰RGD的脂质体能进入肿瘤球内部,但荧光较弱,TAT修饰脂质体荧光主要集中在肿瘤球表面,共修饰脂质体组荧光在肿瘤球内外分布均匀。这是由于两种配体共修饰脂质体后,发挥协同作用。

图3 激光共聚焦观察香豆素-6标记脂质体对A549细胞肿瘤球的穿透能力.Fig.3 Uptake of coumarin-6 loaded liposomes by A549 cells tumor spheroids based on confocal laser scanning microscopy
2.4 RGD/TAT-LP-PTX抑制A549细胞增殖 MTT实验结果见图4,紫杉醇脂质体对A 549细胞的增殖抑制率随着紫杉醇的给药浓度增加而增强。在相同给药浓度下,RGD/ TAT-LP-PTX对A 549细胞的增殖抑制作用显著强于TATLP-PTX、RGD-LP-PTX和LP-PTX,差异具有统计学意义(P<0.01)。

图4 紫杉醇脂质体对A 549细胞的增殖抑制率*P<0.01,与相同紫杉醇浓度下TAT-LP-PTX和RGD-LP-PTX比较;#P<0.01,与RGD/TAT-LP-PTX在2.5和10µg/ml比较Fig.4 A 549 cell viability at various concentration of PTX after the treatment*P<0.01,Compared with TAT-LP-PTX and RGD-LP-PTX in the same PTX concentration;#P<0.01,Compared with RGD/TAT-LP-PTX in 2.5,10µg/ml PTX concentration
3 讨论
理想的肿瘤靶向药物传递系统不仅需要在全身给药后将药物浓集在肿瘤组织,而且还需要能够特异识别肿瘤细胞将药物高效地传递到肿瘤细胞内,从而将治疗作用最大化并减少抗肿瘤药物的副作用[8]。整合素(Integrins)是一类细胞黏附受体分子,在有核细胞表面均广泛表达,其中整合素αvβ3在神经胶质瘤、黑色素瘤、肺癌等多种肿瘤细胞及肿瘤相关的内皮细胞表面高度表达,与肿瘤的血管发生,肿瘤转移及肿瘤的抗放射治疗密切相关,因此整合素αvβ3常被用作肿瘤靶向的特异性靶点[9-10]。有研究表明,精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)的三肽序列能够特异性地识别含αv亚基的整合素家族,具有高度亲和力[10]。细胞穿膜肽TAT能够穿过与之相接触的任何细胞的细胞膜,而对细胞膜没有损伤[11]。TAT修饰的脂质体用于肿瘤靶向给药已经被广泛研究,然而其缺乏选择性也限制了TAT在全身系统给药中的应用[12]。本研究合成了DSPE-PEG 3500-RGD和DSPE-PEG 2000-TAT。首先通过实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)到达肿瘤组织,再通过长链的DSPE-PEG 3500-RGD识别高度表达整合素受体的肿瘤细胞并结合,第三步DSPE-PEG 2000-TAT的穿膜作用,高效进入肿瘤细胞以实现肿瘤细胞的三级靶向。
本研究构建的RGD与TAT共修饰脂质体的粒径在100 nm左右,紫杉醇的包封率大于80%。在细胞摄取试验中,与普通脂质体相比,经过RGD或者TAT修饰后都能够显著增强肺癌细胞对脂质体的摄取,其中对共修饰脂质体的摄取效率显著高于RGD或者TAT单独修饰的脂质体,这说明二者发挥了协同作用,共同促进入胞。定性的细胞共聚焦实验结果显示,不同脂质体组之间荧光强度的差异与定量实验结果相一致。通过肿瘤细胞毒性实验证实经过双配体修饰后能够增强载药脂质体对肿瘤细胞的增殖抑制能力,这与细胞摄取的实验结果相一致,这说明脂质体的细胞毒性依赖于肿瘤细胞对脂质体的摄取效率。在某些实体肿瘤组织中,由于肿瘤组织致密生长,肿瘤内部压力高且血管少,因此给药系统很难进入肿瘤组织深部[13-15]。本研究构建了体外肿瘤球模型用于模拟评价RGD/TAT-LP-PTX对实体肿瘤的穿透能力。结果显示,单独修饰RGD的脂质体能进入肿瘤球内部分散均匀,但荧光较弱;TAT修饰脂质体荧光主要集中在肿瘤球表面,共修饰脂质体组荧光在肿瘤球内外分布均匀,且荧光强度显著强于其他对照组。这是由于两种配体共修饰脂质体后,发挥协同作用,这与体外细胞增殖抑制实验结果相一致。
综上所述,经过整合素受体RGD和细胞穿膜肽TAT共同修饰后能够增强脂质体的入胞能力,增强载药脂质体对肿瘤细胞的增殖抑制能力,RGD/TAT-LP是一种潜在高效的肿瘤给药系统。
[1] Shunichi S,Maemondo M,Tachihara M,et al.Randomized phase II trial of uracil/ tegafur and cisplatin versus vinorelbine and cisplatin with concurrent thoracic radiotherapy for locally advanced unresectable stage III non-small-cell lung cancer:NJLCG 0601[J].Lung Cancer,2013,81(1):91-96.
[2] Qin Y,Chen H,Yuan W,et al.Liposome formulated with TAT-modified cholesterol for enhancing the brain delivery[J].Int J Pharm,2011,419(1-2):85-95.
[3] Kuai R,Yuan W,Li W,et al.Targeted delivery of cargoes into a murine solid Tumor by a cell-penetrating peptide and cleavable poly(ethylene glycol) comodified liposomal delivery system via systemic administration[J].Mol.Pharmaceu tics,2011,8(6):2151-2161.
[4] Yao Q,Chen H,Zhang Q,et al.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeuticefficacy on brain glioma in animals [J]. International Journal of Pharmaceutics,2011,420(2):304-312.
[5] Oba M,Fukushima S,Kanayama N,et al.Cyclic RGD peptide-conjugated polyplex micelles as atargetable gene delivery system directed to cells possessing αvβ3 and αvβ5 integrins[J].Bioconjug Chem,2007,18(5):1415-1423.
[6] Kuai R,Yuan W,Qin Y,et al.Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-modified liposomes [J]. Mol.Pharmaceutics,2010,7(5):1816-1826.
[7] Zhang QY,Tang J,Fu L,et al.A pH-responsive a-helical cell penetrating peptide-mediated liposomal delivery system[J].Biomaterials,2013,34 (32):7980-7993.
[8] Li Z.Lipid-polymer hybrid nanoparticles:synthesis,characterization and applications[J].Nano LIFE,2010,1(1):163-173.
[9] Hegi ME,Diserens AC,Gorlia T,et al.MGMT gene silencing and benefit from temozolomide in glioblastoma[J].N Engl J Med,2005,352(10):997-1003.
[10] X.Ying,Wen H,Lu WL,et al.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].Journal of Controlled Release,2010,141(2):183-192.
[11] Ikramy A,Kogure K,Futaki S,et al.Octaarginine-modified liposomes:Enhanced cellular uptake and controlled intracellular trafficking[J].International Journal of Pharmaceutics,2008,354(1-2):39-48.
[12] Kale A.Torchilin VP.Enhanced transfection of tumor cells in vivo using“Smart”pH-sensitive TAT-modified pegylated liposomes[J].J.Drug Targeting,2007,15 (7-8):538-545.
[13] Jiang X.Solid tumor penetration by integrin-mediated pegylatedoly(trimethylenecarbonate) nanoparticles loaded with paclitaxel[J].Biomateria ls,2013,34(6):1739-1746.
[14] Gao HL.A cascade targeting strategy for brain neuroglial cells employing nanoparticles modified with angiopep-2 peptide and EGFP-EGF 1 protein [J]. Biomaterials,2011,(33):8669-8675.
[15] Zhan C.Cyclic RGD conjugated poly(ethyleneglycol)-co-poly(lactic acid) micelle enhances paclitaxel anti-glioblastoma effect[J].J Control Release, 2010,143(1):136-142.
RGD and cell penetrating peptides co-modi fi ed paclitaxel loaded liposome inhibit the A549 cells
ZHANG Wei-hua, YE Min, ZHOU Rong-wei, SUN Jian△
(Department of Oncology, The Fourth Affiliated Hospital of Nanchang University, Nanchang 330003,China)
ObjectiveTo prepare RGD and TAT co-modi fi ed paclitaxel loaded liposome(RGD/TAT-LP-PTX)for A 549 cells targeting.Method The co-modi fi ed liposome was prepared by fi lm-ultrasonic method. The appearance,particle size,Zeta potential were evaluated. The cellular uptake by A 549 cells in vitro was used to evaluate the targeting ef fi ciency. The anti-proliferation ef fi ciency of RGD/TAT-LP-PTX was evaluated by MTT assay。ResultsThe particle diameter of the co-modi fi ed liposome was (118.5±11.4) nm with the Zeta potential of (21.58±2.42 )mV. The entrapment ef fi ciency of PTX was 86.5%. The result demonstrated that the co-modi fi ed liposome uptaken by A 549 were 2.1, 2.8 times higher than that of TAT-LP and RGD-LP, respectively. The RGD/TAT-LP-PTX shows the highest anti-proliferation ef fi ciency。ConclusionThe co-modi fi ed liposome might serve as a promising tumor delivery system of antitumor drugs.
integrin receptor; cell penetrating peptides; liposomes; lung cancer
R 943
A
1005-1678(2014)01-0046-03
章卫华,男,硕士,副主任医师;孙坚,通信作者,男,主任医师,研究方向:肿瘤疾病的基础与临床治疗研究,Email:527236911@qq.com。
