布鲁菌wzt基因的原核表达及生物信息学分析
2014-09-15王秀然康立恒郝芳芳许春晓卢天成周晓丽
王秀然,康立恒,安 伟,郝芳芳,陈 思,许春晓,卢天成,周晓丽
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.吉林大学白求恩医学部,吉林 长春 130021;3.吉林大学第一医院,吉林 长春 130021;4.军事医学科学院军事兽医研究所,吉林 长春 130122)
布鲁菌病是一种人畜共患疾病,该病不但严重影响养殖业的发展,对人类健康也构成了巨大威胁.人畜布鲁菌病难以防控的原因是多方面的,其中,其致病机理(包括胞内寄生机理)和免疫机理不清楚是主要原因.
引起布鲁菌病的布鲁菌是兼性细胞内寄生的革兰氏阴性球杆菌,不产生芽孢和荚膜.虽然布鲁菌不能自主运动,但其携带组装鞭毛的所有基因,也不含趋化系统[1].脂多糖(lipopolysaccharide,LPS)是布鲁菌主要的毒力因子,也是引起哺乳动物免疫的主要抗原之一[2].目前布鲁菌脂多糖合成的途径并不完全清晰,已经发现的与布鲁菌脂多糖合成相关的关键基因有wbkA,gmd,wzm,wzt,wbkB,wbkC等,其中wzt基因为ABC转运系统(ABC transporter)的重要组成部分[3],布鲁菌LPS-O侧链的合成即是通过ABC转运途径.有研究显示[4],线性O多糖大多是通过这一途径完成的,这一过程中糖苷连接到UDP-PP-糖链上,在细胞膜内膜上完成聚合物的合成,然后借助ABC转运蛋白运到膜外,链接到核心寡糖和类脂A上;其中,wzt基因编码ABC型转运体(ATP酶结构域)O抗原输出系统ATP结合蛋白,其突变导致B.melitensis 16M形成粗糙型突变体,ELISA检测S-LPS的O侧链可确定O侧链缺失.O多糖合成前体由wzt形成的ABC转运系统通过十一异戊烯联聚合物转移到膜,在那里它被连接到脂质A核心和易位到外膜的周质面[5].ABC转运系统在细菌中是一个主要的细胞转运机器,由一系列同源基因编码的操纵子组成[6].该操纵子由ATP结合蛋白、膜蛋白、亚基结合蛋白3部分组成,通常情况下,形成由6个跨膜片段组成的2个完整的膜蛋白[7].ABC转运系统是膜外生物大分子合成的主要运输通道之一,参与胞外多糖的合成[8].此外,ABC转运系统在细菌营养成分的运输、独立分子的外排等过程中也起着重要的作用[9].研究发现,wzt基因缺失会造成布鲁菌O侧链缺失,同时降低布鲁菌的毒力[10];缺失wzt基因的布鲁菌突变株与亲本株相比,细胞免疫水平下降,体液免疫水平上升[11-12].
本研究对源于布鲁菌的wzt基因进行了克隆并对原核进行了表达,对其进行了生物信息学分析和结构预测,以为阐明布鲁菌wzt基因的功能提供理论依据.
1 材料与方法
1.1 菌株及载体
布鲁菌Brucella abortus S19DNA、感受态菌株Eschericholia.coli DH5α、E.coli BL21(DE3)由军事医学科学院军事兽医研究所五室赠送;Trans-T1感受态、原核表达载体pEASY-E1expression kit购自北京全式金生物技术有限公司.
1.2 方法
1.2.1 培养基
液体LB培养基:蛋白胨1g,酵母粉0.5g,NaCl 1g,蒸馏水100mL,pH=7.2.
固体培养基(Ampicillin,Ampr):蛋白胨1g,酵母粉0.5g,NaCl 1g,琼脂1.5g,蒸馏水100mL,pH=7.2.121℃灭菌20min.灭菌后加除菌的氨苄西林至100μg/mL.
1.2.2 引物的设计及合成
根据GenBank中B.abortus S19的序列信息设计引物.上游引物(Nde I酶切位点)F:catatgATGATCCAGCCATCGATTACCCTGT;下游引物R(Xho I 酶切位点):ctcgagTCATGCTATAGCTCCCATTCCCGAG.引物由长春华大中天生物技术有限公司合成.
1.2.3 wzt基因的扩增
以B.abortus S19总DNA为模板,反应体系50μL:模板DNA 2μL,上游引物1μL,下游引物1μL,Ex Taq酶0.5μL,10×Buffer 5μL,dNTP 4μL,水36.5μL.反应条件:94℃5min;94℃1min,58℃30s,72℃1min,30个循环;72℃延伸10min.
1.2.4 重组表达质粒的构建及鉴定
利用凝胶回收试剂盒纯化回收PCR产物,将回收产物与pEASY-E1载体连接并转化Trans-T1感受态细胞,转化后加入250μL经室温平衡的LB培养基,于37℃,180r/min恒温摇床中培养1h.取200μL菌液均匀地涂布于准备好的Ampr固体培养基平板上,37℃培养过夜.
挑取单菌落接种于LB(Amp)液体培养基中,180r/min,37℃恒温摇床中培养12h,采用载体正向引物(E Control Forward Primer:GGAATTGTGAGCGGATAACAATTCC)和下游引物R进行PCR鉴定.
提取阳性菌液质粒,进行Nde I和Xho I双酶切鉴定,37℃水浴锅酶切3h.酶切体系:质粒4μL,限制性内切酶Nde I 0.5μL,限制性内切酶Xho I 0.5μL,Buffer 1μL,无菌水4μL.将鉴定正确的质粒pEASY-wzt进行测序.
1.2.5 诱导表达
将pEASY-wzt转化到E.coli BL21(DE3).挑取阳性单克隆菌落,接种到5mL含有Amp的抗性LB液体培养基中,37℃,180r/min培养6h;至菌液D(600)为0.6时,加入终浓度为1mmol/L 的IPTG,37℃继续诱导4h.
1.2.6 聚丙烯酰胺凝胶电泳(SDS-PAGE电泳)分析
收集1.5mL诱导的菌液,以未诱导菌液作为阴性对照,于室温12000r/min离心1min,弃上清,用1mL PBS悬浮;12000r/min离心1min,用50μL蒸馏水悬浮沉淀,加入50μL 2×SDS Buffer,在沸水中孵育5~10min.12000r/min离心5min,取上清液进行8%SDS-PAGE电泳分析.凝胶用考马斯亮蓝R-250染色.
1.2.7 表达蛋白质的纯化
收集100mL诱导表达的菌液,4℃,5000r/min离心5min;弃上清,加入100mL的PBS洗涤菌液,4℃,5000r/min离心5min;重复洗涤一次,弃上清,将菌体置于冰水中,用20mL的Binding Buffer结合液进行重悬.超声裂解细菌,超声10s,间歇10s,功率400W持续工作30min,直至上清液变清澈.4℃,13000r/min离心10min,取上清,经0.22μm的滤膜过滤后,用1mL HisTrapTMFF亲和层析柱纯化蛋白.
1.2.8 表达产物的Western Blotting鉴定
纯化产物经SDS-PAGE分析后,根据SDS-PAGE凝胶的大小,剪裁PVDF膜和滤纸.将滤纸放在转膜缓冲液中完全浸透;PVDF膜先在甲醇中敏化15s,随后放入蒸馏水中浸泡2min.组装转膜装置,从阳极到阴极依次为:8层滤纸-PVDF膜-凝胶-8层滤纸.PVDF膜要略大于凝胶,以保证所有蛋白能够转到膜上;并将滤纸、凝胶、PVDF膜对齐,赶走气泡.恒流110mA,电压控制在25V内,电转25min.用洗涤液清洗PVDF膜3次,每次5min.加入5%脱脂奶粉常温封闭,在摇床上轻轻摇动1~2h.倒掉封闭液,用洗涤液洗膜3次,每次5min.一抗孵育:加入1∶200(体积比)倍稀释的鼠抗His标签单克隆抗体,37℃孵育2h,倒掉一抗,洗涤液洗膜(方法同上);二抗孵育:加入1∶2000(体积比)倍稀释的辣根过氧化物酶标记的羊抗鼠IgG,37℃孵育2h.倒掉二抗,洗涤液洗膜(方法同上)[13].加入TMB显色液显色10min,加纯水终止,扫描保存图片.
1.3 wzt基因表达产物的生物信息学分析与结构预测
1.3.1 wzt蛋白结构预测
采用Discovery Studio 2.5软件以Swiss-Model模式对蛋白质结构进行预测[14].
1.3.2 wzt基因表达产物的生物信息学分析
在NCBI数据库中对与wzt基因功能相关的蛋白序列进行检索,并采用Clustalx1.83和MEGA5.0进行生物信息学分析.
2 结果与分析
2.1 wzt基因扩增产物的鉴定
以B.abortus S19总DNA为模板,PCR扩增wzt基因,成功获得目的基因,扩增产物经1%琼脂糖凝胶电泳检查,得到与目的基因大小相符的约756bp的条带(见图1).
2.2 重组表达质粒的酶切鉴定
将重组质粒pEASY-wzt经Xho I单酶切、Nde I和Xho I双酶切进行鉴定,得到的结果同理论值相符,表明重组表达质粒pEASY-wzt构建正确.经测序,与GenBank注册序列一致.
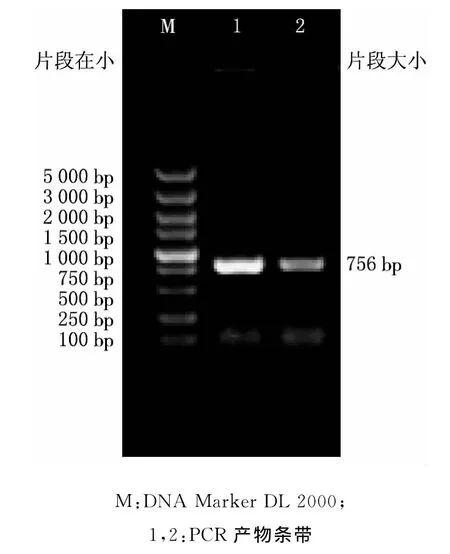
图1 目的基因wzt的PCR扩增产物凝胶电泳图
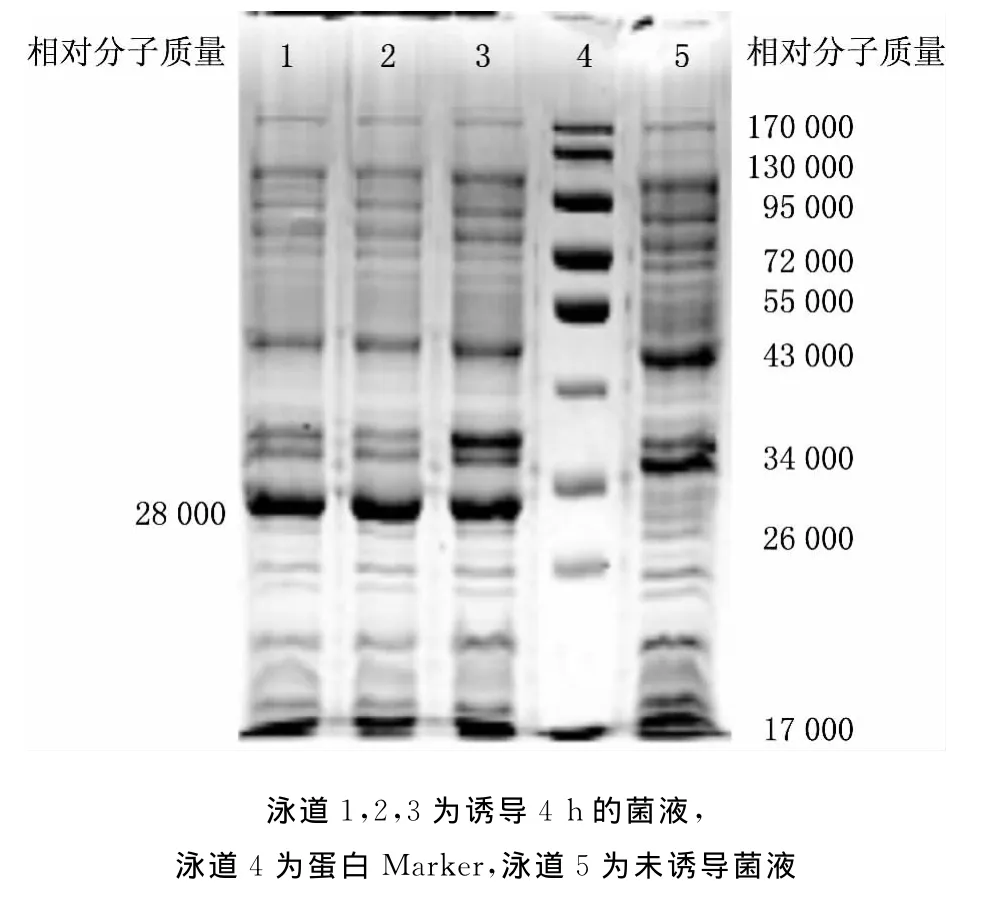
图2 表达产物的SDS-PAGE分析
2.3 表达产物的鉴定
将构建好的重组质粒pEASY-wzt转到大肠杆菌BL21中,加入IPTG使其终浓度为1.0mmol/L,37℃,诱导4h.通过8%SDS-PAGE分析鉴定,表明重组质粒能够成功表达目的蛋白,在相对分子质量约28000处可见差异蛋白条带,与理论值相符(见图2),表明wzt基因成功表达.
2.4 表达产物的分离纯化
SDS-PAGE结果表明,蛋白表达成功,经亲和层析纯化可获得纯化的重组蛋白,经Lowry法测定纯化蛋白的质量浓度为0.43mg/mL.
2.5 目的蛋白的鉴定
Western Blotting分析显示,在相对分子质量约28000处可见特异反应条带(见图3),表明纯化的重组蛋白能被His标签单克隆抗体所识别,表明所表达蛋白为wzt蛋白.

图3 纯化产物的Western blot分析
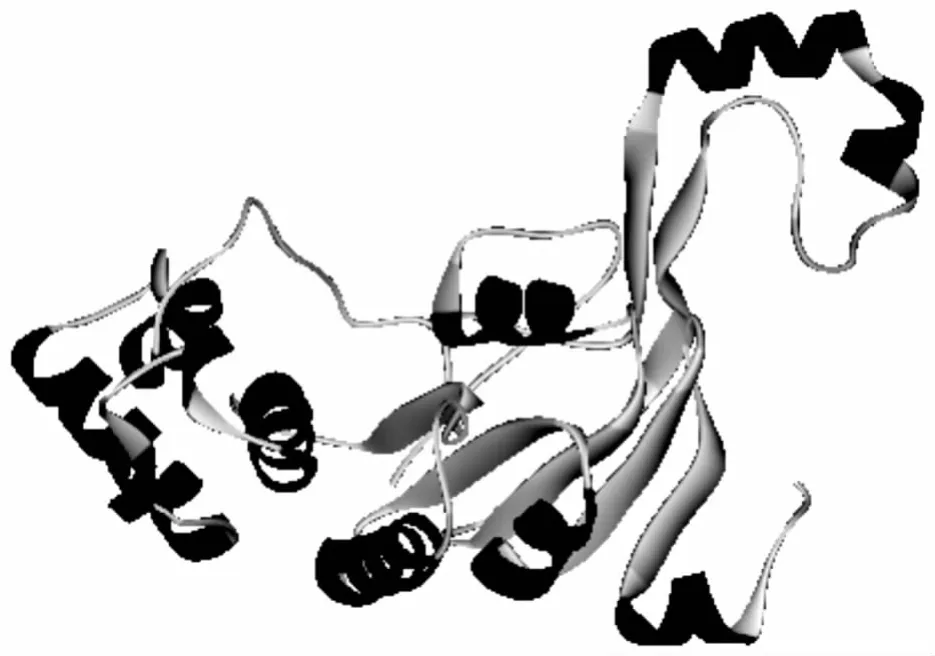
图4 ABC转运系统结构图
2.6 wzt编码蛋白的结构预测
由Discovery Studio 2.5生成、通过Swiss-Model构建的结构示意图见图4.模板选择1oxv,与来自Sulfolobus solfataricus的蔗糖ABC转运系统的ABC-ATP酶的序列一致性仅23.11%.三维构象显示,该蛋白可能由8个α螺旋、7个β片层构成.

图5 wzt基因及部分功能相同的基因编码的蛋白序列的系统进化分析
2.7 wzt编码蛋白的同源性分析
将wzt基因编码的蛋白序列与GenBank中功能相关的基因序列进行同源性比较,发现该基因编码的蛋白质序列在多数种属中具有较高的种属特异性.布鲁菌属不同种的该基因蛋白同源性接近100%(见图5),与其他种属相关蛋白的差异较大,但与耶尔森氏菌的O:9菌株的该蛋白序列同源性较高.
3 讨论
布鲁菌是一种重要的人畜共患病病原,其LPS既是其主要的毒力因子,同时也是引起免疫的重要抗原,wzt基因作为其合成的关键基因,在O多糖跨膜合成过程中起着重要的作用.
O多糖是在内膜上由糖基转移酶催化形成的脂质链接的O侧链重复单位,可通过某种机制将脂质链接的O多糖传递到细胞周质空间,并将O多糖链接到核心寡糖上形成LPS[5].在细菌中参与O多糖合成的基因往往形成RFB基因[15-16],RFB基因编码合成新型糖苷前体的糖基转移酶,作为运输过程所需要的酶,因此,RFB基因座位的多态性影响O多糖的结构多样性[17].
目前已知有3种途径参与O多糖的合成运输过程,分别为WZY依赖型途径、ABC转运型和合酶依赖型途径.在WZY依赖型途径中,由wzx蛋白同源类似物完成跨膜运输;而在ABC转运型途径中则由ABC转运子完成运输,其ATP结合域的序列高度保守,特别是核苷酸结合区[18].本研究的结果显示,ABC转运系统中的wzt蛋白、ATP结合域,在布鲁菌中具有高度保守的种属特异性,因此ATP结合域的保守性具有属的特异性.目前,有关O多糖合成的ABC转运子的确切组织形式和模式尚未见报道,没有结构数据可以参考,大部分信息是来自大肠杆菌等细菌的2型荚膜合成过程的研究和假说[18-19].本研究发现wzt蛋白具有8个α螺旋、7个β片层结构,为进一步研究ABC转运系统的组织形式及形成模式提供了依据.
本研究成功表达了wzt蛋白,并对其结构进行了初步的预测,研究结果为进一步揭示wzt基因在LPS合成过程中的作用机制,阐述其在细菌组成物质的合成和免疫调节中的作用具有重要的意义.
[1]ALTON G G,JONES L M,ANGUS R D,et al.Techniques for the Brucellosis Laboratory[R].Institut National de la Recherche Agronomique,1988.
[2]CARDOSO P G,MACEDO G C,AZEVEDO V,et al.Brucellaspp noncanonical LPS:structure,biosynthesis,and interaction with host immune system[J].Microb Cell Fact,2006,23:5-13.
[3]GODFROID F,CLOECKAERT A,TAMINIAU B,et al.Genetic organisation of the lipopolysaccharide O-antigen biosynthesis region of Brucella melitensis16M (wbk)[J].Res Microbiol,2000,151:655-668.
[4]CLOECKAERT A,GRAYON M,VERGER J M,et al.Conservation of seven genes involved in the biosynthesis of the lipopolysaccharide O-side chain in Brucellaspp[J].Res Microbiol,2000,151:209-216.
[5]RAETZ C R H ,WHITFIELD C.Lipopolysaccharide endotoxin[J].Annu Rev Biochem,2002,71:635-700.
[6]JIANG X,LEONARD B,BENZON R,et al.Macrophage control of Brucella abortus:role of reactive oxygen intermediates and nitric oxide[J].Cell Immunol,1993,151:309-319.
[7]WANG Z,NIU J R,WANG S S,et al.In vivo differences in the virulence,pathogenicity and induced protective immunity of wboA mutants from genetically different parent Brucellaspp.[J].Clin Vaccine Immunol,2013,20(2):174-180.
[8]ADONE R,FRANCIA M,PLSTOIA C,et al.Protective role of antibodies induced by Brucella melitensis B115against B.melitensis and B.abortus infections in mice[J].Vaccine,2012,30(27):3992-3995.
[9]TOMII K ,KANEHISA M.A comparative analysis of ABC transporters in complete microbial genomes[J].Genome Res,1998,8(10):1048-1059.
[10]GODFROID F,TAMINIAU B,DANESE I,et al.Identification of the perosamine synthetase gene of Brucella melitensis 16M and involvement of lipopolysaccharide O side chain in Brucella survival in mice and in macrophages[J].Infect Immun,1998,66:5485-5493.
[11]WANG X,WANG L,LU T,et al.Effects of partial deletion of the wzm and wzt genes on lipopolysaccharide synthesis and virulence of Brucella abortus S19[J].Mol Med Rep,2014,9(6):2521-2527.
[12]WANG X R,YAN G M,ZHANG R,et al.Immunogenic response induced by wzm and wzt gene deletion mutants from Brucella abortus S19[J].Mol Med Rep,2014,9(2):653-658.
[13]张瑞,王秀然,夏力亮,等.牛布氏菌virB8基因的克隆及原核表达[J].中国生物制品学杂志,2012,25(7):841-843.
[14]刘艳.二甲氧基硫代磷酸酯类农药单克隆抗体研制及单链抗体三维结构模拟[D].南京:南京农业大学,2009.
[15]POPOFF M Y,LE MINOR L.Expression of antigenic factor O:54is associated with the presence of a plasmid in Salmonella[J].Ann Inst Pasteur Microbiol,1985,136B:169-177.
[16]KEENLEYSIDE W J,PERRY M B,MACLEAN L L,et al.A plasmid-encoded rfbO:54gene cluster is required for biosynthesis of the O:54antigen in Salmonella enterica serovar Borreze[J].Mol Microbiol,1994,11:437-448.
[17]AL-HENDY A,TOIVANEN P,SKURNIK M.The effect of growth temperature on the biosynthesis of Yersinia enterocolitica O:3lipopolysaccharide:temperature regulates the transcription of the rfb but not of the rfa region[J].Microb Pathog,1991,10:81-86.
[18]MANTING E H,DRIESSEN A J.Escherichia coli translocase:the unravelling of a molecular machine[J].Mol Microbiol,2000,37:226-238.
[19]CHU S,NOONAN B,CAVAIGNAC S,et al.Endogenous mutagenesis by an insertion sequence element identifies Aeromonas salmonicida AbcA as an ATP-binding cassette transport protein required for biogenesis of smooth lipopolysaccharide[J].Proc Natl Acad Sci USA,1995,92:5754-5758.
