基于SCILAB的SO2转化工艺的设计参数分析
2014-09-15,,
,,
(天津现代职业技术学院,天津 300350)
硫酸是化学工业重要的产品之一,是化学工业的基础原材料。它广泛应用于磷酸盐生产、石油化工、金属冶炼、化学医药、国防军工等工业生产部门。传统的硫酸生产工艺是在焚硫炉内用空气作为氧化剂将硫酸转化为SO2,随后在钒催化剂(其活性成分为V2O5)的作用下SO2被转化为SO3,最后SO3气体被浓硫酸吸收,可以生产出浓度高达98%的浓硫酸【1-3】。其中SO2转化工序是生产硫酸的关键,也是本文重点研究的部分。建立SO2转化工序的热力学计算模型,利用商业数学软件SCILAB的矩阵处理的核心功能,处理矩阵多项式及列表等复杂的对象,绘制出复杂的函数图形,以及系统的动态演化过程。在已有的报道中,很少涉及SO2的转化过程与数学软件模拟应用。本文对该工艺进行热力学计算,并对计算结果进行数值分析(采用二分法与梯形公式),以期为这类工艺过程的开发与设计提供理论和依据。
一、管式反应器设计
1.物料衡算:
SO2+ 1/2O2⟺SO3
1 2 3
反应速率方程为 :
(1)
式中 : 1 表示SO2, 2表示O2, 3 表示SO3。
设管式反应器内流体符合活塞流假设,对活塞流反应器(PFR)取微元体 dV,单位时间对关键组分A进行衡算,定态条件下:
按照质量守恒定律 :
输入 = 输出 + 反应量
FA=(FA+dFA)+-(-rA)dV
(2)
2.热量衡算:
由热力学第一定律知:
(a) + (b) = (c)
式中:
(a) :反应放出的热量
(b) :热损失(通过管壁换热)
(c) :反应中心的温度变化
由于SO2转化为SO3为绝热操作,热损失为0。
上式可变为:
(a) + 0 = (c)
管式反应器热量衡算公式,如下所示:
(-ΔH)rdV+0=(∑FiCpi)dT【5】
(3)
或者
(-ΔH)ASdZ+0=(∑FiCpi)dT
(4)
为了计算Cpi, 使用如下方程 :
Cpi=ai+biT+ci/T2
(5)

二、分析方法
1.平衡曲线
为了模拟该流程,绘制两条平衡曲线 :一条依据反应动力学参数,另一条依据工艺技术参数。
反应混合物的质量组成如下:
SO2: 6.26%
O2: 8.3%
N2: 85.44% (惰性气体)
反应平衡方程如下:
SO2+ 1/2O2⟺SO3Total
a b 0 100
a-n b-n n 100-1/2n
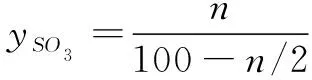
(6)
设定 : a = 6.26
(7)
b = 8.3
(8)
为了建立平衡曲线,需要研究如下的方程 : xe= f(T)
(9)
(10)
通过方程 (6), (7) 和 (8), 得到如下方程 :
(11)
(1)动力学平衡曲线
以 (xe, T)为横纵坐标系,绘制平衡曲线。设Kp=k1/k2
⟹lnKp=lnk1-lnk2
(12)
反应平衡常数如以下方程:
(13)
(14)
因此 :
(15)
求得 :
(16)
依据方程 (11) 和 (16), 可以绘制动力学平衡曲线。
(2)热力学平衡曲线
依据热力学参数,我们可以计算 Kp:
(17)

(18)
(19)
利用方程 (5) 和表1中的数据,可以计算Cpi:
(20)
现在有2个方程来表述 Kp,设定方程(11)和 方程(20)相等,可以得到一个有关 T 与 xe的方程。为了绘制热力学平衡曲线,我们需要使用二分法。
2.绝热操作
在绝热操作过程中,初始温度 T0=750°C。
使用如下的方程来计算温度的变化 :
(21)
(22)
⟹ΔHR=-23423.4
依据方程 (2.5) 和表1,可得出 :
Cpm=1.44n + 784.6
(23)
3.速度曲线与催化剂用量
(1)速度曲线
为了绘制速度曲线,需要使用二分法。因此,建立如下的方程 :
(24)
以及如下的表达式 :
(25)
(26)
(27)
(28)
(29)
注:*.rA为所有需要绘制的等速曲线的速度。
使用二分法,可以得到f(T,xe)=0(零点近似值),所需要的条件。
(2)首段催化床所需催化剂用量
在绝热操作中,可以建立如下的方程 :
T=187xe+T0
(30)
(31)
依据这两个方程,可以建立有关 rA与xe的函数曲线。使用梯形法来计算首段催化床所需的催化剂质量。
(3)梯形公式
首先,对于线性函数f(x) = Ax+ B, 对于 [a,b]实数区间,定积分公式如下:
(32)

(33)
使用梯形公式计算如下方程在[0, xe]区间面积 :
r × dW=F0× dx
(34)
当转化率等于 x和流量等于F0时,W为所需的催化剂的质量 。
4.四段连续催化床所需的催化剂用量
使用2.3.3中相同的方程,可以确定在绝热条件下,SO2转化为SO3反应中四段连续催化床所需的催化剂质量。(详情见讨论3.4.)
依据所得到的数据,绘制相关的曲线(图5)。
三、结果与讨论
1.平衡曲线
由图-1,可以清楚地看到,这两条曲线很相似,但是并不是完全重叠。这主要是由于动力学曲线依据方程(11)和(16)直接绘制的,而热力学曲线由二分法,满足精度要求后绘制而成。
2.绝热操作线
在绝热操作过程中,如图2所示反应转化率与离开床层的温度呈线性关系。因此,为得到较高转化率,必须采用多段催化。
绝热转化方程 :
T=187x + T0,T0=750K
(35)
3.速度曲线
如图3所示,原料气速度曲线为后一条依次等速线越过前面一条等速线顶点,所有的等速线在顶点附近的汇集(图中深黑色曲线)。依据该速度曲线,可以确定SO2转化为SO3反应中所需的催化剂质量。
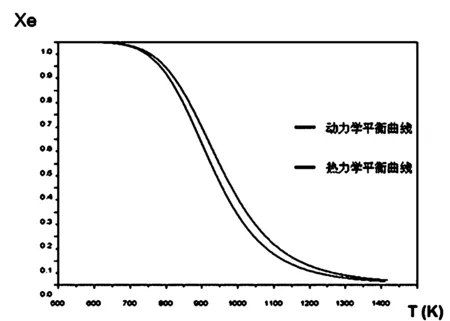
图1 动力学与热力学平衡曲线

图2 绝热操作线

图3 速度曲线
4.首段催化床所需的催化剂用量

图4 催化曲线

图5 四段连续催化床的操作曲线
利用梯形公式,可以计算首段床所需催化剂的质量。
5.四段连续催化床所需的催化剂用量
依据此操作曲线,可以确定四段连续催化床所需的催化剂用量。
为使转化率达到 0.975, 设定反应气进入催化床的初始温度为 T0= 787K。
依据前面绘制的速度曲线,当进入催化床温度为700K时,最后一段催化床转化率能达到 0.971。
从计算出的速度曲线中,我们从中选取更接近所希望得到的转化率(0.975)的速度曲线(即最后一段转化率达为0.971的速度曲线)。然后反向操作,逐渐降低各段催化床的进入温度,即最后一段催化床降低20K,第二段和第三段分别降低30K,依据前面绝热转化的计算数据,各段催化床的T0会发生变化。可以得到如下的表格:

表2 各段催化床的反应气进入温度与转化率
为了获得所需的转化率,选取最适曲线,可以得到如下的表格:

表3 四段连续催化床所需的催化剂质量
注:*. mcatal 为所需催化剂质量。
依据表3,可以绘制如下的曲线:

图6 log(mcatal)=f(xe)
由上,可以看到到当转化率越高,所需的催化剂越多,而且呈快速增长趋势。
四、结论
利用SCILAB软件可以模拟操作反应器中的各种参数,如反应温度,催化剂质量,转化率等等。
依据模拟操作的结果,当转化率为0.999时,所需的催化剂约为转化率为0.99时的40倍。显然,获取0.999的转化率是不合理的。通过该模拟操作可以避免不必要的浪费,最大限度地降低成本,实现盈利。
符号说明:
a ,b,c——常数
Cp——恒压热容(J / mol·K)
K——反应平衡常数
p——气体的压强(Pa)
T——温度( K)
ΔH——反应的焓变(J / mol)
ΔG——反应的吉布斯自由能变化(J / mol)
ν——化学反应计量因数
i——下标,表示组分
参考文献:
[1]庞婷,谭英杰,孙惠质,等.硫酸生产新工艺[J].硫酸工业,2010,(03).
[2]蒋文军.炼油厂酸性气直接制取工业硫酸技术[J].石油炼制与化工,2001,(12).
[3]周超,白峰杉.自由数学软件Scilab[J].数值计算与计算机应用,2002,(02).
[4]Kurtén T, Lane JR, Jørgensen S,Kjaergaard HG. A computational study of the oxidation of SO2 to SO3 by gas-phase organic oxidants[J].J Phys Chem A.2011.
