失交感神经支配与新骨形成及改建
2014-09-14王承勇危红英张德庆陈伟辉
王承勇, 林 海, 王 锦, 危红英, 张德庆, 卢 萌, 陈伟辉
成骨细胞和破骨细胞的增殖、分化和生长受到多重调节作用机制的影响,除了受局部生长因子、细胞因子及细胞黏附分子的调节作用外,还受到自主神经系统的调节[1-4]。Bjurholm等研究表明,在骨组织中存在无髓交感神经[5]。交感神经对于骨组织改建和新骨形成中的作用越来越受到重视。较早的研究显示,6-羟基多巴胺(6-HODA)等药物可使沙鼠中耳泡中破骨细胞活性增强,表现为骨吸收作用,认为交感神经能通过调节破骨细胞活性,促进骨吸收[6];但最近的研究则提出相反的观点,Cherruau的研究从不同角度提出,交感神经兴奋可以促进骨吸收,减少骨形成[7]。
交感神经通过分泌神经介质,包括儿茶酚胺类的β受体激动剂以及NPY等神经肽类物质,在骨改建和骨愈合中的作用是复杂和广泛的,对于其作用机制还未完全明确。本实验在建立去交感神经支配动物模型的基础上,通过建立拔牙窝骨缺损模型,探讨去交感神经支配对拔牙窝新骨形成和骨改建的调节作用。
1 材料与方法
1.1动物及仪器 5周龄清洁级雄性SD大鼠50只,体质量250~300 g[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2003-0003];多功能显微镜(AX84U-MCB,日本奥林巴斯株式会社),切片机(2035,德国徕卡微系统有限公司),并根据实验要求自制手术器械若干。
1.2实验方法 (1)失交感神经支配模型:具体建模方法参见文献[8]。50只SD大鼠按5个时间点(1,3,7,14,21 d)分为5组,每组10只,其中2只为预实验大鼠,未列入最后数据的统计分析。每组大鼠5只左侧为颈上神经节切除术组(SCGx),右侧为假手术组(CG);另5只左侧为CG组,右侧为SCGx组;SCGx组为实验组,CG组为对照组。(2)拔牙窝骨愈合模型:10%水合氯醛300~350 mg腹腔注射麻醉,仰卧位,翻开口腔暴露上颌第一磨牙,分离牙龈,小刮匙挺出上颌第一磨牙,建立拔牙窝骨愈合模型。(3)不同时间点处死大鼠并行多聚甲醛内灌注,切取大鼠上颌骨部分,置入新鲜配制4%多聚甲醛,4 ℃低温固定过夜。微波法上颌骨快速脱钙,持续脱钙直到大头针可以无阻力穿透上颌骨。
1.3H-E染色检测拔牙窝 常规H-E染色,显微拍照(×100)。利用Image-Pro Plus6.0软件对照片进行分析。选取拔牙窝区域作为兴趣区域(AOI),分析拔牙窝内组织情况。分为以下成分:血凝块和血痂(blood clot and scab, BCAS)、未矿化组织(non-mineralized tissue, NMT)、编织骨(woven bone, WB)、板层骨(lamellar bone, LB)、新生骨组织(new bone, NB)、拔牙窝面积(T.Ar)、新骨面积(B.Ar),单位均为像素(pixel)。骨组织形态计量学参数包括:
新骨面积:B.Ar(NB)=WB+LB,表示拔牙窝内新形成骨组织总和
骨体积分数:BV/TV=B.Ar/T.Ar×100%,表示既定拔牙窝内新骨形成面积与拔牙窝面积之比
各组分分数(以BCAS为例):BCAS/T.Ar×100%,表示拔牙窝内各组成成分与拔牙窝面积之比
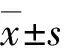
2 结 果
2.1各组拔牙窝组织形态学 (1)1 d可见拔牙窝表面大量血性渗出物覆盖,伴坏死及细菌感染。拔牙窝内血凝块形成,少量炎症细胞浸润,拔牙窝骨壁周围可见残留牙周膜以及纤维素性渗出物。未见新生血管形成,筛状板周围少量多核破骨细胞形成,伴少量骨吸收陷窝。实验组与对照组之间差别无统计学意义。(2)3 d可见拔牙窝近牙槽嵴部分有大量肉芽组织形成,血凝块机化,毛细血管形成,拔牙窝中部及底部可见明显纤维化过程,成纤维细胞生长活跃,血管数目较顶部肉芽组织少,拔牙窝底及部分样本拔牙窝壁形成纤维性骨痂,少量编织骨形成,可见破骨细胞及骨吸收陷窝增多。对照组成骨细胞及编织骨少于实验组。(3)7 d可见拔牙窝纤维细胞生长活跃,血凝块被完全机化,拔牙窝整体充满大量成熟的纤维组织,毛细血管相对生长活跃,可见明显编织骨的形成,局部可见骨化现象。侧壁出现骨吸收陷窝,筛状板因吸收表现为部分连续性中断,对照组毛细血管相对较少。(4)14 d可见纤维性骨痂充填牙槽窝,纤维组织成熟,成骨活动明显。新骨形成部位周围大量成骨细胞以及毛细血管分布,骨小梁结构明显,部分底部骨组织形成板层骨形态。对照组结构松散,排列欠规则。(5)21 d可见骨小梁生长至牙槽嵴顶,骨组织趋于成熟,但骨小梁结构较无序。骨小梁周围骨髓组织形成,血管数量明显减少。板层骨结构对照组明显少于实验组(图1)。
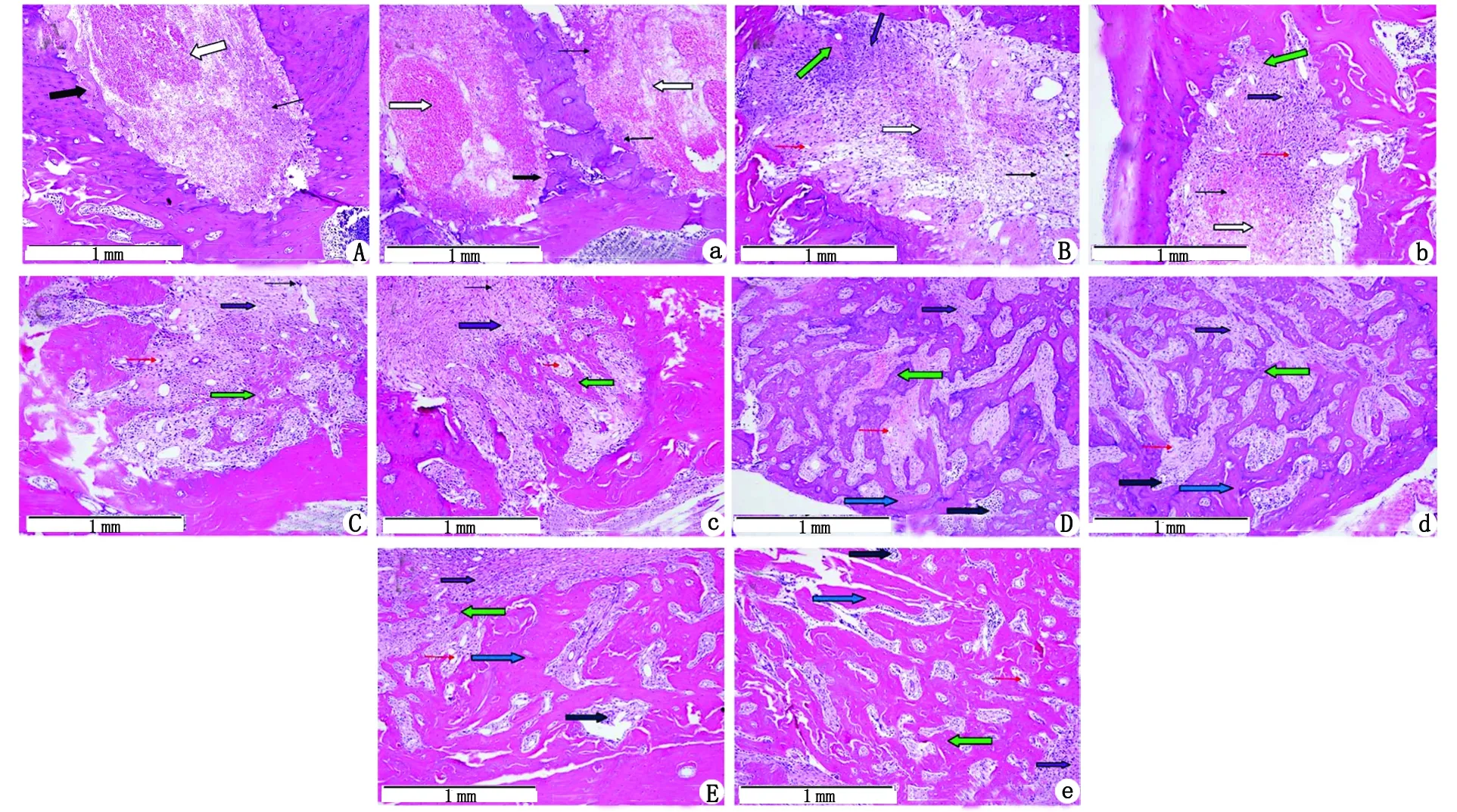
A~E:实验组;a~e:对照组. A、a:1 d;B、b:3 d;C、c:7 d;D、d:14 d;E、e:21 d. :血凝块和血痂;:牙周膜;:骨髓;:纤维性骨痂;:编织骨;:板层骨;:炎症细胞;:血管.
2.2各指标统计学分析结果
2.2.1BV/TV 在术后早期,实验组新骨形成均较对照组快,表现为新骨形成量上的差异,在达到3周之后,新骨形成在量的方面,二者之间的差别无统计学意义,显示新骨形成已经趋近于稳定的状态(图2)。
2.2.2拔牙窝各组成成分 1 d时间点,拔牙窝内由BCAS和NMT(主要是残余牙周膜)两部分组成,组成比例基本一致,差别无统计学意义。3 d时间点,随着BCAS机化的进程,NMT开始明显增多,但BCAS以及NMT在实验组与对照组之间差别无统计学意义。有少量新生的WB出现,实验组多于对照组,差别有统计学意义。7 d时间点,NMT在实验组和对照组中差别有统计学意义,反证包括编织骨和板层骨在内的NB之间,实验组量大于对照组。在NB中,WB之间差别无统计学意义,而LB差别则有意义。14 d时间点,NB及LB的形成上实验组均多于对照组;21 d时间点,NB形成上实验组与对照组之间的差别无统计学意义,但是在NB中,实验组与对照组在WB、LB比例之间的差别均有统计学意义(表1)。
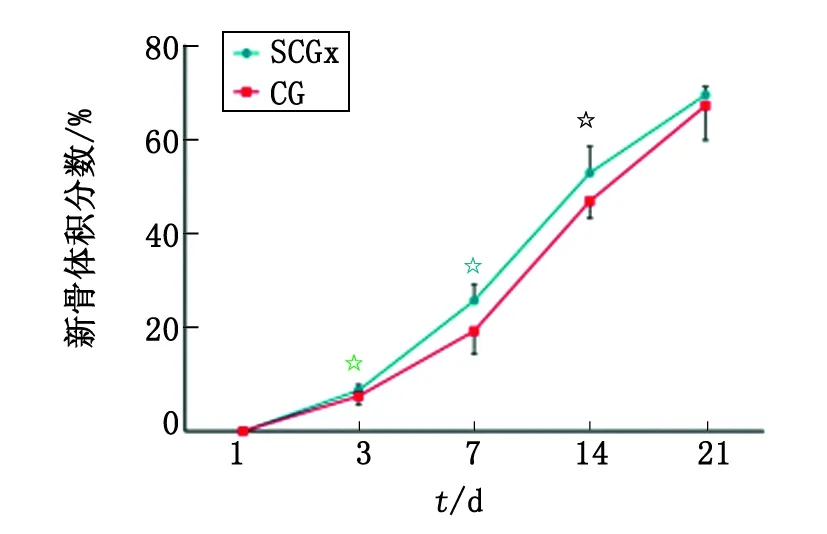
SCGx:颈上神经节切除术组;CG:假手术组. n=8. 与CG组比较,☆:P<0.05.
3 讨 论
骨组织的改建是一个动态平衡过程,骨和骨膜上分布着丰富的交感神经,而交感神经来源的信号对成骨细胞以及破骨细胞的生长与分化起着特殊的刺激作用。神经系统功能紊乱往往可以直接影响骨形成与改建,表现为局部骨质减少、病理性骨折、骨折愈合异常、拔牙后牙槽骨吸收和过量骨痂形成等[4,9-10]。
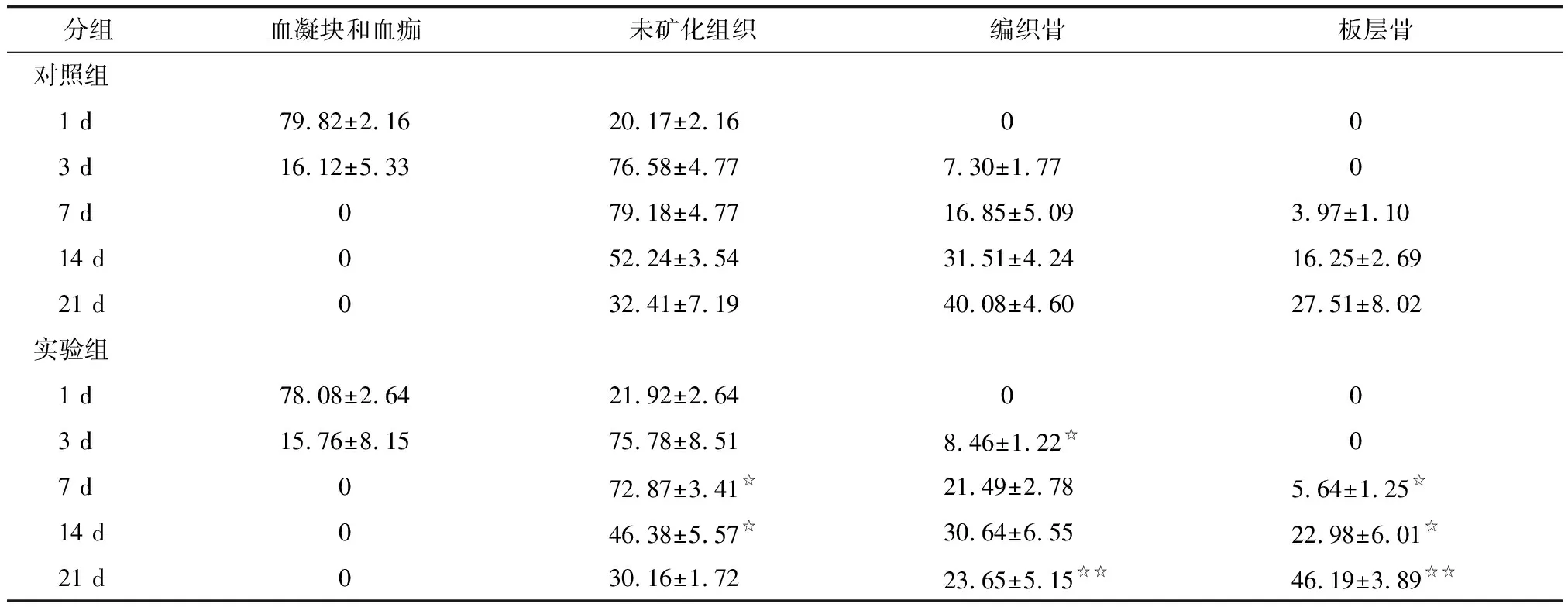
表1 各组拔牙窝构成
在之前的研究中,Sherman等利用6-HODA在沙鼠上进行试验表明,失交感神经支配可以导致骨吸收明显增加,新骨形成减弱[11]。另一项研究也表明,在失交感神经支配的下颌骨骨膜上破骨细胞增加[6]。其观点支持交感神经的作用是促进骨形成,降低骨吸收。
另一方面,Togari的研究指出,交感神经末梢对骨组织中的成骨细胞以及破骨细胞均产生影响[12];且近年来的研究指出,交感神经活动对骨形成与改建有抑制作用,其作用通过活化成骨细胞上的β-肾上腺素受体,减少骨基质形成[13-15],又通过活化成骨细胞β-肾上腺素受体,增加了RANKL的表达,后者可以增强破骨细胞活性和促进破骨细胞形成增强骨吸收作用。Okada等研究发现,应用心得安这类β-肾上腺素受体抑制剂可以抑制牙周炎大鼠骨吸收,减少牙槽嵴的骨丧失[16]。近年来的研究均表明交感神经作用可以抑制骨形成。
在本实验中,各时间段拔牙窝骨形成与改建过程在大体标本以及形态学表现上同Sato等的研究类似[17],仅在同一时间点的表现上略有不同。在拔牙术后3,7,14 d时间点上,实验组的新骨形成相对于对照组差别具有统计学意义,即失交感神经侧牙槽窝新骨骨量大于交感神经支配侧骨量,失交感神经支配对新骨形成起到促进作用。术后21 d时间点,2组之间差别已无统计学意义,新骨形成趋于稳定,这说明在抑制交感神经之后,可以更快地达到骨形成与骨吸收的平衡点。Haug等的研究从另一方面提出交感神经与感觉神经在神经生长上存在着相互竞争的作用,选择性的切断一种神经支配会导致另一种神经过度生长,继而通过增强感觉神经对骨形成的促进作用从而促进新骨形成[18]。
本实验针对新生骨组织中不同的骨质成分进行单独分析发现,在术后3~21 d的骨愈合早期,新生骨组织变化具有特别意义,不仅表现为新骨形成,并在此过程中伴随着骨改建和骨成熟。拔牙术后3~14 d时间点上不仅表现为总新骨形成差异,而且在成熟的板层骨形成差别也具有统计学意义。这个差异在21 d最为明显(P<0.01)。这说明失交感神经支配对于新骨形成不仅表现在促进骨形成,同时也促进了新骨组织的成熟,从而证实交感神经不仅抑制骨形成,也抑制骨改建,延迟了骨成熟,对于拔牙窝的完全骨愈合起到抑制作用。
综上所述,失交感神经支配不仅仅对骨形成具有促进作用,对骨改建和新骨成熟也具有显著的意义。
参考文献:
[1] 王承勇, 陈伟辉, 林 海, 等. 神经支配与种植体骨结合和骨感知的相关性[J]. 中国组织工程研究与临床康复, 2010,14(4):684-688.
[2] 陈伟辉, 乔 鞠, 田卫东. 应力作用下生长因子对成骨细胞增殖和分化的调节[J]. 国外医学口腔医学分册, 1999,26(6):347-350.
[3] Ransjo M, Lie A, Mukohyama H,etal. Miroisolated mouse osteoclasts express VIP-1 and PACAP receptors[J].BiochemBiophysResCommun, 2000,274(2):400.
[4] Boggio V, Ladizesky M G, Cutrera R A,etal. Autonomic neural signals in bone: physiological implications for mandible and dental growth[J].LifeSciences, 2004,75(4):383-395.
[5] Bjurholm A, Kreicbergs A, Terenius L,etal. Neuropeptide Y-, tyrosine hydroxylase- and vasoactive intestinal polypeptide-immunoreactive nerves in bone and surrounding tissues[J].AutonNervSyst, 1988,25(2):119-125.
[6] Sherman B E, Chole R A. Effects of catecholamines on calvarial bone resportioninvitro[J].AnnOtolRhinolLaryngol, 2001,110 (7 Pt 1):682-689.
[7] Cherruau M, Morvan F O, Schirar A,etal. Chemical sympathectomy-induced changes in TH-, VIP-, and CGRP-immunoreactive fibers in the rat mandible periosteum: influence on bone resorption[J].JCellPhysiol, 2003,194(3):341-348.
[8] 林 海, 王承勇,王 锦,等. 颈上神经节切除术构建失交感神经支配大鼠模型[J]. 福建医科大学学报, 2013,47(6):362-365.
[9] Yoshimoto M, Konig B, Allegrini S,etal. Bone healing after the inferior alveolar nerve lateralization: a histologic study in rabbits[J].JOralMaxillofacSurg, 2004,62(9):131-135.
[10] 徐 琳, 谭颖辉, 葛永玲, 等. 离断下齿槽神经对兔下颌骨骨折愈合影响的实验研究[J]. 口腔颌面外科杂志, 2006,16(1):19-22.
[11] Sherman B E, Chole R A. Effect of chemical sympathectomy with 6-hydroxydopamine on osteoclast activity in the gerbilline middle ear bulla[J].OtolNeurotol, 2001,22(2):237-241.
[12] Togri A, Arai M, Mizutani S,etal. Expression of mRNAs for neuropetide receptors and beta-adrenergic receptors in human oseoblasts and human osteogenic sarcoma cells[J].NeuroscienceLetters, 1997,233(2-3):125.
[13] Takeda S, Elefteriou F, Levasseur R,etal. Leptin regulates bone formation via the sympathetic nervous system[J].Cell, 2002,111(3):305-317.
[14] Elefteriou F, Ahn J D, Takeda S,etal. Leptin regulation of bone resorption by the sympathetic nervous system and CART[J].Nature, 2005,34(7032):514-520.
[15] Bonnet N, Brunet-Imbault B, Arlettaz A,etal. Alteration of trabecular bone under chronic beta2 agonists treatment[J].MedSciSportsExerc, 2005,037(9):1493-1501.
[16] Okada Y, Hamada N, Kim Y,etal. Blockade of sympathetic beta-receptors inhibits Porphyromonas gingivalis-induced alveolar bone loss in an experimental rat[J].ArchOralBiol, 2010,55(7):502-508.
[17] Sato H, Takeda Y. Proliferative activity, apoptosis and histogenesis in the early stages of rat tooth extraction wound healing[J].CellsTissuesOrgans, 2007,186:104-111.
[18] Haug S R, Berggreen E, Heyeraas K J. The effect of unilateral sympathectomy and cavity preparation on peptidergic nerves and immune cells in rat dental pulp[J].ExpNeurol, 2001,169(1):182-190.
