抵抗素在伴高脂血症性急性坏死性胰腺炎大鼠发病中的作用
2014-09-14林珊珊
吴 婷, 林珊珊
肥胖及高血脂与急性胰腺炎(acute pancreatitis,AP)关系密切,不仅诱发AP,而且加重胰腺组织的病理损害,但是其加重损害的机制至今未完全阐明。研究已表明,AP时抵抗素合成分泌增加[1],抵抗素具有促进炎症介质产生及微循环障碍的作用,从而加重AP的病情。伴高脂血症性AP(hyperlipidemic acute pancreatitis, HAP)时抵抗素水平的变化国内外研究较少,本研究拟通过饮食方式诱导建立高脂血症大鼠模型,研究伴与不伴高脂血症的急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)大鼠血清及胰腺组织抵抗素表达的变化,以及其与炎症细胞因子肿瘤坏死因子-α(TNF-α)之间的关系,以期进一步了解抵抗素在伴高脂血症的ANP发病机制中的可能作用。
1 材料与方法
1.1动物模型建立与分组 健康雄性SD大鼠[上海斯莱克实验动物有限公司,合格证号:SOXK(闽)2012-0001]50只,体质量170~180 g。随机分为正常对照组(C组)5只、单纯ANP组(ANP组)15只、高脂对照组(H组)15只、高脂ANP组(HAP组)15只。分别用基础饲料(C、ANP组)及高脂饲料(H、HAP组)喂养4周;高脂饲料配方[2](主要成分为87.8%基础饲料+10%猪油+2%胆固醇+0.2%胆酸钠等,购自闽侯县吴氏动物实验中心)。ANP及HAP组采用传统的手术方法制备ANP模型(3.5%牛磺胆酸钠1 mL/kg体质量,以0.2 mL/min的速度逆行胰胆管注射);C、H组采用逆行胰胆管注射生理盐水,剂量和速度同上。造模成功后4,9,24 h各处死5只大鼠,抽血测定血清淀粉酶、胆固醇(TC)、甘油三酯(TG)水平,取胰头组织行H-E染色,胰腺组织病理半定量积分参照Kusske法[3](对胰腺组织在光镜下的表现按水肿、炎症细胞浸润、坏死3方面的轻重程度评分,共分3级,无病理改变者0分,最重者9分)。
1.2血清TNF-ɑ和抵抗素水平的测定 腹腔动脉采血5~6 mL,静置1 h后3 000 r/min离心10 min分离血清,置于-20 ℃冰箱,待标本收集后吸取各组实验大鼠血清上清液50 μL,采用ELISA法测定血清TNF-ɑ和抵抗素浓度,严格按照试剂盒操作步骤进行检测。
1.3胰腺组织抵抗素及核转录因子NF-κB p65表达水平的测定
1.3.1石蜡切片制备 分别于造模后4,9,24 h各处死5只大鼠,剖腹后取胰腺组织,4%多聚甲醛固定,常规脱水、透明、石蜡包埋,切片5 μm并附于经多聚赖氨酸附膜的载玻片上,保存于4 ℃冰箱中。
1.3.2超敏二步免疫组织化学法检测胰腺组织抵抗素及NF-κB p65表达水平 石蜡切片置于37 ℃恒温箱中烤片过夜,经二甲苯脱蜡、梯度乙醇水化、抗原修复、阻断内源性过氧化物酶、血清封闭等处理后,滴加一抗(1∶100兔抗大鼠NF-κB p65抗体及1∶25羊抗大鼠抵抗素抗体,购自Santa Cruz公司)后置于湿盒中,37 ℃恒温箱中孵育2 h,滴加试剂1(Polymer Helper)室温孵育20 min,滴加试剂2(poly-HRP anti-Rabbit IgG)室温孵育20 min,DAB显色,苏木素复染,自来水冲洗,脱水透明,封片镜检。阳性对照由购买相应抗体的试剂公司提供,PBS替代一抗作阴性对照。
1.3.3使用专业图像分析软件Image-Pro Plus计算各组胰腺组织抵抗素及NF-κB p65表达的平均光密度值。
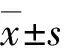
2 结 果
2.1模型鉴定 全部大鼠饲养4周后手术,直至模型制备完毕后24 h,各组大鼠无一死亡,其中C、H组大鼠状态较好,大多数可活动或饮水,ANP、HAP组大鼠大多精神萎靡、懒动,基本无活动或饮水。造模成功率100%。
ANP组血清淀粉酶水平较C、H组明显升高,高脂饲料组血清TC、TG水平高于正常饲料组,差别有统计学意义(P<0.01)。光镜下观察,ANP、HAP组胰腺组织明显水肿,尤其是HAP组,造模后9,24 h在坏死、出血、炎性细胞浸润程度、胰腺组织病理学评分等方面较ANP组显著加重,差别有统计学意义(P<0.05,表1)。

表1 各组血清淀粉酶、血脂水平及胰腺组织病理学评分
2.2大鼠血清TNF-ɑ水平测定结果 与C组比较,ANP组和HAP组大鼠术后4 h血清TNF-ɑ水平已明显升高,24 h时达到高峰,各时间点血清TNF-ɑ浓度明显高于对照组,差别有统计学意义(P<0.01);与ANP组比较,HAP组大鼠术后4和9 h TNF-ɑ水平无明显变化(P>0.05),但24 h明显升高(P<0.05),具体见表2。
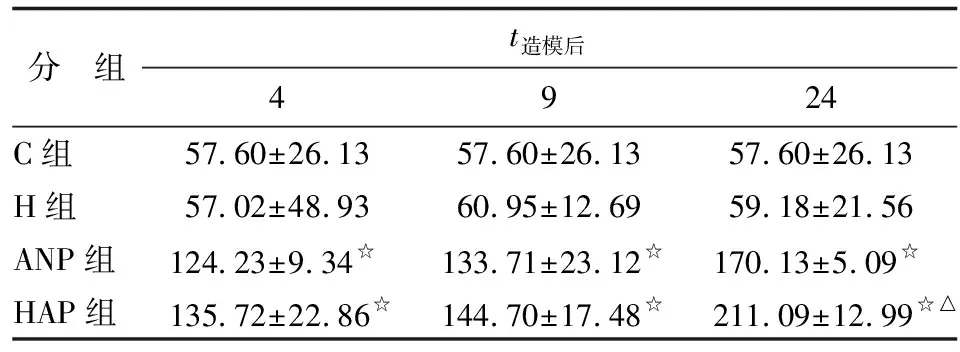
表2 血清TNF-ɑ水平
2.3大鼠血清抵抗素水平测定结果 与C组比较,ANP组大鼠术后4 h血清抵抗素水平开始升高,24 h时达到高峰,明显高于对照组,差别有统计学意义(P<0.01);与H组比较,HAP组大鼠术后4 h血清抵抗素浓度开始升高,24 h时浓度明显高于H组,差别有统计学意义(P<0.01);与ANP组比较,HAP组大鼠术后各时间点抵抗素水平均明显高于ANP组,差别有统计学意义(P<0.01),见表3。

表3 血清抵抗素水平
2.4血清抵抗素水平与TNF-ɑ水平、胰腺组织病理学评分相关分析 血清TNF-ɑ和抵抗素水平均在造模后迅速上升,至24 h达高峰,HAP组和ANP组的血清抵抗素水平和TNF-ɑ水平均呈正相关关系(r=0.365和r=0.698,P<0.05),ANP组胰腺组织病理学评分与血清抵抗素、TNF-ɑ水平均呈正相关(r=0.657和r=0.732,P<0.05),HAP组胰腺组织病理学评分与血清抵抗素、TNF-ɑ水平均呈正相关(r=0.632和r=0.661,P<0.05)。
2.5大鼠胰腺组织NF-κB p65表达水平 造模后早期胰腺组织NF-κB p65表达水平即升高,与C组和H组比较,ANP组和HAP组4 h胰腺组织NF-κB p65表达增加,差别有统计学意义(P<0.01),主要表达于胰腺腺泡细胞和间质炎症细胞,随着时间延长,NF-κB p65表达逐渐增加,24 h达高峰(图1)。HAP组各时间点胰腺组织NF-κB p65表达水平均较ANP组增高,差别有统计学意义(P<0.05),具体见表4。

表4 胰腺组织NF-κB p65平均光密度值
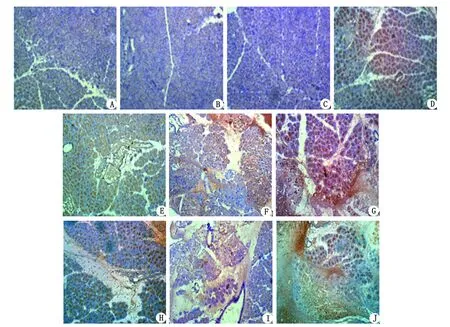
A:C组,B:H4h组,C:H9h组,D:H24h组,E:ANP4h组,F:ANP9h组,G:ANP24h组,H:HAP4h组,I:HAP9h组,J:HAP24h组. C组及H组各时间点胰腺组织均未见明显NF-κB p65表达,ANP组及HAP组各时间点均可见NF-κB p65表达,主要表达于腺细胞胞质及小叶间质中. NF-κB p65表达呈时间依赖性,随时间的延长,表达逐渐增加;与ANP组比较,HAP组各时间点有更明显的NF-κB p65表达.
2.6大鼠胰腺组织抵抗素表达水平 与C组比较,H24h组胰腺组织抵抗素表达水平有所增加,差别有统计学意义(P<0.05);与C组和H组比较,ANP4h和HAP4h胰腺组织抵抗素表达增加,差别有统计学意义(P<0.01),见图2,表5。
2.7胰腺组织抵抗素表达水平与胰腺组织NF-κBp65表达水平、胰腺组织病理学评分相关分析 胰腺组织抵抗素和NF-κB p65表达水平在造模后迅速上升,至24 h达高峰,HAP组和ANP组的胰腺组织抵抗素表达水平和NF-κB p65表达水平呈正相关关系(r=0.839和r=0.957,P<0.01),ANP组胰腺组织病理学评分与胰腺组织抵抗素及NF-κB p65表达水平均呈正相关(r=0.946和r=0.944,P<0.01),HAP组胰腺组织病理学评分与胰腺组织抵抗素及NF-κB p65表达水平均呈正相关(r=0.904和r=0.857,P<0.01)。
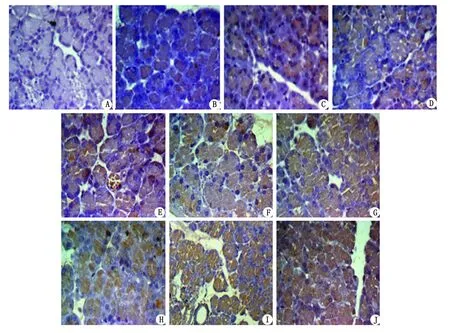
A:C组,B:H4h组,C:H9h组,D:H24h组,E:ANP4h组,F:ANP9h组,G:ANP24h组,H:HAP4h组,I:HAP9h组,J:HAP24h组. C组及H组各时间点胰腺组织均未见明显抵抗素表达,ANP组及HAP组各时间点均可见抵抗素的表达,主要表达于胰腺腺泡细胞和胰腺坏死区域中;抵抗素表达呈时间依赖性,随时间的延长,表达逐渐增加.

表5 胰腺组织抵抗素平均光密度值
3 讨 论
SAP是全身炎症反应性疾病,其病理过程是胰腺腺泡内胰酶的异常激活,活化的胰酶对胰腺组织自身进行消化,导致单核巨噬细胞的激活、炎症介质的释放,最后通过炎症介质的相互作用促进炎症的扩大[4]。细胞因子属于炎症介质的范畴,目前认为与AP关系较为密切的细胞因子有TNF-α、IL-1、IL-6及IL-8等,这些炎症细胞因子的表达在基因水平上受到转录因子NF-κB的调控。NF-κB信号通路参与了AP的发病及病情发展,多项研究均发现,AP早期即有NF-κB的活化,胰腺组织NF-κB表达增加,药理学抑制NF-κB能够改善胰腺炎的病情,通过逆转录病毒介导胰腺p65和IKK2表达能够引起胰腺炎[5-8]。Huang等通过转基因途径构建胰腺组织编码p65的小鼠动物模型,通过与正常小鼠的比较发现:p65转基因小鼠经哇皮素诱导胰腺炎模型后有更高的炎症因子水平,胰腺组织病理损害更重。持续3月的胰腺组织NF-κB活化导致了胰腺组织类似慢性胰腺炎的病理改变[9]。本实验结果也显示,AP造模后4 h胰腺组织NF-κB p65表达水平即升高,随着时间延长,NF-κB p65表达逐渐增加,24 h达高峰,胰腺组织病理学评分与胰腺组织NF-κB p65表达水平均呈正相关。与ANP组比较,HAP组胰腺组织病理损害更重,同时胰腺组织NF-κB p65表达水平更高。
脂肪细胞因子抵抗素作为上游炎症介质,具有调节新陈代谢和免疫反应的作用,它不仅能够募集炎症细胞,刺激TNF-α、IL-2、IL-6等促炎细胞因子的释放,还可以促进微循环障碍的形成[10-11],从而加重AP的病情。AP患者及动物实验中都观察到升高的抵抗素水平,抵抗素升高的水平与病情的严重程度及血清CRP水平呈正相关,能够作为胰周脂肪坏死的标志,可以预测胰周脂肪坏死的范围及病情的严重程度[1],这些均提示AP时胰周脂肪组织坏死释放的抵抗素可能通过促炎症作用而加重病情。目前关于抵抗素与AP的研究多为临床研究,国内徐克群等通过L-精氨酸腹腔内注射诱导大鼠ANP模型,发现ANP模型大鼠血清和胰腺组织的抵抗素表达水平明显升高,与血清TNF-α、IL-1β、CRP水平和胰腺组织病理评分呈正相关,注射重组抵抗素后,血清TNF-α、IL-1β水平升高[12]。本实验结果显示,与C组相比,ANP组和HAP组造模术后4 h血清及胰腺组织抵抗素表达开始升高,24 h达高峰,血清抵抗素水平与TNF-α水平呈正相关,胰腺组织抵抗素表达与NF-κB p65表达、胰腺组织病理学评分呈正相关,也支持抵抗素可能通过NF-κB信号途径促进TNF-α的释放参与ANP病情的发生发展。
随着膳食结构的改变,高脂血症及肥胖人群增加,高脂血症肥胖与胰腺炎之间的因果关系存在争议。本课题组前期研究证实了高脂血症不仅诱发AP,而且能加重AP时胰腺组织的病理损害[13-14]。杨体雄等的研究发现,在相同致病因素前提下,高TG血症是导致胰腺炎进一步发展的促进因素[15]。同时临床研究发现,肥胖是胰腺炎发生发展的一个危险因素,与非肥胖患者相比,肥胖患者胰腺炎的发生率更高,尤其腹型肥胖与AP病情的严重性相关[16-18],这些观察提示腹腔内脂肪组织可能在AP发病中起重要的病理生理作用。国内外一些研究[1,12]及本研究均证实,AP时胰腺组织及胰周脂肪细胞坏死可能引起抵抗素的释放,促进炎症反应,而高脂肥胖双重致病因素作用下的胰腺炎抵抗素的表达怎样尚未见相关报道。本实验通过高脂喂养4周,经淀粉酶、血脂、病理评分等评估,说明高脂饲料喂养4周能够成功建立伴高脂血症性ANP大鼠模型,高脂血症能加重急性胰腺炎时胰腺组织的病理损害。实验结果显示,与C组和H组比较,ANP和HAP组各时间点血清及胰腺组织抵抗素表达水平均明显升高,差别有统计学意义,表明抵抗素参与了重症AP的发病。与ANP组各时间点比较,HAP组血清及胰腺组织抵抗素表达水平更高,差别有统计学意义,而且与TNF-α、与NF-κB p65表达、胰腺组织病理学评分呈正相关,这一实验结果表明,在相同致病因素前提下,高脂肥胖可能通过增加血清及胰腺组织抵抗素的表达激发炎症细胞因子的释放从而导致胰腺组织病理损害较重。当然,脂肪细胞因子除抵抗素外还有脂联素、内脂素等,关于其他脂肪细胞因子在AP发病中扮演怎样角色,还有待深入研究。
总之,通过本研究,笔者认为抵抗素参与了重症AP的发病过程,可能通过促进转录因子NF-κB p65的表达及TNF-α的释放发挥生物学效应,在伴高脂血症性重症AP中,抵抗素的过表达可能是加重病情的原因之一。
参考文献:
[1] Schaffler A, Hamer O, Dickopf J,etal. Admission resistin levels predict peripancreatic necrosis and clinical severity in acute pancreatitis[J].AmJGastroenterol, 2010,105(11):2474-2484.
[2] 吴 婷, 王昭智. 一氧化氮在伴高脂血症急性出血坏死性胰腺炎大鼠胰腺及肾损害中的作用[J]. 世界华人消化杂志, 2011,19(10):1022-1027.
[3] Xu P, Zhou X J, Chen L Q,etal. Pioglitazone attenuates the severity of sodium taurocholate-induced severe acute pancreatitis[J].WorldJGastroenterol, 2007,13(13):1983-1988.
[4] Bhatia M, Wong F L, Cao Y,etal. Pathophysiology of acute pancreatitis[J].Pancreatology, 2005,5(2-3):132-144.
[5] Sah R P, Garg P, Saluja A K. Pathogenic mechanisms of acute pancreatitis[J].CurrOpinGastroenterol, 2012,28(5):507-515.
[6] Satoh A, Shimosegawa T, Fujita M,etal. Inhibition of nuclear factor-kappaB activation improves the survival of rats with taurocholate pancreatitis[J].Gut, 1999,44(2):253-258.
[7] Chen X, Ji B, Han B,etal. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response[J].Gastroenterology, 2002,122(2):448-457.
[8] Algul H, Treiber M, Lesina M,etal. Pancreas-specific RelA/p65 truncation increases susceptibility of acini to inflammation-associated cell death following cerulein pancreatitis[J].JClinInvest, 2007,117(6):1490-1501.
[9] Huang H, Liu Y, Daniluk J,etal. Activation of nuclear factor-kappaB in acinar cells increases the severity of pancreatitis in mice[J].Gastroenterology, 2013,144(1):202-210.
[10] Pirvulescu M, Manduteanu I, Gan A M,etal. A novel pro-inflammatory mechanism of action of resistin in human endothelial cells: up-regulation of SOCS3 expression through STAT3 activation[J].BiochemBiophysResCommun, 2012,422(2):321-326.
[11] Falcao-Pires I, Castro-Chaves P, Miranda-Silva D,etal. Physiological, pathological and potential therapeutic roles of adipokines[J].DrugDiscovToday, 2012,17(15-16):880-889.
[12] 徐克群, 薛乐宁, 龚燕芳, 等. 罗格列酮在急性坏死性胰腺炎中对抵抗素的影响[J]. 中华消化杂志, 2010,30(7):493-495.
[13] Ponzo O, Schreier L, Resnik R,etal. Endogenous hypertriglyceridemia intensifies the course of cerulein-induced pancreatitis in rat: relation with changes in the VLDL composition[J].AnnNutrMetab, 2006,50(1):37-44.
[14] Zhang W, Zhao Y, Zeng Y, etal. Hyperlipidemic versus normal-lipid acute necrotic pancreatitis: proteomic analysis using an animal model[J].Pancreas, 2012,41(2):317-322.
[15] 杨体雄, 周亚魁, 何跃明, 等. 高甘油三脂血症对急性胰腺炎的发生及其病理损害程度的影响[J]. 中华实验外科杂志, 2001,18(6):544-545.
[16] Chen S M, Xiong G S, Wu S M. Is obesity an indicator of complications and mortality in acute pancreatitis An updated meta-analysis[J].JDigDis, 2012,13(5):244-251.
[17] Hong S, Qiwen B, Ying J,etal. Body mass index and the risk and prognosis of acute pancreatitis: a meta-analysis[J].EurJGastroenterolHepatol, 2011,23(12):1136-1143.
[18] Sadr-Azodi O, Orsini N, Andren-Sandberg A,etal. Abdominal and total adiposity and the risk of acute pancreatitis: a population-based prospective cohort study[J].AmJGastroenterol, 2013,108(1):133-139.
