Real time-PCR检测循环DNA基因对原发性肝癌的临床诊断价值
2014-09-13郭丽萍
郭丽萍
原发性肝癌(prjmary hepatic cancer,PHC)是肝细胞或肝内胆管细胞发生癌变导致的肝癌,是消化系统最为常见的恶性肿瘤,主要包括肝细胞癌(hepatic cellular cancer,HCC)、肝内胆管细胞癌(intrahepatic bile duct cellular cancer,ICC)和肝细胞癌-肝内胆管细胞癌混合型等不同病理类型,其中90%患者为肝细胞癌(hepatocellular carcinoma,HCC)[1]。目前血清AFP是诊断肝癌(HCC)的重要指标和特异性最强的肿瘤标记物,国内常用于肝癌的普查、早期诊断、术后监测和随访;在本研究中,我们采用real time-PCR方法,通过检测血浆循环DNA载量表达情况,探讨循环DNA的临床早期筛查价值,为循环DNA作为原发性肝癌早期筛查肿瘤标志物提供科学实验依据。
1 材料与方法
1.1 研究对象
选取2008年6月至2013年6月于我院收治的肝病患者,根据《中国常见恶性肿瘤诊疗规范》第二分册原发性肝癌或《原发性肝癌诊疗规范(2011年版)》诊疗标准,经临床症状、影像学检查、肿瘤标志物及病理检查诊断为原发性肝癌后确定为研究对象[2-3]。经诊断符合本研究目的患者共63例,男性41例(65.1%),女性22例(34.9%),平均年龄为(58±19.6)岁,其中有淋巴结转移者36例(57.1%)。此外选取25例经体检健康的志愿者作为正常对照组,平均年龄为(56±18.6)岁。
1.2 血浆DNA提取
无菌采取研究对象患者组及对照组志愿者血液2~3 ml,分离血浆,根据天根DNA提取试剂盒(北京天根生化科技有限公司)说明书提取血液基因组DNA,-20℃保存备用。
1.3 引物及荧光探针设计合成
根据已发表文献选取β-globin 基因(GenBank ID:U01317)作为目的基因分析循环DNA血液载量,引物为,β-globin-F:5’-GTG CAC CTG ACT CCT GAG GAG A-3’;β-globin-P:5’-CCT TGA TAC CAA CCT GCC CAG-3’;Taqman荧光探针:5’-(FAM)AAG GTG AAC GTG GAT GAA GTT GGT GG(TAMAAR)-3’。上述所有引物序列均由Invitrogen(北京)公司合成。
1.4 循环DNA real time-PCR载量检测
Real-Time PCR检测原发性肝癌患者和对照组志愿者人群循环DNA血浆载量,采用ABI 7500 Fast实时荧光定量PCR仪(Lifetechnology公司,美国)和TransStart®Probe qPCR SuperMix试剂盒(北京全式金生物技术有限公司),按试剂盒实验说明书推荐体系(20 μl)及说明书中的PCR(三步法)进行实验;采用ABI Taqman质控试剂盒(Lifetechnology公司,美国),以104ng/ml、103ng/ml、102ng/ml、101ng/ml、100ng/ml作为终浓度建立标准曲线。根据real time-PCR检测样品Ct值及标准曲线,计算原发性肝癌患者和对照组志愿者血浆循环DNA载量,比较原发性肝癌患者确诊前后血浆循环DNA含量、原发性感染淋巴结转移前后血浆循环DNA含量,及与对照组血浆DNA含量的比较。
1.5 统计学处理

2 结果
2.1 原发性肝癌确诊前后血浆循环DNA载量变化
检测原发性肝癌患者确诊前24个月及确诊后血浆循环DNA的变化,行对比分析,结果显示:原发性肝癌患者确诊后的血浆循环DNA载量显著高于确诊前(P<0.01),也显著高于对照组(P<0.01);确诊前6个月血浆循环DNA载量显著高于确诊前12个月、18个月、24个月及对照组的(P<0.01);确诊前12个月、18个月、24个月血浆循环DNA载量与对照组相比,虽无统计学差异(P>0.05),但数值上也高于对照组,且确诊前24个月至确诊前12个月血浆循环DNA载量呈上升趋势,无统计学差异(P>0.05)(表1,图1)。

表1 原发性肝癌患者确诊前后及对照组血浆循环DNA载量
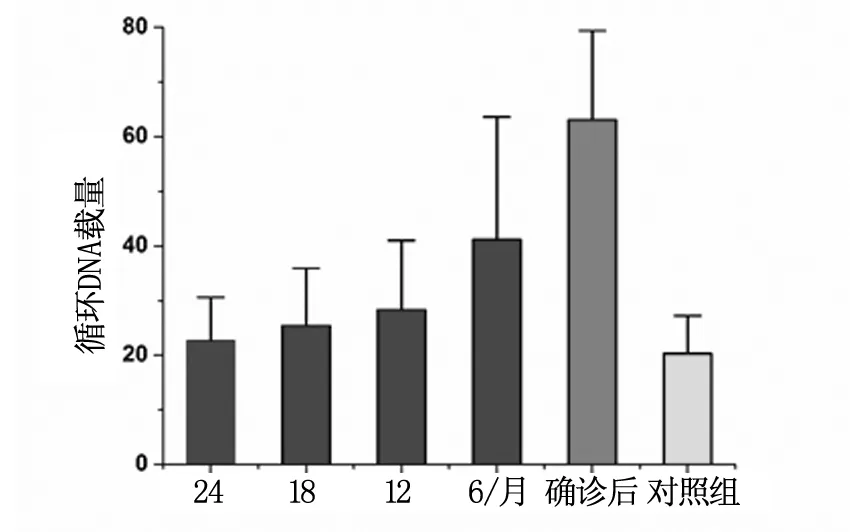
图1 原发性肝癌患者确诊前后及对照组血浆循环DNA载量
2.2 原发性肝癌有无淋巴结转移患者间血浆循环DNA载量比较
比较有淋巴结转移的原发性肝癌患者和无淋巴结转移肝癌患者血浆DNA载量,结果显示:有淋巴结转移原发性肝癌患者血浆DNA载量[(79.3±13.7 )ng/ml]显著高于无淋巴结转移原发性肝癌患者[(52.1±12.5)ng/ml],经统计学分析,P<0.01,两组间差异显著(图2)。
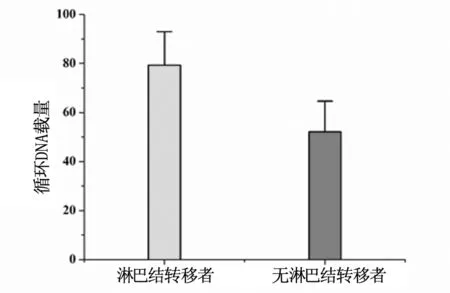
图2 原发性肝癌有无淋巴结转移患者间血浆循环DNA载量比较
3 讨论
循环DNA(circulating DNA)又称循环核酸,是1种游离于细胞外的、存在于各种体液中的DNA。Mandel和Metais于1947年最早发现了循环DNA的存在,但是受当时实验条件和方法的限制并没能查明其余疾病的关系[4]。1977年,Leon等于Cancer Research杂志发表文章称肿瘤患者血浆循环DNA载量水平显著高于健康人群,首次阐明了血浆循环DNA与肿瘤疾病的关系[5]。随后的研究也证实了肿瘤细胞DNA 与血浆循环DNA的关系,2种DNA之间存在着一致的基因突变[6]。1999-2003年期间召开的3次“血浆/血清循环核酸在癌症的诊断、预后及随访的应用”研讨会预言血浆循环DNA的检测将为临床肿瘤的早期筛查诊断及病程预测提供新的微创的、敏感的、特异的分子生物检测手段。随后的关于肺癌、乳腺癌及鳞癌的研究证实了血浆循环DNA在肿瘤病程预测及早期筛查中的作用[7]。
张博恒等利用AFP和B超检查手段对高危人群每隔6个月进行一次肝癌筛查,结果显示早期筛查有助于肝癌早发现,可使肝癌患者死亡率下降37%,因此,对高危人群的早期筛查是原发性肝癌早期发现的重要途径[8]。然而,由于AFP 的敏感性和特异度不高,美国肝病研究学会(AASLD)已不再将AFP作为筛查指标。在本研究中,我们采用real time-PCR的方法检测了血浆循环DNA在原发性肝癌临床早期筛查和诊断的意义,结果显示原发性肝癌确诊前的24个月、18个月、12个月的血浆循环DNA载量和对照组健康人群的血浆循环DNA无显著性差异,但是确诊前6个月的血浆循环DNA显著高于24个月、18个月和12个月的血浆循环DNA载量,而确诊后的血浆DNA载量显著高于确诊前的24个月、18个月、12个月和6个月的血浆DNA载量,这些结果提示我们确诊前6个月的血浆循环DNA载量具有诊断性价值,同时也提示我们血浆循环DNA载量在原发性肝癌早期筛查和诊断的临床可行性。上述结果和任宁、张雪峰等的研究结果是一致的[7,9]。淋巴结转移原发性肝癌患者和淋巴结未转移患者血浆循环DNA分析结果显示发生淋巴结转移的原发性肝癌患者血浆DNA载量显著高于未发生淋巴结转移的原发性肝癌患者(P<0.01),提示我们血浆循环DNA可以作为早期原发性肝癌筛查和诊断,以及判断原发性肝癌病程的一个有价值的检测指标。
在本研究中,我们的实验结果证实了血浆循环DNA在原发性肝癌早期筛查和诊断中的价值,同时也可以用于判定原发性肝癌病程或有无淋巴结转移;由于血清甲胎蛋白敏感性和特异性的不足,real time-PCR检测血浆循环DNA有可能成为原发性肝癌早期筛查和诊断的一个新临床标准。
[1] Lo RC,Ng IO.Hepatic Progenitor Cells:their role and functional significance in the New Classification of Primary Liver Cancers〔J〕.Liver Cancer,2013,2(2):84-92.
[2] 钦伦秀,孙惠川,汤钊猷,等.原发性肝癌研究进展——2006沪港国际肝病大会纪要〔J〕.中华外科杂志,2006,44(15):1070-1074.
[3] Leon SA,Shapiro B,Sklaroff DM,et al.Free DNA in the serum of cancer patients and the effect of therapy〔J〕.Cancer Res,2007,37(3):646-650.
[4] Emmanuelle G,Elodie C,Paolo V,et al.Circulating free D-
NA is hplasma or serum as biomarker of carcinogenesis,practical aspects and biological significance〔J〕.Mutat Res,2011,6(35):105-117.
[5] 任 宁,钦伦秀,屠 红,等.肝细胞癌病人血浆循环DNA定量分析及其临床意义〔J〕.复旦学报(医学版),2011,32(2):134-138.
[6] 蔡永娥,乔建锦,孙晓茹,等.我国原发性肝癌研究进展〔J〕.现代肿瘤医学,2008,16(1):141-143.
[7] 张雪峰,王 斌,钱冬萌,等.循环DNA和HBV-DNA载量与原发性肝癌的相关性探讨〔J〕.现代生物医学进展,2011,11(19):3713-3715.
[8] Ito H,Yonemura Y,Fujita H,et al.Prognostic relevance of urokinase-type plasminogen activator(uPA)and plasminogen activator inhibitors PAI-1 and PAI-2 in gastric cancer〔J〕.Virchows Arch,1996,427(5):487-496.
[9] Plebani M,Herszenyi L,Carraro P,et al.Urokinase-type pla-
sminogen activator receptor in gastric cancer:tissue expression and prognostic role〔J〕.Clin Exp Metastasis,1997,15:418-422.
