肝癌细胞中SPARC表达及其与糖酵解作用的相关性
2014-09-13华红伟胡薇薇
华红伟 姜 峰 胡薇薇 李 静 丁 罡
分泌性富含半胱氨酸的酸性蛋白(secreted protien acidic and rich in cysteine,SPARC)是细胞外基质非胶原糖蛋白中的1种钙结合蛋白,也称骨连接蛋白(osteonectin)[1]。SPARC基因定位于人类染色体5q31.3-q32[2],编码由298-304个氨基酸组成的蛋白质。SPARC蛋白参与多种生物学过程,包括胚胎发育,成骨组织形成,伤口愈合及组织重建等[3];同时,与肿瘤的发生发展也密切相关,主要涉及新生血管的形成[4],调控细胞周期,调节细胞的粘附作用[5]等过程,但SPARC与肿瘤细胞糖酵解之间的调节关系及作用机制目前尚未见报道。
糖酵解作用中己糖激酶(hexokinase 2,HK)是第一个限速酶,当细胞中HK活力增强时,6-磷酸葡萄糖增加,为糖酵解提供充足的碳源和能源[6];乳酸脱氢酶(lactate dehydrogenase-A,LDHA)是糖酵解途径的末端酶,催化丙酮酸转化为乳酸,LDHA在多种肿瘤中高表达,提示LDHA与肿瘤的发生发展有密切的关系。本研究以肝癌细胞HepG2、Hep3B、Huh7为研究对象,观察SPARC表达与HK-Ⅱ及LDHA活性之间的相互作用关系,初步探究SPARC与糖酵解作用之间的相互关系及作用机制。
1 材料与方法
1.1 细胞
本实验选取HepG2、Hep3B、Huh7人肝癌细胞作为研究对象,购自于美国菌种保藏中心细胞库(ATCC)。细胞株培养于含5%二氧化碳、温度为37.5 ℃、饱和湿度的培养箱中,所用DMEM培养液中加入10%胎牛血清及青-链霉素双抗(penicillin-streptomycin,PS)。
1.2 主要试剂及耗材
SPARC质粒及siRNA购自于北京傲锐东源生物科技有限公司;Oligofectamine、pti-MEM®I 低血清培养基购自于Invitrogene 公司;乳酸脱氢酶活性检测试剂盒购自于BioVision公司;己糖激酶比色检测试剂盒购自于Sigma公司。
1.3 实验方法
1.3.1 质粒/siRNA的转染 转染前一天取出对数生长期的细胞,以每孔3-5×105密度接种于6孔细胞培养板上,当细胞融合率在70%~80%时进行转染实验;将浓度梯度为2 μg/ml,4 μg/ml,6 μg/ml的质粒分别加入Opti-MEM I低血清培养基,共100 μl轻轻摇匀;以Oligofectamine作为转染载体,按照质粒(μg):Oligofectamine(μl)=1∶2的比例加入Oligofectamine,用Opti-MEM I 低血清培养基稀释,总体积为100 μl,在室温下孵育5 min;将上述两种混合物混合(共200 μl),室温下孵育30 min,直到质粒:Oligofectamine复合物形成;将复合物加入到细胞培养板中,37 ℃、CO2培养箱孵育8 h。24 h后换液,再过24 h收集细胞评估转染效率,并筛选出最佳质粒浓度。
1.3.2 比色法检测HK/LDHA活性 检测前一天,将转染后的细胞以2×105/孔密度接种于24孔板中;弃去原培养液,PBS漂洗细胞2次,将细胞培养板用多孔板离心机400 r/min离心5 min,吸去上清液;加入用PBS稀释10倍后的试剂盒提供的HK/LDHA释放试剂150 μl,适当摇晃混匀,在细胞培养箱中孵育1 h;应用己糖激酶检测试剂盒/乳酸脱氢酶检测试剂盒,按照说明书方法通过一系列HK/LDHA标准品及相应测得的吸光度值绘制标准曲线,应用酶标仪分别在563 nm及490 nm处检测吸光度(OD值),间接反映HK,LDHA活性的变化。每个样品重复测定3次。
2 结果
转染SPARC质粒的肝癌细胞中HK的活性与对照组相比明显下降,HepG2/Hep3B/Huh7 3种肝癌细胞中HK-Ⅱ的相对吸光度分别降低至(57.45±5.05)%、(56.1±5.70)%、(49.73±7.06)%,P<0.05);反之,siRNA抑制SPARC表达后的细胞中,3种细胞中HK-Ⅱ的相对吸光度分别上调至(174.20±8.41)%、(166.69±9.71)%、(152.84±3.39)%,有显著性差异(P<0.05)(图1,表1)。
转染SPARC质粒的肝癌细胞中LDHA的活性与对照组相比明显下降,HepG2/Hep3B/Huh7 3种肝癌细胞中LDHA的相对吸光度分别降低至(50.53±8.07)%、(54.38±2.08)%、(42.34±3.44)%;反之,siRNA抑制SPARC表达后的HepG2细胞中,LDHA的活性较对照组明显上调,3种肝癌细胞中LDHA的相对吸光度分别上调至(176.65±6.85)%、(163.24±6.44)%、(151.25±6.75)%,有显著性差异(P<0.05)(图2,表2)。
3 讨论
SPARC具有多种生物学功能,在多种肿瘤中,如乳腺癌[7]、神经胶质瘤[8]、黑色素瘤[9]中均表现为高表达,它与肿瘤的发生、侵袭、转移等病理过程密切相关[10],在肿瘤发生发展中的作用及对肿瘤信号传导通路的调节功能较复杂,并且具有组织特异性,目前的研究主要集中于SPARC对肿瘤新生血管形成、EMT转变、相关生长因子及受体表达、以及蛋白水解酶表达等调节作用方面[11]。糖酵解代谢是恶性肿瘤细胞获取能量的主要来源,肿瘤细胞糖酵解活跃程度与肿瘤生长速度和侵袭性有密切关切,但SPARC与糖酵解作用的相互关系研究较少。
本研究以肝癌细胞HepG2、Hep3B、Huh7为研究对象,分别转染SPARC与siRNA SPARC,以促进SPARC高表达或抑制SPARC基因的表达,应用比色法检测在SPARC不同表达水平时,糖酵解关键酶HK-Ⅱ与LDHA的活性变化,观察SPARC与这两种糖酵解关键酶活性之间的相互关系,初步探究了肿瘤细胞中SPARC表达与糖酵解作用是否关联。实验结果显示,SPARC过表达的细胞中,HK-Ⅱ、LDHA的活性明显下调,而当应用siRNA抑制SPARC表达时,HK-Ⅱ、LDHA的活性明显上调,差异具有统计学意义(P<0.05),提示肝细胞癌中,SPARC的表达水平与细胞糖酵解作用相互关联,SPARC通过负性调控糖酵解作用的关键酶HK-Ⅱ、LDHA参与介导肝癌细胞的糖酵解作用,进而影响肿瘤的发生发展,而Le Bail 等的报道显示SPARC在肝细胞癌的基质中呈高表达水平,并与肝癌的恶性程度有关[12],陈科济等[13]利用RT-PCR技术分别检测 62 例HCC及相应癌旁组织标本、30例正常肝组织标本中 SPARC mRNA 的表达,结果显示SPARC 在HCC癌组织中表达上调,在正常肝组织中低表达,因此SPARC在肿瘤细胞中表现出促癌或抑癌作用还有待进一步明确,同时相关生物学作用是否与肝癌细胞的类型、不同肿瘤的病理类型、肿瘤分期相关尚未清晰。同时,目前另有研究表明,SPARC与AMP激活的蛋白激酶(AMP-activated protiein kinase,AMPK)信号传导通过具有相互调节作用,AMPK作为能量代谢变化的感受器,能够被ATP/AMP的比值变化所激活,SPARC通过AMPK信号通路参与调控细胞的糖酵解过程[14],因此,结合本研究结果,SPARC、糖酵解关键酶及AMPK信号通路之间是否存在相互调节作用还有待深入探究。
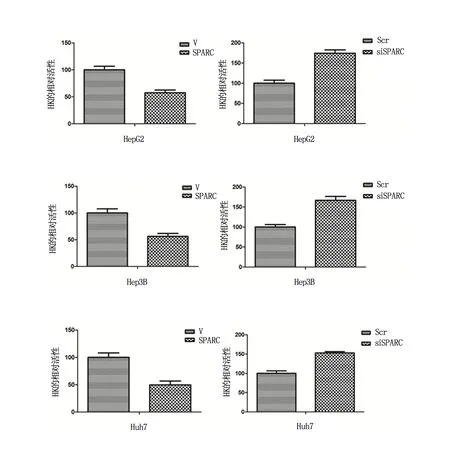
图1 HepG2/Hep3B/Huh7细胞分别转染SPARC或siRNA SPARC后HK相对活性的变化

表1 HepG2/Hep3B/Huh7细胞分别转染SPARC或siRNA SPARC后HK在563 nm处的OD值,(X±SEM,%)
*为与对照组比较,P<0.05。
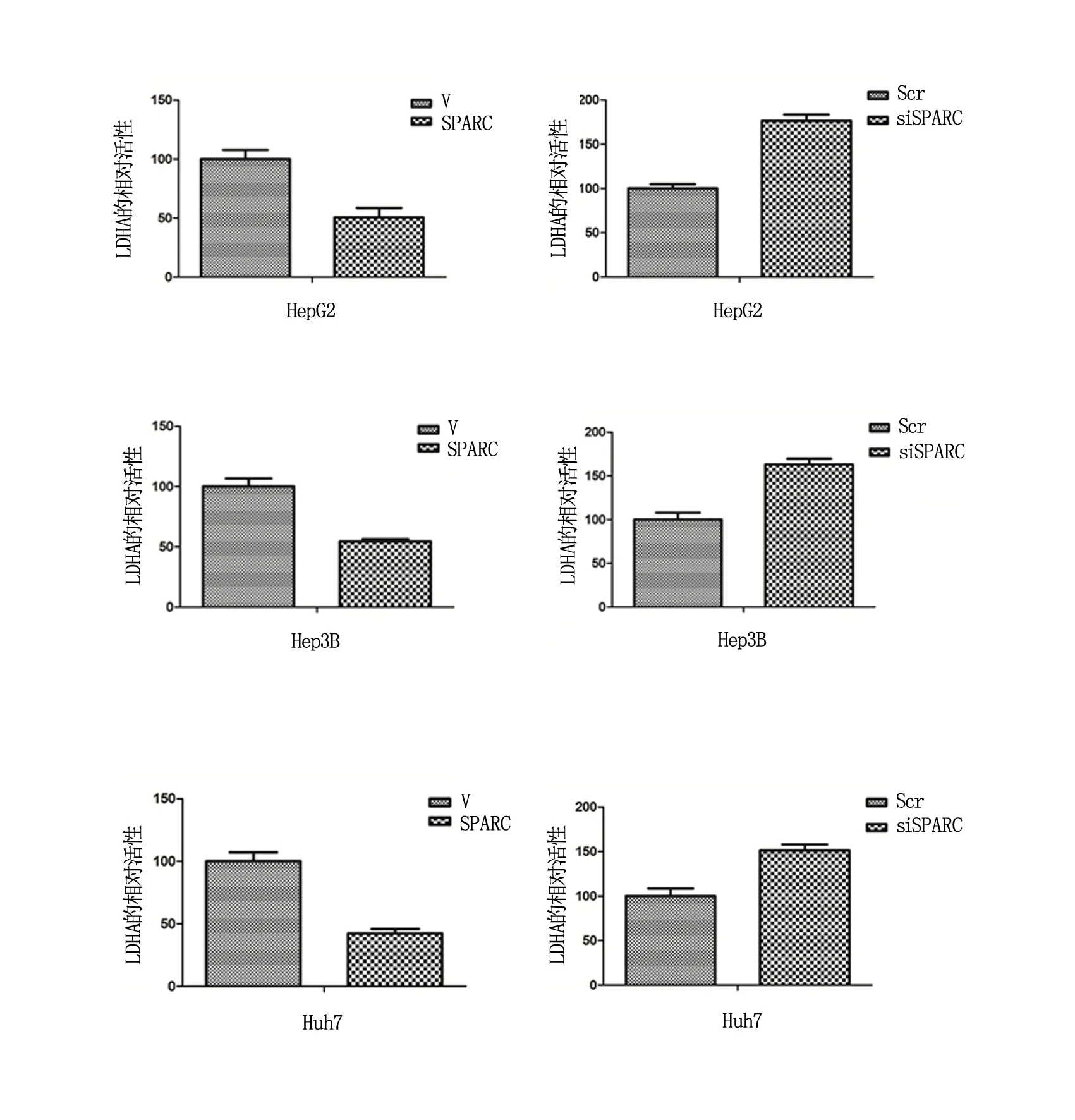
图2 HepG2/Hep3B/Huh7细胞中分别转染SPARC或siRNA SPARC后LDHA的相对活性

表2 HepG2/Hep3B/Huh7细胞分别转染SPARC或siRNA SPARC后LDHA在490 nm处的OD值(X±SEM,%)
*为与对照组比较,P<0.05。
综上,本研究发现在肝细胞癌中SPARC通过负性调节糖酵解关键酶影响细胞的糖酵解过程,在下一步研究中,我们将在不同类型的肝癌细胞系及肝癌组织样本中,进一步探究SPARC表达与糖酵解的作用机制,为抑制肝细胞癌的发展机制研究提供了新的思路。
[1] Hohenester E,Maurer P,Hohenadl C,et al.Structure of a novel extracellular Ca(2+)-binding module in BM-40〔J〕.Nat Struct Biol,1996,3(1):67-73.
[2] Gilles C,Bassuk JA,Pulyaeva H,et al.SPARC/osteonectin induces matrix metalloproteinase 2 activation in human breast cancer cell lines〔J〕.Cancer Res,1998,58(23):5529-5536.
[3] Swaminathan SS,Oh DJ,Kang MH,et al.Secreted protein -
acidic and rich in cysteine(SPARC)-null mice exhibit more uniform outflow〔J〕.Invest Ophthalmol Vis Sci,2013,54(3):2035-2047.
[4] Liang JF,Wang HK,Xiao H,et al.Relationship and prognostic significance of SPARC and VEGF protein expression in colon cancer〔J〕.J Exp Clin Cancer Res,2010,29:71.
[5] Cheng L,Sage EH,Yan Q.SPARC fusion protein induces -
cellular adhesive signaling〔J〕.PLoS One,2013,8(1):e53202.
[6] Mathupala SP,Rempel A,Pedersen PL.Glucose catabolism in cancer cells:identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions〔J〕.J Biol Chem,2001,276(46):43407-43412.
[7] Azim HA Jr,Singhal S,Ignatiadis M,et al.Association between SPARC mRNA expression,prognosis and response to neoadjuvant chemotherapy in early breast cancer:a pooled in-silico analysis〔J〕.PLoS One,2013,8(4):e62451.
[8] Girotti MR,Fernandez M,Lopez JA,et al.SPARC promotes cathepsin B-mediated melanoma invasiveness through a collagen I/alpha2beta1 integrin axis〔J〕.J Invest Dermatol,2011,131(12):2438-2447.
[9] Yunker CK,Golembieski W,Lemke N,et al.SPARC-indu-
ced increase in glioma matrix and decrease in vascularity are associated with reduced VEGF expression and secretion〔J〕.Int J Cancer,2008,122(12):2735-2743.
[10] Shackleton M.Normal stem cells and cancer stem cells:si-
milar and different〔J〕.Semin Cancer Biol,2010,20(2):85-92.
[11] 戴芳芳,于国华,张居民,等.结直肠癌组织SPARC和MMP-2及VEGF的表达临床意义分析〔J〕.中华肿瘤防治杂志,2012,19(14):1086-1090.
[12] Le Bail B,Faouzi S,Boussarie L,et al.Osteonectin/SPARC is overexpressed in human hepatocellular carcinoma〔J〕.J Pathol,1999,189(1):46-52.
[13] 陈科济,王 义,孙延富.肝细胞癌组织SPARC表达及其临床意义〔J〕.中国癌症杂志,2008,18(10):744-748.
[14] Song H,Guan Y,Zhang L,et al.SPARC interacts with A-
MPK and regulates GLUT4 expression〔J〕.Biochem Biophys Res Commun,2010,396(4):961-966.
