二价金属离子转运体在锰转运过程中的作用
2014-09-13焦翼飞李涛曾水林
焦翼飞,李涛,曾水林
(东南大学医学院 人体解剖与组织胚胎学系,江苏 南京 210009)
二价金属离子转运体(divalent metal-ion transporter-1,DMT1)是一种在哺乳动物中广泛表达的金属离子转运体,参与机体内多种金属离子的转运(以铁和锰为主)。相关研究已证实,金属离子、氧化还原物质、炎症反应等因素均可影响DMT1基因的表达。DMT1还可能与脑内神经元变性有关。深入研究DMT1将为了解金属离子代谢及其相关疾病的发病机制提供重要的研究资料。正常生理条件下,锰(Mn)是机体必需的金属元素,对维持大脑正常功能起到重要作用。Mn过多或缺乏会对机体产生有害的影响。Mn能选择性蓄积在脑内,作用于锥体外系,因此,Mn中毒可引起类帕金森症状。近年来,越来越多的实验室在研究细胞(尤其是神经元)摄取和转运Mn的机制,结果显示DMT1在Mn转运过程中可能起着至关重要的作用。
1 二价金属离子转运体
二价金属离子转运体又称为自然抵抗相关巨噬蛋白2(natural resisitance associated macrophage protein 2,Nramp2),或二价阳离子转运体1(divalent cation transporter 1,DCT1),属于可溶性载体家族成员(solute carrier family 11member 2,SLC11A2),是哺乳动物体内质子偶联的跨膜金属离子转运体。它于1995年首次被发现,因与已经发现的Nramp1基因同源性高达78%,所以被命名为Nramp2[1]。自发现DMT1以来,在它的结构、分布、功能等方面研究已经获得很多重要进展,对于DMT1的研究已经成为整个微量元素研究领域的一个热点问题。
1.1 DMT1分子的结构
DMT1分子量为61456,等电点(isoionic point,pI)为6.02,是具有12个跨膜结构域(transmemberane,TM)的糖蛋白,其糖基化的细胞外袢状结构和高度保守的细胞内序列都具有高度的疏水性。DMT1信使核糖核苷酸(mRNA)的4种亚型在不同组织和细胞编码4种不同的DMT1蛋白并行使不同的功能。其中的2个在最后1个外显子中含有IRE(iron-responsive element)序列,其他2个则没有;因此C末端DMT1蛋白亚型被分为Ⅰ(+IRE)和Ⅱ(-IRE)。人DMT1基因组DNA含有43 999个碱基,包括16个外显子,其cDNA有4 142个碱基,所编码蛋白含561个氨基酸,其羧基端和氨基端都位于细胞胞质内。DMT1与同家族Nramp1的基因同源性高达78%,氨基酸相似性达到64%,二者的主要区别在于氨基端的不同[2]。Lee等[3]研究发现与Nramp1基因相比,DMT1在氨基端多出1个外显子和内含子1,并在羧基端多出了外显子17和内含子16,故推测两者在结构和功能上的差别可能与此有关。
1.2 DMT1分子的分布
DMT1在体内的表达具有组织和细胞特异性,且不同的亚型在各个器官的表达和功能上都有所不同。DMT1亚型在成人组织中普遍存在,而DMT1(+IRE)和DMT1(-IRE)却具有细胞型特异性和亚细胞分布特异性。相关研究表明,在胚胎组织中DMT1(+IRE)和DMT1(-IRE)的表达是普遍存在的,并且两种亚型的蛋白都集中在胚胎上皮细胞膜上,这与所在组织的吸收或排泄功能相关。其中,DMT1(-IRE)存在于神经元、神经样细胞、星形胶质细胞以及星形细胞瘤的细胞核和细胞质中,而DMT1(+IRE)主要存在于在这些细胞的细胞质中[4]。
1.3 DMT1分子的功能
DMT1的生物学效应的首次发现是基于对两种动物模型[microcytic(mk) mice和Belgrade(b/b) rats]的表型分析,它们发生了自发的突变导致,DMT1基因的第4个跨膜结构域的第185号残基从甘氨酸突变成精氨酸[5]。两种动物都表现出小红细胞性贫血,这和铁转运体的破坏有关,进而导致了体内锰的失衡。类似的,人类含有不同区域突变的DMT1,如E399D[6]、R416C[7]或者G212V[8]也都表现出小红细胞性贫血,这提示我们DMT1在哺乳类动物中功能上可能的共性。
Salazar等[9]对帕金森(PD)患者死后的脑组织行免疫组织化学检测发现,在其黑质(SN)中DMT1的表达量增加;在MPTP染毒的小鼠腹侧中脑发现DMT1+IRE表达量上调,并且发现含有DMT1突变体的小鼠有部分的抗MPTP毒性的神经保护功能。陈瑛等[10]用乳胞素诱导神经元(SH-SY5Y)细胞系的损伤进而检测DMT1表达量的改变时发现,乳胞素处理组DMT1的表达量明显增加。这提示我们,DMT1可能和脑以及神经元的损伤有密切的关系。
现阶段,有两种理论来解释DMT1发挥功能的机制:(1) 不依赖于转铁蛋白受体(TfR)通路;(2) 依赖于转铁蛋白受体(TfR)通路。在不依赖于转铁蛋白受体通路中,DMT1能够作为一个协同转运体将金属离子的向内运输和质子的向外运输结合起来。对爪蟾卵母细胞的电生理研究显示,在中性膜电位和pH环境下,DMT1以1∶1的速率转运质子和金属离子。降低膜电位或pH值都可以提高DMT1对金属离子的转运速率。这种紧密的关系可以保护细胞免受含过量金属或酸性环境的危害[11]。DMT1和TfR的共区域化预示着由DMT1摄取锰的通路中肯定有一条是受TfR调节的。当金属离子如铁或者锰结合到转铁蛋白-转铁蛋白受体复合物上,由于内吞作用金属离子由细胞质膜转运到细胞质基质中,然后Ⅴ型ATP酶活化导致吞噬泡变酸进而金属离子从复合物中解离,这会反过来活化吞噬泡膜上的DMT1协同运输金属离子和质子,正如图1[12]所示。
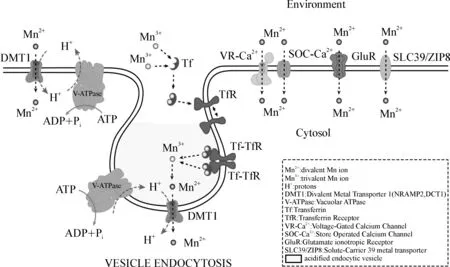
图1通过血脑屏障摄取锰的分子机制(来自文献[12])
2 锰
锰是地壳中广泛分布的一种元素。锰一般以氧化物、碳酸盐和硅酸盐的形式存在。锰还是动物生理机能不可缺少的7种必需金属元素之一。作为一种人体的必需微量元素,锰是转移酶、水解酶、裂合酶、精氨酸酶、谷氨酰胺合成酶、超氧化物歧化酶等多种酶的活性基团或辅助因子[13]。锰通过对这些酶的调控参与体内多种生理代谢过程,如免疫调节、细胞黏附、蛋白质和碳水化合物的新陈代谢等。锰在神经元生长发育及骨骼形成中亦发挥重要作用[14]。锰缺乏时,机体会出现糖类、脂类的代谢异常,骨骼畸形,生长停滞,生殖功能异常,中枢神经系统功能障碍等[15]。
尽管锰对于新陈代谢的功能是必需的,但是过多地暴露在富含锰的环境中是很危险的,吸入含锰颗粒物和肺部炎症有关,在人和灵长类中主要表现是咳嗽、支气管炎、肺炎和肺功能受损[16],在啮齿类动物中表现为鼻上皮组织炎症[17]。暴露在高锰环境中的男性员工被报道出可能会阳痿和失去性欲[18],可能是由于精氨酸酶在这些功能中起着重要的作用。虽然大多数的锰是从食物中获得的,但由饮食造成的锰中毒是很罕见的[19],这是由于机体中有肠上皮细胞的吸收和胆管细胞的排泄两条途径很好地调节锰的平衡。相比较而言,嗅球对微粒锰的摄取和转运可以导致锰在纹状体和小脑中沉积及鼻上皮组织的炎症[17]。职业暴露在锰环境中6个月到2年会引起锥体束外的综合征,被称为锰中毒,不管在分子水平还是临床水平和先天性帕金森病都极其相似[20]。锰中毒是一种伴随着步态紊乱的帕金森综合征。遭受锰中毒的患者表现出两相的身体机能下降的特征,初始相是精神上的忧虑包括情绪的异变、情感的缺乏,随之而来的第二相是动力缺乏,比如运动能力下降、肌张力障碍和运动迟缓[21]。锰暴露是一个显著的公共健康问题,锰作催化剂被广泛用于数不尽的工业生产方法中以及作为汽油的添加剂,作为像代森锰一样的除菌剂,用来净化饮用水的高锰酸盐里也含有锰。这些使得锰中毒在非职业锰暴露下也时有发生。
近年来,随着纳米材料的广泛使用,尤其是含锰纳米材料由于具有其独特的电化学性能如减小极化,增大充放电电流密度,具有优良的离子传导性和较高的电位等得到了非常广阔的应用前景。锰暴露的环境问题越来越严重,研究[22-23]表明一些人造纳米颗粒很容易引起靶器官炎症,导致大脑损伤;使机体产生氧化应激效应;容易进入细胞甚至细胞核内;有随尺寸减小而生物毒性增大的趋势。纳米锰颗粒作为一种外源性化合物进入到中枢神经系统之后,必然会引起脑组织内相应细胞的功能改变[24]。Oszlanczi等[25]将大鼠暴露在含一定量纳米锰的环境下,一段时间后发现大鼠均表现出神经毒性反应,如静止活动增多,步态紊乱,神经末梢传导速度显著地降低等。Oszlanczi等[26]还将大鼠暴露在等量的不同状态的无机锰(MnO2和MnCl2)环境下,发现MnCl2的神经毒性大于MnO2,可能是因为在MnCl2中锰处于离子状态更容易被吸收和转运。毛彩霞等[27]研究纳米锰和常规锰对HeLa细胞的毒性效果发现,纳米MnO2对HeLa细胞DNA的损伤显著高于常规MnO2,提示MnO2颗粒的大小与其毒性效应直接相关:在一定范围内,颗粒尺寸越小,DNA损伤效应越大。
目前,锰过量引起神经毒性的机制已经有一些研究结果,如造成氧化应激、引起线粒体功能异常、凋亡信号Caspase的活化等,但锰转运到大脑的机制仍然不清楚。在过去的二十年里,人们发现了各种各样的转运机制,比如主动运输和易化扩散。近年来发现锰可以通过高亲和力的金属离子转运体(如钙和铁的转运体)进行运输。这些转运体中包括:二价金属离子转运体DMT1,属于天然抗性相关巨噬细胞蛋白NRAMP家族[28];ZIP-8,可溶性载体39家族的一员[29];转铁蛋白受体(TfR),主要负责对三价的铁离子的转运[30];电压调节和钙库操纵性钙离子通道[31];离子交换的谷氨酸盐受体钙离子通道[32]。其中DMT1对锰的转运起着至关重要的作用,也是当前的研究热点。
3 DMT1在锰转运中的作用
1997年Chua等[33]发现,b/b型大鼠网织红细胞以及一些器官(如肾脏、大脑和股骨)对锰的摄取和十二指肠对锰的吸收,相对于野生型大鼠(+/+)和杂合子大鼠(+/b)中显著减少,提示b/b型大鼠锰代谢的破坏是由于DMT1的突变导致锰摄取和转运的不足。Knopfel等[34]在对小肠膜囊泡进行的研究也验证了这一观点。最直接验证DMT1是否对锰的转运起作用的方法是,当环境中锰含量很高时检测DMT1表达量的变化。Garcia等[35]对幼大鼠进行高锰食谱的喂养的体内实验表明,大鼠脑中DMT1表达量上升了35%。这种含量的升高不是区域特异性的,尽管如此,这个实验仍然是食物中锰含量的升高伴随着DMT1表达量升高的一个很好的直接证据。此外,这种关联在体外实验中也得到了证实。Wang等[36]在对永生的脉络丛上皮细胞Z310细胞系锰暴露24 h和48 h后,DMT1的表达量分别上升了45%和78%,并且他们的研究还发现:(1) 暴露在高锰的环境下DMT1的表达量升高;(2) DMT1 mRNA的含量也升高;(3) 铁调节蛋白和DMT1 mRNA的蛋白-RNA结合位点结合使mRNA的结构稳定,增加DMT1的表达量;(4) DMT1的核不均一RNA的含量并不升高。研究结果显示,DMT1通过铁调节蛋白和其mRNA的结合使mRNA更加稳定而不是增加其基因的转录进而达到DMT1蛋白的表达量的上调。高锰环境下,可以诱导炎症等的发生,而炎症因子可以刺激DMT1表达量的升高[37],也可能是细胞中锰含量升高的一个因素。Bai等[38]用不同来源的锰来研究DMT1的作用发现,DMT1对有机锰(和氨基酸结合的锰)的转运远远大于对MnSO4的转运,说明不同来源的锰的毒性应该也不同,并且证实了锰存在的条件下DMT1 mRNA的表达量会增加。He等[39]对中国汉族192名PD患者和193名健康对照用限制性片段长度多聚酶链式反应(PCR-RFLP)检测一个突变体(1303C/A)和两个单核苷酸多态性(SNPs)位点(1254T/C和IVS4+44C/A),对10%的样本进行直接的基因组测序来获得其基因组分型,结果在等位基因或突变基因或PD患者中基因型没有发现显著地差异,然而,一个单体型(1254T和IVS4+44C/A都变成C)在PD患者中较对照组中出现的频率增多(18.2%对11.4%,OR值1.72,95%可信区间1.15~2.59,P=0.01)。这些结果提示,在这些人群中DMT1基因型CC可能是PD的一个危险因子。最近对嗅球中DMT1的研究[40]显示,在b/b型大鼠中鼻对锰的吸收显著减少,在铁缺乏大鼠的嗅球中DMT1的含量升高,可能铁在DMT1对锰的吸收过程中也起着重要的作用。
综上所述,细胞通过膜表面的DMT1摄取并转运外环境的锰,DMT1会随着锰含量的升高而表达量上调,锰进入细胞体内损伤细胞,从而导致一系列的疾病(如PD等)。此外,DMT1随着年龄的升高而表达量升高[41],这是老年人群更容易患PD的一个可能的原因。
4 展 望
由于DMT1转运锰的机制并没有完全明了,DMT1摄取锰的精确的途径和明确的机制都需要进一步的实验来探究,以下4个方面应该得到重视:(1) 铁似乎在DMT1转运锰中起着某种作用,众所周知,铁和锰对人体都非常重要,且过量都会有毒性,深入探讨铁是否对DMT1转运锰有影响,可以更好地理解微量元素在脑内的转运过程;(2) 在不人为地增加锰含量条件下,上调DMT1的表达,是否会对日常饮食中锰的摄取增多,如果增多,那毫无疑问DMT1在锰的转运中起着至关重要的作用;(3) 锰累积之后应该会有补偿的排除锰的机制,从而减轻锰的毒性,到目前为止还没有研究锰的排出途径的报道,如果可以人为地加强这些补救途径也许对职业锰中毒的患者会有好的疗效;(4) 一些新的研究方法如晶体学,三维立体研究DMT1的功能,可能会对DMT1转运金属离子的机制有更进一步的了解。
[1] VIDAL S M,BELOUCHI A,CELLIER M,et al.Cloning and characterization of a second human NRAMP gene on chromosome 12q131[J].Mamm Genome,1995,6(4):224-230.
[2] McKIE A T,BARROW D,LATUNDE-DAT A G O,et al.An iron-regulated ferric reductase associated with the absorption of dietary iron[J].Science,2001,291(5509):1755-1759.
[3] LEE P L,GELBART T,WEST C,et al.The human nramp2 gene:characterization of the gene structure,alternative splicing; promoter region and polymorphisms[J].Blood Cell Mol Dis,1998,24(2):199-215.
[4] KE Y,QIAN Z M.Brain iron metabolism:neurobiology and neurochemistry[J].Prog Neurobiol,2007,83(3):149-173.
[5] SU M A,TRENOR C C,FLEMING J C,et al.The G185R mutation disrupts function of the iron transporter Nramp2[J].Blood,1998,92(6):2157-2163.
[6] MIMS M P,GUAN Y,POSPISILOVA D,et al.Identification of a human mutation of DMT1 in a patient with microcytic anemia and iron overload[J].Blood,2005,105(3):1337-1342.
[7] IOLASCON A,D’APOLITO M,SERVEDIO V,et al.Microcytic anemia and hepatic iron overload in a child with compound heterozygous mutations in DMT1 (SCL11A2)[J].Blood,2006,107(1):349-354.
[8] BEAUMONT C,DELAUNAY J,HETET G,et al.Two new human DMT1 gene mutations in a patient with microcytic anemia,low ferritinemia,and liver iron overload[J].Blood,2006,107(10):4168-4170.
[9] SALAZAR J,MENA N,HUNOT S,et al.Divalent metal transporter 1 (DMT1) contributes to neurodegeneration in animal models of Parkinson’s disease[J].Proc Natl Acad Sci USA,2008,105(47):18578-1883.
[10] 陈瑛,竺飞燕,王炼,等.DMT1在多巴胺能神经元变性中的作用研究[J].中国病理生理杂志,2011,27(2):350-356.
[11] NEVO Y.Site-directed mutagenesis investigation of coupling properties of metal ion transport by DCT1[J].Biochim Biophys Acta,2008,1778(1):334-341.
[12] GRUENHEID S,CANONNE-HERGAUX F,GAUTHIER S,et al.The iron transport protein NRAMP2 is an integral membrane glycoprotein that colocalizes with transferrin in recycling endosomes[J].J Exp Med,1999,189(5):831-841.
[13] POST J E.Manganese oxide minerals:crystal structures and economic and environmental significance[J].Proc Natl Acad Sci USA,1999,96(7):3447-3454.
[14] LIAO S L,CHEN C J.Manganese stimulates stellation of cultured rat cortical astrocytes[J].Neuroreport,2001,12(18):3877-3881.
[15] TAKEDA A,SOTOGAKU N,OKU N.Influence of manganese on the release of neurotransmitters in rat striatum[J].Brain Res,2003,965(1-2):279-282.
[16] BOOJAR M M,GOODARZI F.A longitudinal follow-up of pulmonary function and respiratory symptoms in workers exposed to manganese[J].J Occup Environ Med,2002,44(3):282-290.
[17] DORMAN D C,McMANUS B E,PARKINSON C U,et al.Nasal toxicity of manganese sulfate and manganese phosphate in young male rats following subchronic (13-week) inhalation exposure[J].Inhal Toxicol,2004,16(6-7):481-488.
[18] BARANSKI B.Effects of the workplace on fertility and related reproductive outcomes[J].Environ Health Perspect,1993,101( Suppl 2):81-90.
[19] DORMAN D C,STRUVE M F,WONG B A.Brain manganese concentrations in rats following manganese tetroxide inhalation are unaffected by dietary manganese intake[J].Neurotoxicology,2002,23(2):185-195.
[20] CERSOSIMO M G,KOLLER W C.The diagnosis of manganese-induced parkinsonism[J].Neurotoxicology,2006,27(3):340-346.
[21] OLANOW C W.Manganese-induced parkinsonism and Parkinson’s disease[J].Ann N Y Acad Sci,2004,1012:209-223.
[22] CHIU W L,JOHN J,RICHARD M C,et al.Pulmonary toxicity of single wall carbon nanotube sin mice 7 and 90 days after intratracheal instillation[J].Toxicol Sci,2004,77:126-134.
[23] CHILLAPPAGARI S,MIETHKE M,TRIP H,et al.Copper acquisition is mediated by YcnK and regulated by YcnK and CsoR in bacillus subtilis[J].J Bacterilo,2009,191:2362-2370.
[24] CORBIN J G,GALANO N,JULIANO S L,et al.Regulation of neural progenitor cell development in the nervous system[J].J Neurocytol,2008,106:2272-2287.
[25] OSZLANCZI G,VEZER T,SARKOZI L,et al.Functional neurotoxicity of Mn-containing nanoparticles in rats[J].Ecotoxicol Environ Saf,2010,73(8):2004-2009.
[26] OSZLANCZI G,VEZER T,SARKOZI L,et al.Metal deposition and functional neurotoxicity in rats after 3-6 weeks nasal exposure by two physicochemical forms of manganese[J].Environ Toxicol Pharmacol,2010,30(2):121-126.
[27] 毛彩霞,田熙科,杨光涛,等.纳米MnO2与常规MnO2粉末对HeLa细胞DNA损伤的对比研究[J].生态毒理学报,2007,2(2):190-195.
[28] GARRICK M D,DOLAN K G,HORBINSKI C,et al.DMT1:a mammalian transporter for multiple metals[J].Biometals,2003,16(1):41-54.
[29] HE L,GIRIJASHANKER K,DALTON T P,et al.ZIP8,member of the solutecarrier-39(SLC39)metal-transporter family:characterization of transporter properties[J].Mol Pharmacol,2006,70(1):171-180.
[30] LUCACIU C M,DRAGU C,COPAESCU L,et al.Manganese transport through human erythrocyte membranes[J].Biochim Biophys Acta,1997,1328(2):90-98.
[31] RICCIO A,MATTEI C,KELSELL R E,et al.Cloning and functional expression of human short TRP7,a candidate protein for store-operated Ca2+influx[J].J Biol Chem,2002,277(14):12302-12309.
[32] KANNURPATTI S S,JOSHI P G,JOSHI N B.Calcium sequestering ability of mitochondria modulates influx of calcium through glutamate receptor channel[J].Neurochem Res,2000,25(12):1527-1536.
[33] CHUA A C,MORGAN E H.Manganese metabolism is impaired in the Belgrade laboratory rat[J].J Comp Physiol,1997,167:361-369.
[34] KNOPFEL M,ZHAO L,GARRICK M D.Transport of divalent transition-metal ions is lost in small-intestinal tissue of b/b Belgrade rats[J].Biochemistry,2005,44(9):3454-3465.
[35] GARCIA S J,GELLEIN K,SYVERSEN T,et al.A manganese-enhanced diet alters brain metals and transporters in the developing brain[J].Toxicol Sci,2006,92(2):516-525.
[36] WANG X,LI G J,ZHENG W.Upregulation of DMT1 expression in choroidal epithelia of the blood-CSF barrier following manganese exposureinvitro[J].Brain Res,2006,1097(1):1-10.
[37] LUDWICZEK S,AIGNER E,THEURL I,et al.Cytokine-mediated regulation of iron transport in human monocytic cells[J].Blood,2003,101:4148-4154.
[38] BAI S P,LU L,WANG R L,et al.Manganese source affects manganese transport and gene expression of divalent metal transporter 1 in the small intestine of broilers[J].Br J Nutr,2012,108:267-276.
[39] HE Q,DU T,YU X,et al.DMT1 polymorphism and risk of Parkinson’s disease[J].Neurosci Lett,2011,501(3):128-131.
[40] THOMPSON K,MOLINA R M,DONAGHEY T,et al.Olfactory uptake of manganese requires DMT1 and is enhanced by anemia[J].FASEB J,2007,21(1):223-230.
[41] KE Y,CHANG Y Z,DUAN X L,et al.Age-dependent and iron-independent expression of two mRNA isoforms of divalent metal transporter 1 in rat brain[J].Neurobiol Aging,2005,26(5):739-748.
