胰高血糖素样肽-1的研究进展
2014-09-13王璠璠卢海英刘莉洁
王璠璠,卢海英,刘莉洁
(东南大学 医学院,江苏 南京 210009)
1902年Bayliss和Starling在小肠分泌物中发现了促胰液素(secretin)[1],创生了“激素”概念[2]。20世纪30年代,法国学者La Barre等[3]发现促胰液素粗制品可使血糖下降,于是提出小肠分泌物中还存在一种不影响胰液分泌却可降低血糖的因子(intestinal factor),并称之为“肠促胰岛素(incretin)”。胰岛素放射性免疫荧光检测法出现后,多个实验室分别证实口服葡萄糖对胰岛素分泌的促进作用明显高于等量葡萄糖的静脉注射[4-7],肠-胰岛轴(entero insular axis)的概念即由此产生[8],肠促胰岛素被认为参与其中。Creutzfeldt[9]将“肠促胰岛素”的特点归纳为:进食后由胃肠细胞分泌;进食后的生理浓度下即可产生促胰岛素分泌效应;促胰岛素分泌效应具有葡萄糖依赖性。据此标准,抑胃多肽(gastric inhibitor polypeptide,GIP)又称葡萄糖依赖性促胰岛素分泌多肽(glucose-dependent insulinotropic peptide,GIP),成为了第一个肠促胰岛素成员[10-12]。1983年,发现GIP十多年后,Mclntyre等在分析胰高血糖素原的基因序列时发现了另一种效应更为强大的肠促胰岛素,即胰高血糖素样肽-1(glucagons like peptide-1,GLP-1)[13]。
GLP-1属于胰高血糖素原基因的翻译后组织特异性蛋白水解产物(tissue-specific posttranslational proteolytic product),进食可引起肠L细胞释放GLP-1,产生葡萄糖浓度依赖性促胰岛素分泌效应[14]。近年来,利用GLP-1类似物、GLP-1受体(GLP-1R)激动剂及GLP-1R基因靶向破坏等不同手段所进行的研究发现,GLP-1对于机体多种组织和器官,尤其是胰岛,具有诸多功能调节效应,GLP-1已成为糖尿病发病机制及药物治疗的研究热点。
1 GLP-1的合成、分泌及降解
1.1 GLP-1的合成
GLP-1是胰高血糖素原基因的编码产物之一。胰高血糖素原基因位于人类2号染色体长臂,包括6个外显子和5个内含子,GLP-1编码区位于第四外显子[15]。该基因在胰腺α细胞、肠 L细胞以及丘脑下部、脑干等处的神经元中都有表达,产生单一的、完全相同的转录本,进而翻译产生含158个氨基酸的胰高血糖素原(proglucagon);此单链前体蛋白在不同组织中可加工生成一系列具有不同生物活性的胰高血糖素原衍生肽(proglucagon derived peptides,PGDP)[16]。具有组织表达特异性的激素原转化酶(prohormone convertases,PCs)PC2和 PC1/3在胰高血糖素原的翻译后加工过程中具有重要作用。在胰岛α细胞中PC2的作用下,胰高血糖素原的主要翻译后处理产物是胰岛素的主要反调节激素(counterregulatory hormone)——胰高血糖素(glucagon);而在肠黏膜的L细胞中,PC1/3将胰高血糖素原剪切为胰高血糖素样肽-1(glucagon like peptide-1,GLP-1 )、胰高血糖素样肽-2(glucagon like peptide-2,GLP-2)、肠高血糖素(glicentin)、胃泌酸调节素(oxyntomodulin)等(图1)[17-18]。
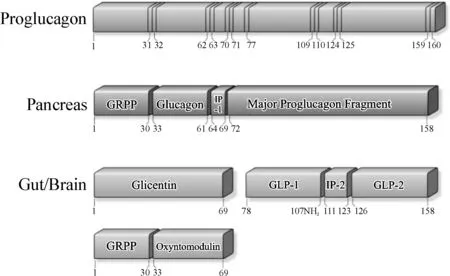
胰高血糖素原在胰腺、肠和脑组织中翻译后处理机制及产物不同。图中数字代表了各胰高血糖素原衍生肽在胰高血糖素原160个氨基酸序列中的对应位点。GRPP,肠高血糖素相关胰多肽;IP-1,中间肽-1;IP-2,中间肽-2
图1胰高血糖素原基因的组织特异性翻译后加工[18]
1.2 GLP-1的分泌
GLP-1由肠L细胞分泌。肠L细胞可见于大鼠及人类的全段肠黏膜上皮,远端回肠(distal ileum)和结肠(colon)中分布密度相对较高[19]。肠L细胞是一类开放型上皮内分泌细胞(open-type intestinal epithelial endocrine cell),其顶端暴露于肠腔,底端与肠壁内神经丛及微循环系统相临近,因此L细胞GLP-1的分泌可受到食物营养成分、肠壁内神经信号和激素信号的共同调控[20]。摄食,尤其是富含脂肪和碳水化合物的食物,是GLP-1迅速释放的主要生理性刺激因素[21]。在啮齿动物和人类,摄食后GLP-1呈双相分泌:10~15 min内的早期分泌相,继以30~60 min的较长期二相分泌。由于L细胞主要分布于远端小肠,营养物对L细胞的直接作用不太可能是引起GLP-1早期分泌的因素。大量研究表明,迷走神经、乙酰胆碱以及GIP等多种神经及体液因素在摄食后GLP-1的早期分泌中发挥重要作用,而GLP-1的二相分泌则很可能是由营养物对L细胞的直接作用所引起。L细胞内PKA、PKC、钙离子以及MAPK等信号的激活参与了GLP-1的分泌[14]。
1.3 GLP-1的活性形式及降解
体内存在多种形式的GLP-1,其中GLP-1(1-37)和GLP-1(1-36)酰胺被认为无生物活性,它们再经两步酶切,去除N端6个氨基酸和形成C端酰胺化,生成具有高度生物活性的GLP-1(7-37)多肽和GLP-1(7-36)酰胺。人类循环系统中的活性GLP-1主要是GLP-1(7-36)酰胺。研究表明,C末端酰胺化不但大幅提高了GLP-1的生物活性,也提高了GLP-1的体内稳定性[22]。
GLP-1(7-36)酰胺可被蛋白水解酶二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)快速降解失活[23]。DPP-4是一种广泛表达于细胞表面的丝氨酸蛋白酶,部分以可溶形式存在于循环血液中。小肠绒毛毛细血管内皮细胞高表达DPP-4,肝脏、胰腺等组织也有DPP-4表达,因而肠L细胞分泌的GLP-1在进入门脉循环之前就已有半数以上被DPP-4降解失活。肾脏是GLP-1及其代谢产物的主要清除场所[24]。
2 GLP-1的生物学作用
2.1 GLP-1受体
GLP-1通过与细胞膜表面的GLP-1受体(GLP-1R)结合发挥作用。GLP-1R是由463个氨基酸组成的7次跨膜螺旋G蛋白偶联受体,其氨基端胞外段在GLP-1与GLP-1R的结合中发挥重要作用,而第三段胞内环中的结构域则为受体与G蛋白的有效偶联所必须。GLP-1与GLP-1R结合,激活胞内腺苷酸环化酶、磷脂酶C,进而增加胞浆内Ca2+浓度,激活PKA、PKC、PI-3K以及MAPK等信号通路[25-26]。GLP-1R在胰岛、肾脏、肺、心脏、肠、迷走神经节和下丘脑、垂体、海马、大脑皮层等神经组织均有表达[27-28]。
2.2 GLP-1的胰腺内作用及机制
2.2.1 GLP-1可促进胰岛素的分泌 对于培养的胰岛、在体或离体胰腺,GLP-1都具有葡萄糖依赖性促胰岛素分泌效应[29]。
GLP-1与β细胞膜表面GLP-1R结合,可激活腺苷酸环化酶,提高胞内cAMP水平,进而激活PKA、鸟苷酸转化因子Ⅱ(cAMP-regulated guanine nucleotide exchange factor Ⅱ,Epac2),通过下列机制促进葡萄糖刺激下的胰岛素分泌(图2):(1) 抑制KATP通道,导致β细胞膜去极化;(2) 增加Ca2+内流,动员胞内Ca2+存储库,增加β细胞内Ca2+浓度;(3) 增加线粒体ATP的合成,以进一步促进细胞膜去极化;(4) 关闭电压依赖性K+通道,阻碍β细胞膜复极化;(5) 直接促进胰岛素囊泡的胞吐[30-33]。

图2GLP-1葡萄糖依赖性促胰岛素分泌效应的细胞内分子机制[18,34-35]
GLP-1可还上调β细胞内葡萄糖感应元件葡萄糖转运体以及葡萄糖激酶的表达,从而增加β细胞对葡萄糖的敏感度以及反应性。
2.2.2 GLP-1可促进胰岛素的合成 GLP-1可与葡萄糖协同作用促进胰岛素基因的表达、维持其mRNA稳定性并促进胰岛素生物合成,具有补充β细胞胰岛素储量、防止β细胞胰岛素耗竭的作用[36-37]。β细胞内cAMP-PKA依赖性及非依赖性信号通路、Ca2+浓度的增加都参与了此生物过程[37]。胰腺十二指肠同源异形盒1(panereatic duodenum homeobox-1,PDX-l)是一种对胰腺发育及β细胞功能都非常重要且必需的转录因子,它在GLP-1的促进胰岛素基因转录及胰岛素分泌中具有核心作用。GLP-1能够促进PDX-1的表达,并增加PDX-1结合胰岛素启动子的能力。PDX-1的表达对于整合GLP-1R依赖的信号通路,调节β细胞胰岛素的分泌、β细胞生长、功能分化和细胞生存是必需的[38]。
2.2.3 GLP-1可增加胰岛β细胞数量 细胞增殖与凋亡之间的平衡维持着β细胞数量的稳定。在体情况下,GLP-1能够促进β细胞的增殖分化、促进胚胎胰岛细胞的分化与成熟;可提高β细胞的葡萄糖耐受性、抑制糖尿病模型动物β细胞的凋亡[39]。 GLP-1类似物Exendin-4可促进内质网应激状态下β细胞的功能及存活[40];还可延缓自发糖尿病模型G-K大鼠、db/db小鼠以及实验诱导宫内发育迟缓大鼠成年糖尿病的发生[39,41-42]。离体实验中,培养基中加入GLP-1可使大鼠及人类胰腺导管细胞分化为胰岛素分泌细胞[43-45]。GLP-1还有助于保持游离胰岛的形态结构、促进其葡萄糖刺激的胰岛素分泌并抑制其细胞凋亡[46],增加原代胰岛对细胞毒性因子的耐受力[47]。
与葡萄糖依赖性的促胰岛素分泌效应不同,GLP-1的促β细胞增殖、分化作用不依赖于葡萄糖的浓度,在正常的血糖情况下就能产生。GLP-1促进β细胞增殖、分化及对β细胞营养、保护功能的实现有GLP-1R下游多种信号通路的参与。GLP-1与GLP-1R结合,激活腺苷酸环化酶产生cAMP,通过cAMP激活磷脂酰肌醇3-激酶(PI3K)及其丝裂原活化蛋白激酶(MAPK/ERK)、蛋白激酶A(PKA)、蛋白激酶B(PKB/Akt)等信号转导途径,加强促凋亡蛋白(如caspase-3)的降调节和抗凋亡蛋白(如bcl-2)的升调节机制,从而调节胰岛β细胞的增殖和凋亡[39,48]。转录因子PDX-1的激活是这些信号通路的共享组件(a shared component),在PDX-1基因敲除的小鼠,GLP-1及其类似物的促β细胞增殖、抑制β细胞凋亡的效应均消失[36]。
2.2.4 GLP-1可抑制胰高血糖素分泌、刺激生长抑素释放 GLP-1通过直接与胰腺δ细胞上的GLP-1R结合而发挥促进生长抑素释放的效应。GLP-1抑制胰腺α细胞胰高血糖素释放的机制尚不清楚,可能是通过促进胰岛素和生长抑素释放间接抑制胰高血糖素释放[49-50]。GLP-1对胰高血糖素释放的抑制效应也具有葡萄糖依赖性,因此不会增加低血糖发生率。
2.3 胰腺外组织的作用
2.3.1 GLP-1对于胃排空和胃酸分泌的作用 GLP-1可抑制胃部平滑肌的活动,从而抑制胃排空、延缓胃部营养物质向小肠的运输,减缓由进食引起的血糖升高[51],这也是GLP-1控制餐后血糖一个重要原因。GLP-1抑制胃排空和胃酸分泌的作用机制较为复杂,胃肠黏膜壁细胞、迷走神经传入纤维以及中枢神经系统中的GLP-1R可能发挥了主要作用[52]。
2.3.2 GLP-1对于神经系统的影响 中枢神经系统中,与摄食、胃肠道运动、血糖调节、心血管活动等多项生理活动有关的调节区域,都有GLP-1R及GLP-1的表达;GLP-1R还分布于向脑干孤束核投射的腹腔迷走传入神经的结状神经节。
动物研究显示,外周或中枢给予GLP-1R激动剂可减少食物摄入、降低体重。对正常个体、肥胖及糖尿病患者,GLP-1R激动剂都可使其产生饱腹感、降低食欲、减少食物摄入并引起体重的持久降低,因而有助于糖尿病人体重和血糖的控制。GLP-1及Exendin-4都是小分子物质,可以自由通过血脑屏障。GLP-1对下丘脑摄食中枢GLP-1R的直接作用以及对胃肠运动及胃酸分泌的抑制作用,共同导致了GLP-1对摄食行为的调节[53-56]。有趣的是,GLP-1 R-/-小鼠并无显著肥胖,这可能是由于GLP-1不是调节体重的关键必需因素,或者是由于发生了某些代偿机制的上调[57]。
GLP-1的促胰岛素分泌效应也可能有神经机制的参与。前已述及,GLP-1由L细胞分泌后,50%以上即迅速被DPP-4降解失活;所剩具有活性的GLP-1在流经肝脏过程中也大量失活,因而只有不到10%的GLP-1能以活性形式到达胰腺。实验证实,GLP-1R表达于腹腔迷走传入神经的结状神经节;肝静脉给予GLP-1引起肝迷走传入冲动增多,并反射性引起胰腺迷走传出冲动的增多;肝静脉注射GLP-1所引起的促胰岛素分泌效应可被神经节阻断剂所取消。因此,局部神经环路很可能参与介导了肠分泌的GLP-1对胰腺的作用[58]。中枢神经系统中GLP-1R的激活还可反射性抑制外周肌肉组织的糖利用、增加胰岛素分泌促进肝糖原合成,提示中枢神经系统中的GLP-1在整体血糖稳态的调节中具有重要作用[59]。
表1罗列了GLP-1对多个器官系统所具有的生物学作用,其中很多作用的生理和治疗意义还有待于进一步研究。
表1GLP-1对多组织器官的生物学作用

器 官GLP-1的作用胰腺促进胰岛素分泌,促进胰岛素原的合成,促进β细胞增殖及分化,抑制凋亡,抑制胰高血糖素分泌和刺激生长抑素释放胃抑制胃排空,抑制胃酸分泌[51]中枢神经增进饱腹感,降低食欲,升高体温,促进学习和记忆[60]周围神经刺激肝迷走神经的输入端[60]心脏增加心率,升高血压[61];保护缺血心肌及再灌注损伤,改善心肌能量代谢[62]肝脏促进糖原合成,抑制肝糖元的分解,增加肌肉组织糖代谢,调节葡萄糖和脂肪在脂肪细胞中的代谢[63]肺刺激肺表面活性物质的分泌,舒张肺血管[64]肾利尿排钠,可能与抗高血压有关[65]
3 展 望
GLP-1的多重生物学作用赋予了其在2型糖尿病治疗中的广阔应用前景。由于天然GLP-1在体内的半衰期非常短,因此基于GLP-1的糖尿病药物研发主要有两种策略:一种是GLP-1类似物的研发,采用氨基酸替换、肽链的延伸以及修饰,延长GLP-1的作用时间;另一种是减缓体内GLP-1的降解,主要是抑制DPP-4以维持体内的活性GLP-1水平。GLP-1类似物Exendin-4和Liraglutide分别于2005年和2010年通过美国FDA认证,现已用于2型糖尿病的临床治疗[66-67]。继DPP-4抑制剂Sitagliptin于2006年通过美国FDA认证之后,Saxagliptin和Vildagliptin也已被相继发现。
同样由于GLP-1以及DPP-4的多重生物学作用,其相关药物对2型糖尿病的长远疗效以及对其它系统器官功能的影响还有待时间的进一步考验。相信,随着研究的不断深入,GLP-1及其相关信号通路将为2型糖尿病的治疗提供更多有效靶点。
[1] BAYLISS W M,STARLING E H.The mechanism of pancreatic secretion[J].J Physiol,1902,28(5):325-353.
[2] CREUTZFELDT W.The[pre-]history of the incretin concept[J].Regul Pept,2005,128(2):87-91.
[3] La BARRE J,STILL E U.Studies on the physiology of secretin Ⅲ.Further studies on the effects of secretin on the blood sugar[J].Am J Physiol,1930,91(2):649-653.
[4] MCINTYRE N,HOLDSWORTH C,TURNER D.New interpretation of oral glucose tolerance[J].Lancet,1964,2(7349):20.
[5] ELRICK H,STIMMLER L,HLAD C,et al.Plasma insulin response to oral and intravenous glucose administration[J].J Clin Endocrinol Metab,1964,24(10):1076-1082.
[6] PERLEY M J,KIPNIS D M.Plasma insulin responses to oral and intravenous glucose:studies in normal and Diabetic subjects[J].J Clin Invest,1967,46(12):1954.
[7] YALOW R S,BERSON S A.Immunoassay of endogenous plasma insulin in man[J].J Clin Invest,1960,39:1157-1175.
[8] UNGER R H,EISENTRAUT A M.Entero-insular axis[J].Arch Intern Med,1969,123(3):261-266.
[9] CREUTZFELDT W.The incretin concept today[J].Diabetologia,1979,16(2):75-85.
[10] BROWN J,MUTT V,PEDERSON R.Further purification of a polypeptide demonstrating enterogastrone activity[J].J Physiol,1970,209(1):57.
[11] BROWN J C,DRYBURGH J R.A gastric inhibitory polypeptide Ⅱ:the complete amino acid sequence[J].Can J Biochem,1971,49(8):867-872.
[12] PEDERSON R A,BROWN J C.Inhibition of histamine-,pentagastrin-,and insulin-stimulated canine gastric secretion by pure “gastric inhibitory polypeptide”[J].Gastroenterology,1972,62(3):393.
[13] SCHMIDT W,SIEGEL E,CREUTZFELDT W.Glucagon-like peptide-1 but not glucagon-like peptide-2 stimulates insulin release from isolated rat pancreatic islets[J].Diabetologia,1985,28(9):704-707.
[14] BAGGIO L L,DRUCKER D J.Biology of incretins:GLP-1 and GIP[J].Gastroenterology,2007,132(6):2131-2157.
[15] WHITE J W,SAUNDERS G F.Structure of the human glucagon gene[J].Nucl Acids Res,1986,14(12):4719-4730.
[16] FEHMANN H C,GOKE R,GOKE B.Cell and molecular biology of the incretin hormones glucagon-like peptide-I and glucose-dependent insulin releasing polypeptide[J].Endocr Rev,1995,16(3):390-410.
[17] GAUTIER J F,FETITA S,SOBNGWI E,et al.Biological actions of the incretins GIP and GLP-1 and therapeutic perspectives in patients with type 2 diabetes[J].Diabetes Metab,2005,31(3 Pt 1):233-242.
[18] HOLST J J.The physiology of glucagon-like peptide 1[J].Physiol Rev,2007,87(4):1409-1439.
[19] EISSELE R,GÖKE R,WILLEMER S,et al.Glucagon-like peptide-1 cells in the gastrointestinal tract and pancreas of rat,pig and man[J].Eur J Clin Invest,1992,22(4):283-291.
[20] DRUCKER D J.Glucagon-like peptides[J].Diabetes,1998,47(2):159-169.
[21] ELLIOTT R M,MORGAN L M,TREDGER J A,et al.Glucagon-like peptide-1 (7-36)amide and glucose-dependent insulinotropic polypeptide secretion in response to nutrient ingestion in man:acute post-prandial and 24-h secretion patterns[J].J Endocrinol,1993,138(1):159-166.
[22] DRUCKER D J.Minireview:the glucagon-like peptides[J].Endocrinology,2001,142(2):521-527.
[23] MENTLEIN R,GALLWITZ B,SCHMIDT W E.Dipeptidyl-peptidase IV hydrolyses gastric inhibitory polypeptide,glucagon-like peptide-1(7-36)amide,peptide histidine methionine and is responsible for their degradation in human serum[J].Eur J Biochem,1993,214(3):829-835.
[24] RUIZ-GRANDE C,ALARCON C,ALCANTARA A,et al.Renal catabolism of truncated glucagon-like peptide 1[J].Horm Metab Res,1993,25(12):612-616.
[25] WHEELER M B,LU M,DILLON J S,et al.Functional expression of the rat glucagon-like peptide-I receptor,evidence for coupling to both adenylyl cyclase and phospholipase-C[J].Endocrinology,1993,133(1):57-62.
[26] 何珂,胡蕴,毛晓明.TCF7L2基因与2型糖尿病发生相关性的研究进展[J].现代医学,2013,41(2):140-143.
[27] WEI Y,MOJSOV S.Tissue-specific expression of the human receptor for glucagon-like peptide-I:brain,heart and pancreatic forms have the same deduced amino acid sequences[J].FEBS Lett,1995,358(3):219-224.
[28] DUNPHY J L,TAYLOR R G,FULLER P J.Tissue distribution of rat glucagon receptor and GLP-1 receptor gene expression[J].Mol Cell Endocrinol,1998,141(1-2):179-186.
[29] NAUCK M A.Is glucagon-like peptide 1 an incretin hormone?[J].Diabetologia,1999,42(3):373-379.
[30] LIGHT P E,MANNING-FOX J E,RIEDEL M J,et al.Glucagon-like peptide-1 inhibits pancreatic ATP-sensitive potassium channels via a protein kinase A-and ADP-dependent mechanism[J].Mol Endocrinol,2002,16(9):2135-2144.
[31] HOLZ G G T,KUHTREIBER W M,HABENER J F.Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon-like peptide-1(7-37)[J].Nature,1993,361(6410):362-365.
[32] QUALMANN C,NAUCK M A,HOLST J J,et al.Insulinotropic actions of intravenous glucagon-like peptide-1 (GLP-1)[7-36 amide]in the fasting state in healthy subjects[J].Acta Diabetologica,1995,32(1):13-16.
[33] HANSOTIA T,DRUCKER D J.GIP and GLP-1 as incretin hormones:lessons from single and double incretin receptor knockout mice[J].Regul Pept,2005,128(2):125-134.
[34] YANG S,FRANSSON U,FAGERHUS L,et al.Enhanced cAMP protein kinase A signaling determines improved insulin secretion in a clonal insulin-producing beta-cell line (INS-1 832/13)[J].Mol Endocrinol,2004,18(9):2312-2320.
[35] HOLST J J,GROMADA J.Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans[J].Am J Physiol Endocrinol Metab,2004,287(2):E199-206.
[36] LI Y,CAO X,LI L X,et al.beta-Cell Pdx1 expression is essential for the glucoregulatory,proliferative,and cytoprotective actions of glucagon-like peptide-1[J].Diabetes,2005,54(2):482-491.
[37] DRUCKER D J,PHILIPPE J,MOJSOV S,et al.Glucagon-like peptide I stimulates insulin gene expression and increases cyclic AMP levels in a rat islet cell line[J].Proc Nat Acad Sci USA,1987,84(10):3434-3438.
[38] LI Y,CAO X,LI L X,et al.β-Cell Pdx1 expression is essential for the glucoregulatory,proliferative,and cytoprotective actions of glucagon-like peptide-1[J].Diabetes,2005,54(2):482-491.
[39] BREGENHOLT S,MØLDRUP A,BLUME N,et al.The long-acting glucagon-like peptide-1 analogue,liraglutide,inhibits β-cell apoptosisinvitro[J].Biochem Biophys Res Commun,2005,330(2):577-584.
[40] YUSTA B,BAGGIO L L,ESTALL J L,et al.GLP-1 receptor activation improves beta cell function and survival following induction of endoplasmic reticulum stress[J].Cell Metab,2006,4(5):391-406.
[41] FARILLA L,HUI H,BERTOLOTTO C,et al.Glucagon-like peptide-1 promotes islet cell growth and inhibits apoptosis in Zucker diabetic rats[J].Endocrinology,2002,143(11):4397-4408.
[42] FARILLA L,BULOTTA A,HIRSHBERG B,et al.Glucagon-like peptide 1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets[J].Endocrinology,2003,144(12):5149-5158.
[43] DRUCKER D J.Glucagon-like peptides:regulators of cell proliferation,differentiation,and apoptosis[J].Mol Endocrinol,2003,17(2):161-171.
[44] STOFFERS D A,KIEFFER T J,HUSSAIN M A,et al.Insulinotropic glucagon-like peptide 1 agonists stimulate expression of homeodomain protein IDX-1 and increase islet size in mouse pancreas[J].Diabetes,2000,49(5):741-748.
[45] BULOTTA A,HUI H,ANASTASI E,et al.Cultured pancreatic ductal cells undergo cell cycle re-distribution and beta-cell-like differentiation in response to glucagon-like peptide-1[J].J Mol Endocrinol,2002,29(3):347-360.
[46] FARILLA L,BULOTTA A,HIRSHBERG B,et al.Glucagon-like peptide 1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets[J].Endocrinology,2003,144(12):5149-5158.
[47] LI Y,HANSOTIA T,YUSTA B,et al.Glucagon-like peptide-1 receptor signaling modulates beta cell apoptosis[J].J Biol Chem,2003,278(1):471-478.
[48] MIAO X Y,GU Z Y,LIU P,et al.The human glucagon-like peptide-1 analogue liraglutide regulates pancreatic beta-cell proliferation and apoptosis via an AMPKmTORP70S6K signaling pathway[J].Peptides,2013,39:71-79.
[49] D′ALESSIO D A,FUJIMOTO W Y,ENSINCK J W.Effects of glucagonlike peptide I-(7-36) on release of insulin,glucagon,and somatostatin by rat pancreatic islet cell monolayer cultures[J].Diabetes,1989,38(12):1534-1538.
[50] SAMOLS E,BONNER-WEIR S,WEIR G C.Intra-islet insulin-glucagon-somatostatin relationships[J].Clin Endocrinol Metab,1986,15(1):33-58.
[51] MACDONALD P E,EL-KHOLY W,RIEDEL M J,et al.The multiple actions of GLP-1 on the process of glucose-stimulated insulin secretion[J].Diabetes,2002,51 (Suppl 3):S434-442.
[52] MEIER J J,KEMMERIES G,HOLST J J,et al.Erythromycin antagonizes the deceleration of gastric emptying by glucagon-like peptide 1 and unmasks its insulinotropic effect in healthy subjects[J].Diabetes,2005,54(7):2212-2218.
[53] HOLST J J.Gut hormones as pharmaceuticals.From enteroglucagon to GLP-1 and GLP-2[J].Regul Pept,2000,93(1-3):45.
[55] GUTZWILLER J P,DREWE J,GOKE B,et al.Glucagon-like peptide-1 promotes satiety and reduces food intake in patients with diabetes mellitus type 2[J].Am J Physiol,1999,276(5 Pt 2):R1541-1544.
[56] HOLST J J.The physiology of glucagon-like peptide 1[J].Physiol Rev,2007,87(4):1409-1439.
[57] SCROCCHI L A,BROWN T J,MACLUSKY N,et al.Glucose intolerance but normal satiety in mice with a null mutation in the glucagon-like peptide 1 receptor gene[J].Nat Med,1996,2(11):1254-1258.
[58] BALKAN B,LI X.Portal GLP-1 administration in rats augments the insulin response to glucose via neuronal mechanisms[J].Am J Physiol Regul Integr Comp Physiol,2000,279(4):R1449-1454.
[59] KNAUF C,CANI P D,PERRIN C,et al.Brain glucagon-like peptide-1 increases insulin secretion and muscle insulin resistance to favor hepatic glycogen storage[J].J Clin Invest,2005,115(12):3554-3563.
[60] SANDOVAL D.CNS GLP-1 regulation of peripheral glucose homeostasis[J].Physiol Behav,2008,94(5):670-674.
[61] BARRAGAN J M,RODRIGUEZ R E,BLAZQUEZ E.Changes in arterial blood pressure and heart rate induced by glucagon-like peptide-1-(7-36) amide in rats[J].Am J Physiol,1994,266(3 Pt 1):E459-466.
[62] NIKOLAIDIS L A,ELAHI D,HENTOSZ T,et al.Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy[J].Circulation,2004,110(8):955-961.
[63] FONTANA J,CERVINKOVA Z,ANDEL M.Effects of GLP-1 (glucagon-like peptide 1) on liver[J].Vnitrni Lekarstvi,2013,59(7):551-558.
[64] BENITO E,BLAZQUEZ E,BOSCH M A.Glucagon-like peptide-1-(7-36)amide increases pulmonary surfactant secretion through a cyclic adenosine 3′,5′-monophosphate-dependent protein kinase mechanism in rat type II pneumocytes[J].Endocrinology,1998,139(5):2363-2368.
[65] GUTZWILLER J P,TSCHOPP S,BOCK A,et al.Glucagon-like peptide 1 induces natriuresis in healthy subjects and in insulin-resistant obese men[J].J Clin Endocrinol Metab,2004,89(6):3055-3061.
[66] BRIONES M,BAJAJ M.Exenatide:a GLP-1 receptor agonist as novel therapy for Type 2 diabetes mellitus[J].Expert Opin Pharmacother,2006,7(8):1055-1064.
[67] DRUCKER D J,DRITSELIS A,KIRKPATRICK P.Liraglutide[J].Nat Rev Drug Discov,2010,9(4):267-268.
