白藜芦醇对白细胞介素-1β诱导的软骨细胞凋亡及增殖能力的影响
2014-09-13杨建辉吕建国聂会勇申晓东
杨建辉 吕建国 聂会勇 申晓东
(西安交通大学医学院第一附属医院康复中心,陕西 西安 710061)
软骨细胞凋亡在骨关节炎(OA)的发生、发展中发挥重要作用〔1〕。细胞凋亡增加,必然导致软骨基质的降解,基质合成减少,且对促进基质合成增加的治疗措施效果不佳〔2〕。白藜芦醇是一种非黄酮类多酚化合物,具有抗衰老、抗氧化、抗炎、抗肿瘤活性、调控细胞凋亡、雌激素调节及免疫调节等多种生物学活性〔3,4〕。本实验以IL-1β诱导的软骨细胞凋亡模拟体内炎性环境下软骨细胞变化,研究白藜芦醇对软骨细胞凋亡及增殖能力的影响。
1 材料与方法
1.1实验试剂 重组人白细胞介素(rhIL)-1β(Pepro-Tech);胰蛋白酶,Ⅱ型胶原酶,DMEN/F12培养基,胎牛血清(Gibco);Hoechst 33342,罗丹明-123(Rhodamine-123)(Sigma);TUNEL试剂盒,SABC试剂盒(武汉博士德公司);MTT,DMSO(Amresco);RNA酶抑制剂(RNase,TAKaRa);白藜芦醇溶液由西安交通大学医学院实验中心提供。
1.2含药血清和正常兔血清的制备 将白藜芦醇按体表面积折算动物的等效剂量〔5〕,再用生理盐水配成8 ml溶液给新西兰大白兔灌胃,正常兔血清则以生理盐水8 ml灌胃。连续2次灌胃,中间间隔2 h,在末次灌胃的3 h后,乙醚和氯胺酮复合麻醉下腹主动脉采血,4℃冰箱过夜后,离心2 500 r/min×25 min,抽取血清,56℃、30 min灭活,经0.45 μm滤膜抽滤除菌、分装,-20℃保存备用。
1.3软骨细胞的分离与培养 无菌条件下取1个月龄新西兰大耳白兔肩、膝关节软骨,将软骨块用D-Hank液漂洗,剪碎至1 mm3大小,加入0.2%Ⅱ型胶原酶,置振荡器上,37℃震荡消化1 h,然后再加入0.25%胰蛋白酶作用30 min后,将游离出的带有酶溶液的软骨细胞用吸管吸出,120目尼龙网筛过滤,获取软骨细胞,细胞活力分析仪检测细胞活力>95%。将消化所得的细胞悬浮于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM/F12培养基中,密度105/ml(Vi-cell细胞活力分析仪计数)接种于6孔板,24孔板或96孔板,置37℃,5% CO2,95%湿度培养箱中培养。48 h后视细胞贴壁情况更换培养液,以后每2天更换培养液1次,待细胞80%汇合后,培养基中加入不同处理因素。实验分为5组,A组(对照组):培养液中无任何刺激因子,每孔加入正常兔血清100 μl;B组:培养液含10 ng/ml IL-1β+正常兔血清100 μl;C组:培养液含10 ng/ml IL-1β+10%含白藜芦醇血清100 μl;D组:培养液含10 ng/ml IL-1β+20%含白藜芦醇血清100 μl;E组:培养液含10 ng/ml IL-1β+40%含白藜芦醇血清100 μl;每组设4个复孔,连续培养24 h后进行检测。实验重复5次。
1.4指标检测及方法
1.4.1细胞形态学观察 细胞培养24 h后,将各组细胞置于倒置相差显微镜下观察细胞形态、核分裂象的变化。
1.4.2TUNEL法检测细胞凋亡 将对照组和各试验组培养的软骨细胞,以1×104/ml接种在放有预处理盖玻片的6孔培养板中进行细胞爬片,贴壁培养,待细胞爬片良好长成单层时,移除孔内的液体。3%过氧化氢室温处理10 min。加0.01 mol/L Tris-HCl缓冲液(TBS),1∶200新鲜稀释蛋白酶K 37℃消化15 min,每片加入20 μl TdTDIG-d-UTP标记缓冲液的混合液(1∶1∶18)中,37℃标记2 h。加封闭液50 μl/片,室温30 min,甩掉封闭液,不洗,用抗体稀释液1∶100稀释生物素化抗地高辛抗体,混匀后50 μl/孔加之标本片上。置样品于湿合中,37℃反应30 min。0.01 mol/L TBS洗2 min×3次。用抗体稀释液1∶100稀释SABC,混匀后加至盖玻片上。37℃反应30 min。0.01 mol/L TBS洗5 min×4次。DAB显色,苏木素轻度复染。0.01 mol/L TBS洗,蒸馏水洗。脱水,透明,封片,显微镜观察。TUNEL法检测细胞凋亡结果判定:切片中软骨细胞细胞核内呈现棕黄色颗粒者为阳性结果。每张切片光镜下计数10个400倍视野,凋亡指数=凋亡细胞数/细胞总数×100%。
1.4.3凋亡细胞核检测 Hoechst 33342是一种能与DNA特异性结合的荧光染料,在培养液中加入Hoechst 33342至终浓度2%,室温下避光染色30 min后,PBS洗涤2次,置于荧光显微镜下观察(激发波长355 nm,发射波长465 nm)。
1.4.4MTT比色法检测 选经加入处理因素培养24 h的96孔板细胞,每孔加入5 mg/ml MTT溶液50 μl,作用4 h,弃上清后加入150 μl DMSO,震荡混匀15 min后,在酶标仪上测定490 nm波长的吸光度值(A490),计算抑制率。
1.4.5流式细胞仪检测细胞周期和增殖指数 选取加入处理因素培养24 h的6孔板细胞,胰蛋白酶消化收集各孔细胞,1 000 r/min离心5 min,弃上清,冷PBS洗2次,70%乙醇固定,4℃过夜。上机前离心去乙醇,冷PBS洗涤后将细胞重悬于1 ml冷PBS中,RNase(10 μg/ml)37℃孵育30 min,加入碘化丙啶(PI,50 μg/ml)染色5 min后上机检测。增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
1.5统计学分析 采用SPSS11.5软件进行单因素方差分析。
2 结 果
2.1细胞形态变化 见图1。正常软骨细胞在镜下呈片状贴附,形态成类圆形、多边形或多角形,胞质内可见折光颗粒,周围有细长的突起,胞核明显呈圆形或椭圆形,核仁清晰,染色质均匀分布,部分细胞胞体增大,可见核分裂象,表现出S期和G2/M的细胞特征。经IL-1β处理的软骨细胞呈去分化表现,细胞胞质回缩,细胞体积缩小,细胞内出现空泡,核分裂象减少。不同浓度的白藜芦醇+IL-1β处理后的软骨细胞,形态上与正常细胞无明显区别。
2.2白藜芦醇对IL-1β诱导软骨细胞凋亡的影响 A组细胞凋亡率平均仅为3.2%,经IL-1β诱导(B组)的软骨细胞凋亡率高达25.5%,二者差异有统计学意义(P<0.01)。含10%、20%、40%白藜芦醇血清组和IL-1β共同作用后(C组、D组、E组)的软骨细胞凋亡率分别为19.4%,11.8%,5.3%;与B组相比差异有统计学意义(P值分别为0.0361、0.0082、0.0067);C、D、E组组间,差异有统计学意义(P<0.05),且随白藜芦醇浓度的增加,细胞凋亡率逐渐降低,表明白藜芦醇对软骨细胞凋亡有明显抑制作用,且呈剂量依赖性。
2.3核形态学变化 见图2。正常软骨细胞核呈类圆形,染色质均匀分布,经IL-1β处理的软骨细胞中有许多出现典型的凋亡核特征,核浓缩、核碎裂,凋亡小体形成,核分裂象减少。经不同浓度白藜芦醇处理后的软骨细胞,细胞凋亡明显减少。
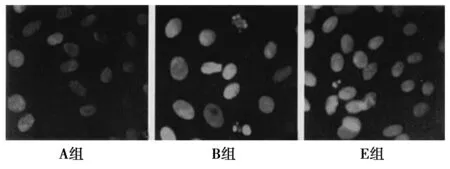
图1 不同处理组软骨细胞形态学变化比较(×200)
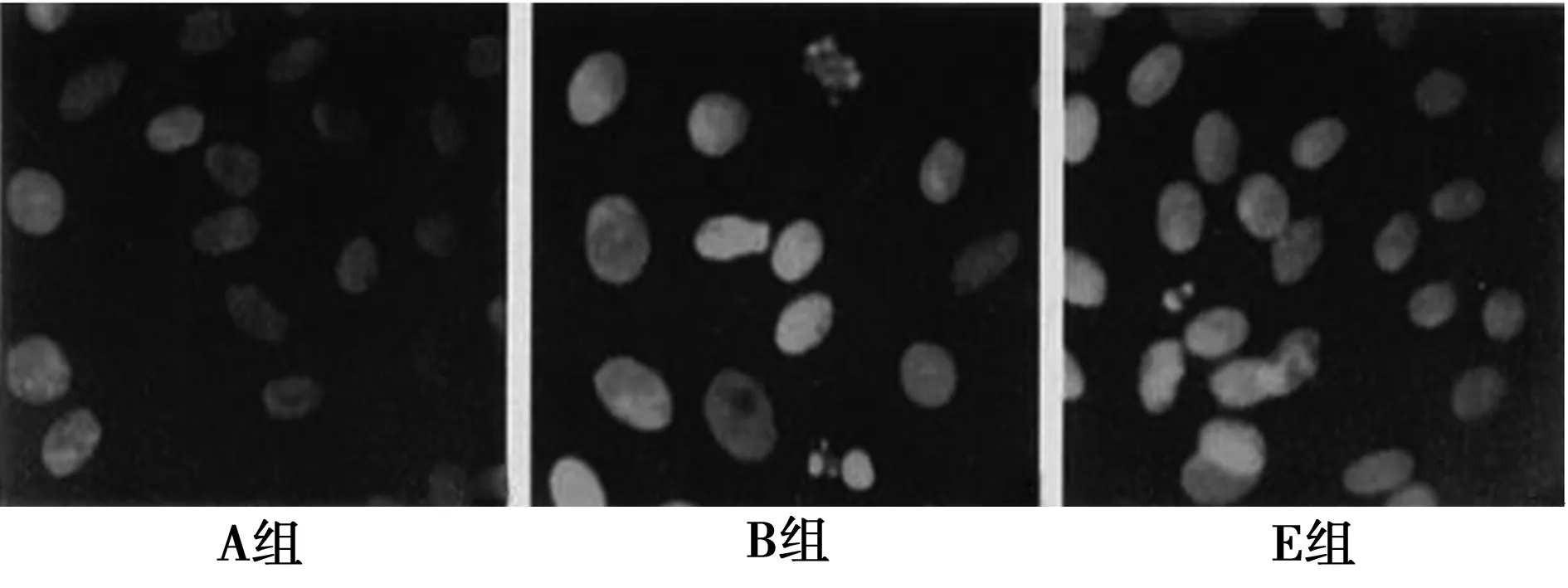
图2 各组细胞核形态学变化Hoechst 33342荧光染色(×800)
2.4MTT检测结果 见表1。IL-1β能明现抑制软骨细胞生长,抑制率达61.3%。10%、20%、40%白藜芦醇组对IL-1β作用的软骨细胞均有保护作用,其抑制率分别为33.2%、24.3%、13.4%,呈剂量依赖性。

表1 不同处理组细胞周期分布及增殖指数±s,%)
2.5流式细胞仪检测结果 见表1。正常软骨细胞增殖能力旺盛,细胞PI达到23.4%;IL-1β处理的软骨细胞PI明显低于正常细胞,仅为7.3%,具有分裂象的S期和G2/M期细胞明显减少;而加入白藜芦醇组S期和G2/M期细胞明显增多,PI明显高于IL-1β诱导组,细胞增殖能力恢复,呈剂量依赖趋势。
3 讨 论
研究证实了软骨细胞凋亡在OA发病中的主要作用,也为抑制软骨细胞凋亡作为治疗手段提供了依据〔6〕。由于关节软骨内不含血管和软骨细胞被软骨基质所包绕,机体内的巨噬细胞无法清除已经发生凋亡的软骨细胞,存留的凋亡小体通过释放基质金属蛋白酶等酶类加速软骨组织的降解〔1〕。
研究表明前炎性介质IL-1β、NO在OA发病中起着重要的作用,可以诱导软骨细胞凋亡〔7〕。IL-1β是存在于骨关节炎软骨及滑液中的重要炎性因子,不仅抑制软骨基质的合成,加速胶原和蛋白多糖的降解,而且抑制软骨细胞增殖,诱导软骨细胞凋亡,通过一系列级联反应引起关节软骨的破坏和炎症反应〔8,9〕,已作为人工制作OA模型的诱导剂而广泛使用〔10〕。
白藜芦醇是植物为抵抗外界刺激如紫外线、真菌、病毒感染或机械损伤而产生的一种植物抗毒素,存在于多种植物中。体外实验中白藜芦醇可抑制白细胞介素(IL)-1β诱导的软骨基质的降解〔11〕,并可抑制IL-1β对软骨细胞caspase-3(细胞凋亡的主要执行者)的激活,故认为白藜芦醇可在体外抑制软骨细胞的凋亡〔12〕。在脂多糖诱导的实验性关节炎中,予关节腔内注射白藜芦醇,可明显减少软骨基质蛋白多糖的丢失及软骨的破坏〔13〕。NO是OA发病机制中的重要介质,可以诱导软骨细胞凋亡,在OA模型狗的实验中,抑制NO,可以降低软骨细胞的凋亡率,减轻软骨的破坏〔14,15〕。予OA模型兔口服白藜芦醇,关节滑液中NO的水平明显降低〔16〕。本实验显示白藜芦醇能明显抑制IL-1β诱导的软骨细胞凋亡。
4 参考文献
1Hashimotos C,Ochs R,Komiyas F,etal.Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis〔J〕.Arthritis Rheum,1998;41(13):1632-8.
2Chen MH,Wang JL,Wong CY,etal.Relationship of chondrocyte apoptosis to matrix degradation and swelling potential of osteoarthritic cartilage〔J〕.J Formos Med Assoc,2005;104:264-72.
3Brisdelli FD,Andrea G,Bozzi A.Resveratrol:a natural polyphenol with multiple chemopreventive properties〔J〕.Curr Drug Metab,2009;10(6):530-46.
4Fabris S,Momo F,Ravagnan G,etal.Antioxidant properties of resveratrol and piceid on lipid peroxidation in micelles and monolamellar liposomes〔J〕.Biophys Chem,2008;135(1-3):7683.
5詹红生,赵咏芳,冯 伟.含药血清方法在中药调节骨与软骨代谢基础研究中的应用〔J〕.中国骨伤,2000;3(11):661-2.
6包乐媛,李会强,毕晓阳,等.人滑膜细胞的分离培养与鉴定〔J〕.中国医学检验杂志,2004;5(2):386-8.
7Jatvinen K,Vuolteenaho K,Nieminen R,etal.Selective inNOS inhibitor 1 400 W enhances anti-catabolic IL-10 and reduces destructive MMP-10 in OA cartilage.Survey of the effects of 1 400 W on inflammatory mediators produced by OA cartilage as detected by protein antibody array〔J〕.Clin Exp Rheumatol,2008;26(2):275-82.
8Pelletier JP,Martel-Pelletier J.Evidence for the involvement of interleukin-1 in human osteoarthritic cartilage degradation:protective effect of NSAID〔J〕.J Rheumatol Suppl,1989;18(14):19-27.
9Kobayashi M,Squires GR,Mousa A,etal.Role of interleukin-1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage〔J〕.Arthritis Rheum,2005;52(9):128-35.
10de IsIa NG,StoItz JF.In vitro inhibition of IL-1 beta catabolic effects on cartilage:a mechanism involved on diacerein anti-OA properties〔J〕.Biorheology,2008;45(34):433-8.
11Ming LEI,Shi-qing LIU,Yu-lan LIUetal.Resveratrol protects bone marrow mesenchymal stem cell derived chondrocytes cultured on chitosan-gelatin caffolds from the inhibitory effect of interleuin-1β〔J〕.Acta Pharmacol Sin,2008;29(11):1350-6.
12Shakibaei M,John T,Seifarth C,etal.Resveratrol inhibits IL-1 beta-induced stimulation of caspase-3 and cleavage of PARP in human articular chondrocytes in vitro〔J〕.Ann N Y Acad Sci,2007;1095(13):554-63.
13Elmali N,Baysal O,Harma A,etal.Effects of resveratrol in inflammatory arthritis〔J〕.Inflammation,2007;30(8):1-6.
14Pelletier IP,Jovanovic DV,Lascau Coman V,etal.Selective inhibitor of inducible nitric oxide synthase reduces progression of experimental osteoarthritis in vitro:possible link with the reduction in chondrocyte apoptosis and caspase-3 level〔J〕.Arthritis Rheum,2000;43(10):1290-9.
15Surazynski A,Miltyk W,Czarnomysy R,etal.Hyaluronic acid abrogates nitric oxide-dependent stimulation of collagen degradation in cultured human chondrocytes〔J〕.Pharmacol Res,2009;60(1):46-9.
16童 敏,高 戈,高洁生,等.白藜芦醇对骨关节炎模型兔关节液中一氧化氮水平的影响〔J〕.新乡医学院学报,2007;24(1):49-52.
