抑制CK2增加Sorbitol引起的肺癌细胞凋亡
2014-09-13徐晓光蒋颖超
齐 昕 徐晓光 蒋颖超
(吉化集团公司总医院,吉林 吉林 132001)
许多研究显示,山梨醇(Sorbitol)作为一种糖醇可以诱导多种癌症细胞凋亡〔1,2〕。在肺癌细胞中Sorbitol可以诱导细胞死亡,然而,Sorbitol也可以增加酪蛋白激酶(CK)2的表达,因此被认为是Sorbitol应用的弊端。 CK2是一种致癌基因,在包括肺癌在内的多种人类肿瘤中普遍上调。研究发现CK2可以参与调控细胞生长、增殖和凋亡〔3〕,通过激活核转录因子(NF)-κB促进癌症细胞存活〔4,5〕,保护癌症细胞免受药物诱导的凋亡〔6〕。研究显示,通过siRNA技术或抑制剂抑制CK2的活性可以引起癌症细胞凋亡〔7~11〕。因此靶向CK2可能会为癌症治疗或者联合治疗提供一种可能性。本文分析CK2抑制剂(TBB)与Sorbitol联合应用在肿瘤抑制中的效应及其根本机制。
1 材料与方法
1.1主要试剂与仪器 山梨醇(Sorbitol),TBB,四甲基偶氮唑蓝(MTT)购自Sigma公司(美国),胎牛血清和DMEM培养基购自Gibco公司(美国)。
1.2细胞株与细胞培养 人肺癌A549细胞购自美国ATCC公司,细胞于含10%胎牛血清DMEM培养基中,当A549细胞生长至对数生长期时进行细胞传代和实验。
1.3MTT法检测细胞活性 A549细胞以1×104/ml密度接种于96孔细胞培养板中,每孔加100 μl,待细胞隔夜培养完全贴壁后给予不同的药物,继续培养24 h后,加入MTT溶液后继续培养4 h,分为对照组(Control),Sorbitol 1 h组,Sorbitol 2 h组,Sorbitol 3 h组。结束后用加样器弃除上清,每孔加入150 μl二甲基亚砜(DMSO),振荡器上混匀10 min,用酶标仪于490 nm波长处测定吸光度(A)值。按下面公式计算细胞存活率。细胞存活率 (%) =〔A实验孔-A空白孔/(A对照孔-A空白孔)〕×100%
1.4Western印迹检测细胞蛋白表达 将各组药物处理过的A549细胞,加入细胞裂解液(RIPA),用细胞刮将贴壁细胞刮下,收集到1.5 ml离心管中,裂解20 min后,离心收集上清,测蛋白浓度,加入上样缓冲液煮沸变性后进行丙烯酰胺凝胶电泳。分离胶浓度10%,电泳结束后将胶上的蛋白转移至聚偏氟乙烯(PVDF)膜上,100 V,转膜2 h,转膜结束后5%脱脂奶粉封闭1 h。封闭结束后,加入相应的一抗(Cell Signaling公司1∶1 000) 4℃孵育过夜,第二天加入对应的二抗 (Cell Signaling公司1∶5 000)室温孵育2 h,Tris盐酸缓冲液(TBST)洗3次膜,每次15 min,化学荧光法(ECL)显影,扫描。
2 结 果
2.1Sorbitol抑制肺癌A549细胞生长 对照组细胞存活率为1。Sorbitol可以引起细胞活性降低,并呈时间依赖性。Sorbitol作用1,2,3 h后细胞存活率分别为(79±4.37)%、(64.4±3.74)%、(50.4±2.65)%。不同浓度Sorbitol(0.5、1、1.5 mol/L)可以显著降低细胞活性,各组细胞存活率分别为(77.5±2.03)%、(62.7±1.74)%、(49.9±2.2)%,并呈剂量依赖性。
2.2Sorbitol介导A549细胞凋亡 分别用0.5、1、1.5 mol/L Sorbitol处理A549细胞,Western印迹检测发现不同浓度的Sorbitol可以明显引起细胞色素C释放,诱导caspase3和RARP的活化。见图1,表1。
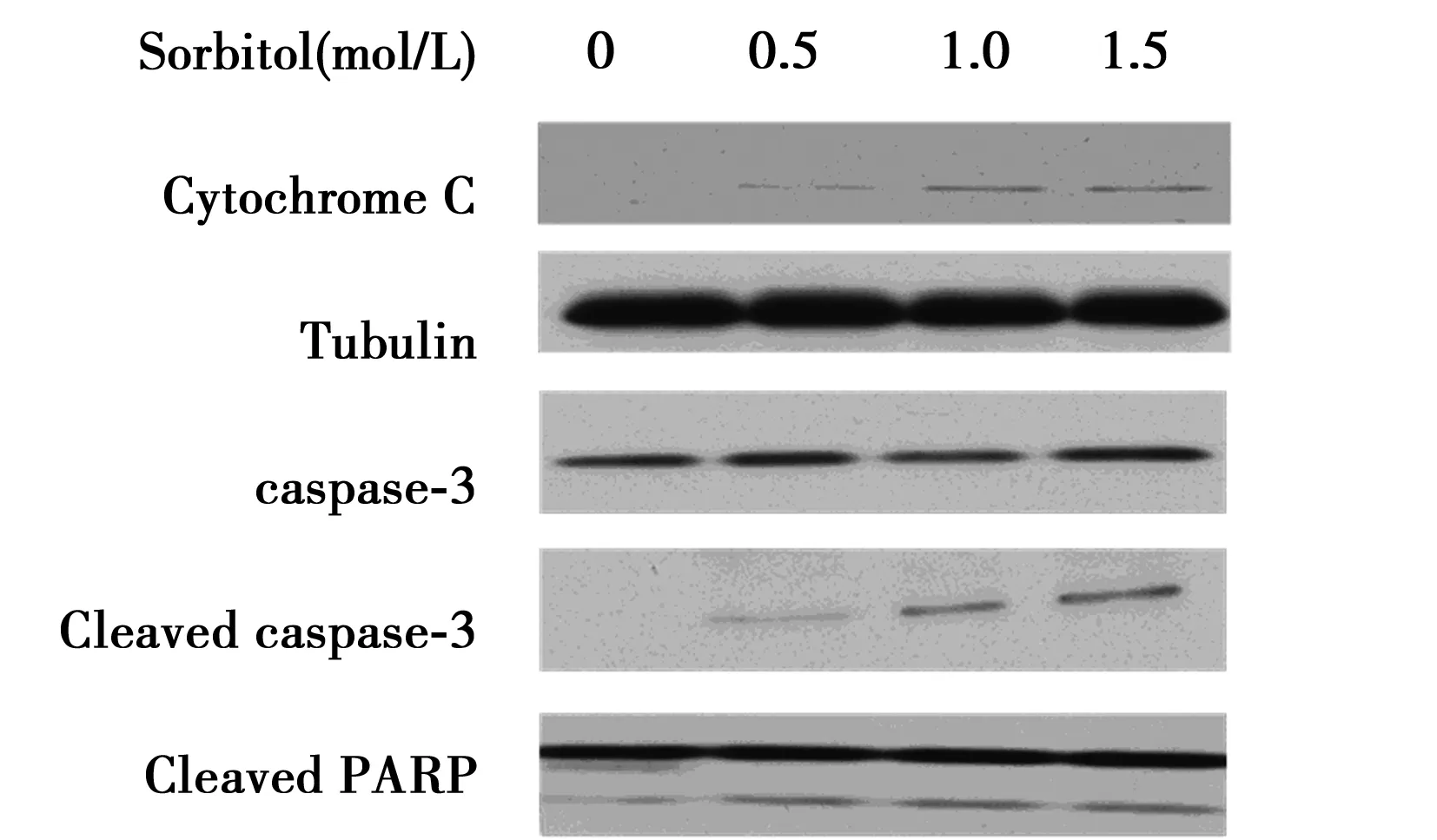
图1 Sorbitol对A549细胞Cytochrome C、Cleaved caspase-3和Cleaved PARP表达水平的影响

表1 Sorbitol对A549细胞Cytochrome C, Cleaved caspase-3和Cleaved PARP表达水平的影响±s)
2.3联合应用TBB增加Sorbitol对A549细胞的生长抑制 结果显示,单独应用TBB对细胞活性没有影响,联合应用TBB增加了Sorbitol在A549细胞中的生长抑制效应。同时,联合应用TBB可以显著增加细胞色素C的释放、caspas-3的活化以及RARP的剪切,结果显示,联合应用TBB可以增加Sorbitol诱导的细胞凋亡。见图2,表2。
2.4TBB可能通过恢复Sorbitol诱导的早幼粒细胞性白血病(PML)降低促进了凋亡 在0.5、1、1.5 mol/L浓度下Sorbitol可以显著降低细胞内PML蛋白表达水平(0.277±0.064、0.186±0.075、0.112±0.057,对照组为0.326±0.073);而联合应用TBB,细胞内PML蛋白表达水平回升,对照组为0.156±0.054,TBB组为0.163±0.042,Sorbitol组为0.075±0.033,Sorbitol+TBB组为0.149±0.042。见图3,图4。
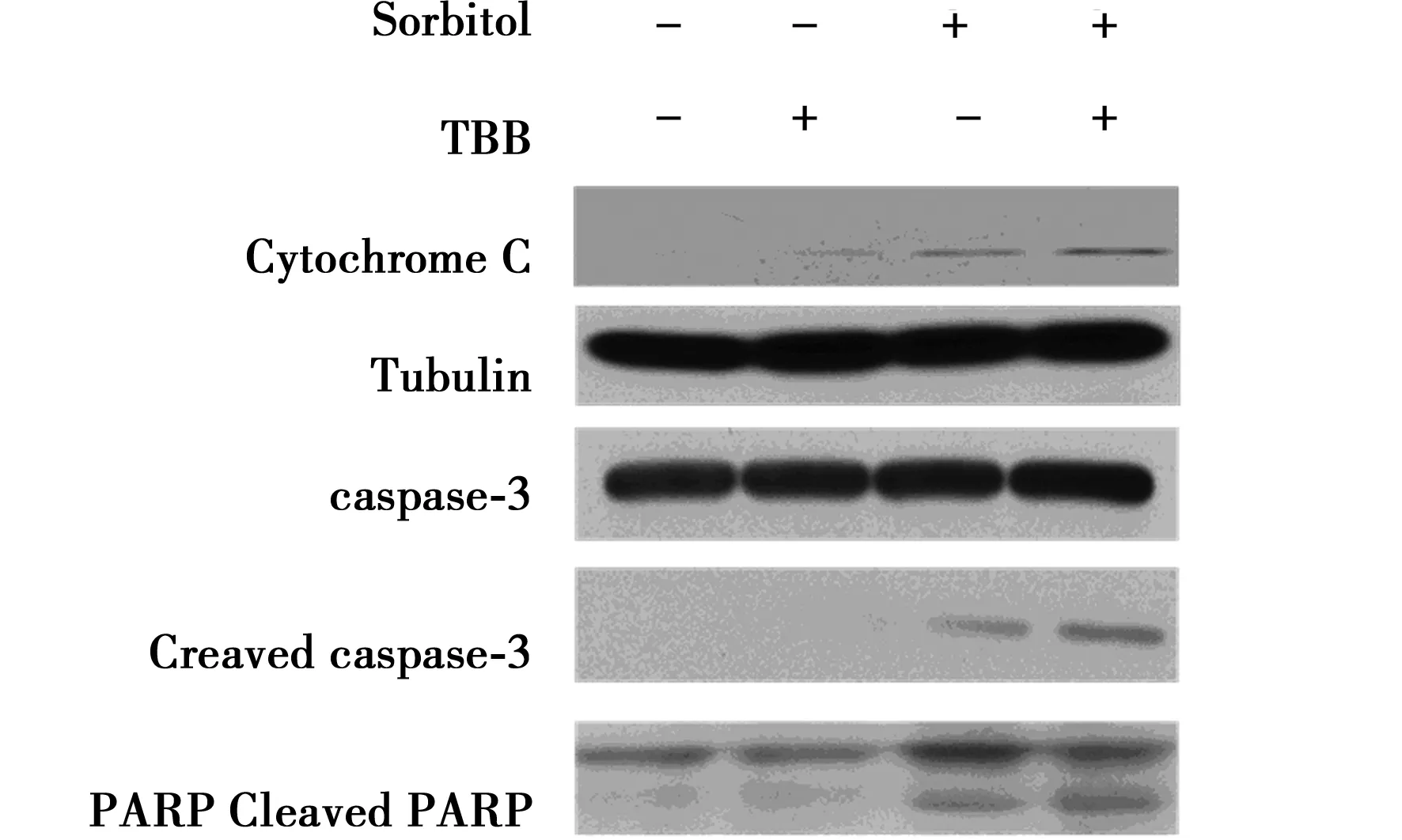
图2 TBB对Sorbitol引起A549细胞Cytochrome C、Cleaved caspase-3和Cleaved PARP水平改变的影响

表2 CK2抑制剂TBB对Sorbitol引起A549细胞活性的影响±s)

图3 不同浓度Sorbitol对A549细胞PML蛋白表达水平的影响

图4 TBB对Sorbitol引起A549细胞PML水平改变的影响
3 讨 论
有报道称,Sorbitol作为一种己糖可以引起Hep-2细胞凋亡,并且可以在胃癌细胞系中诱导细胞核和DNA断裂〔1〕。同样有研究表明,在人类白血病K562细胞中,Sorbitol可以上调bax、下调bcl-2,最终导致细胞色素C的释放〔2〕。本文的结果显示Sorbitol可以显著抑制肺癌A549细胞的生长,增加细胞色素C的释放以及caspase3的活化和RARP的剪切。然而数据也显示,Sorbitol可以增加CK2的水平,从而发挥一定的促活功能。
CK2的促瘤效应与其可以下调PML蛋白的功能息息相关〔12〕。PML最初是在急性早幼粒细胞性白血病(APL)t(15;17)染色体异位的断点处被确认的〔13,14〕。并且PML蛋白属于一个庞大的蛋白家族,这一家族蛋白普遍存在一个非结构化的C末端区域以及位于N末端的RBCC结构域,包括一个环指结构(R)、两个附属锌指结构(B盒;B)和一个α-螺旋卷曲(α-helical coiled-coil)结构域(CC)。RBCC结构域调控蛋白质-蛋白质相互作用和PLM蛋白的多聚化〔15〕。在细胞中,PML蛋白在调控细胞生长,转化抑制和衰老中起到关键作用。而且小鼠内PML蛋白的失活导致了癌症敏感性〔16,17〕。PML参与了复杂的肿瘤抑制信号网络,包括激活p53和抑制PI3K/AKT〔15〕。已有研究证明,PML在许多癌症中是下调的,包括肺癌、结肠癌、胃癌、乳腺癌和中枢神经系统肿瘤〔18〕。
然而,PML几乎不发生突变,而其下调主要是由其他分子对它的翻译后修饰引起的〔19〕。CK2是PML重要的调控者之一。CK2通过直接磷酸化PML第517位丝氨酸促进泛素介导的降解途径从而调控PML蛋白水平,并且在体内试验中,抑制CK2可以增加PML蛋白的肿瘤抑制功能〔12〕。在本研究中,应用蛋白激酶CK2选择性细胞渗透性抑制剂4,5,6,7-四溴-1H-苯并三唑(TBB)〔20〕抑制在人类肺癌细胞系A549细胞中的CK2,结果发现联合应用TBB可以明显恢复PML蛋白水平。
联合化疗是抑制细胞内不同存活通路的有效的癌症治疗策略。在这项研究中,将TBB与Sorbitol联合应用来诱导肺癌A549细胞凋亡。除外其凋亡效应,发现Sorbitol可以降低PML蛋白水平,而这可能是单一Sorbitol治疗的缺陷。因此联合应用CK2抑制剂TBB处理细胞。在肺癌A549细胞中可见,与单一应用Sorbitol相比,联合应用TBB可以通过抑制CK2明显恢复PML蛋白水平,并且抑制细胞生长。同时发现,联合用药可以增加Cleaved caspase-3和Cleaved PARP的水平,这些结果提示Sorbitol联合应用TBB可能是肺癌治疗的一种可行性策略。
4 参考文献
1Teramachi K,Izawa M.Rapid induction of apoptosis in human gastric cancer cell lines by sorbitol〔J〕.Apoptosis,2000;5(2):181-7.
2Marfè G,Morgante E,Di Stefano,etal.Sorbitol-induced apoptosis of human leukemia is mediated by caspase activation and cytochrome c release〔J〕.Arch Toxicol,2008;82(6):371-7.
3Ahmad KA,Wang G,Slaton J,etal.Targeting CK2 for cancer therapy〔J〕.Anticancer Drugs,2005;16(10):1037-43.
4Romieu-Mourez R,Landesman-Bollag E,Seldin DC,etal.Protein kinase CK2 promotes aberrant activation of nuclear factor-κB,transformed phenotype,and survival of breast cancer cells〔J〕.Cancer Res,2002;62(22):6770-8.
5Romieu-Mourez R,Landesman-Bollag E,Seldin DC,etal.Roles of IKK kinases and protein kinase CK2 in activation of nuclear factor-κB in breast cancer〔J〕.Cancer Res,2001;61(9):3810-8.
6Guo C,Yu S,Davis A,etal.A potential role of nuclear matrix-associated protein kinase CK2 in protection against drug-induced apoptosis in cancer cells〔J〕.J Biol Chem,2001;276(8):5992-9.
7Bortolato A,Cozza G,Moro S.Protein kinase CK2 inhibitors: emerging anticancer therapeutic agents〔J〕?Anticancer Agents Med Chem,2008;8(7):798-806.
8Trembley JH,Chen Z,Unger G,etal.Emergence of protein kinase CK2 as a key target in cancer therapy〔J〕.Biofactors,2010;36(2):187-95.
9Hanif IM,Shazib MA,Ahmad KA,etal.Casein kinase Ⅱ:an attractive target for anti-cancer drug design〔J〕.Int J Biochem Cell Biol,2010;42(10):1602-5.
10Faust RA,Tawfic S,Davis AT,etal.Antisense oligonucleotides against protein kinase CK2-alpha inhibit growth of squamous cell carcinoma of the head and neck in vitro〔J〕.Head Neck,2000;22(4):341-6.
11Trembley JH,Unger GM,Tobolt DK,etal.Systemic administration of antisense oligonucleotides simultaneously targeting CK2alpha and alpha' subunits reduces orthotopic xenograft prostate tumors in mice〔J〕.Mol Cell Biochem,2011;356(1-2):21-35.
12Scaglioni PP,Yung TM,Cai LF,etal.A CK2-dependent mechanism for degradation of the PML tumor suppressor〔J〕.Cell,2006;126(12):269-84.
13Louria-Hayon I,Grossman T,Sionov RV,etal.The promyelocytic leukemia protein protects p53 from Mdm2-mediated inhibition and degradation〔J〕.J Biol Chem,2003;278(35):33134-41.
14Bernardi R,Papa A,Pandolfi P.Regulation of apoptosis by PML and the PML-NBs〔J〕.Oncogene,2008;27(48):6299-312.
15Bernardi R,Pandolfi PP.Structure,dynamics and functions of promyelocytic leukaemia nuclear bodies〔J〕.Nat Rev Mol Cell Biol,2007;8(12):1006-16.
16Salomoni P,Pandolfi PP.The role of PML in tumor suppression〔J〕.Cell,2002;108(2):165.
17Trotman LC,Alimonti A,Scaglioni PP,etal.Identification of a tumour suppressor network opposing nuclear Akt function〔J〕.Nature,2006;441(7092):523-7.
18Gurrieri C,Capodieci P,Bernardi R,etal.Loss of the tumor suppressor PML in human cancers of multiple histologic origins〔J〕.J Nat Cancer Inst,2004;96(4):269-79.
19Macleod K.Tumor suppressor genes〔J〕.Curr Opin Genet Dev,2000;10(1):81-93.
20Sarno S,Reddy H,Meggio F.Selectivity of 4,5,6,7-tetrabromobenzotriazole,an ATP site-directed inhibitor of protein kinase CK2 ('casein kinase-2')〔J〕.FEBS Letters,2001;496(1):44-8.
