乌司他丁对细菌脂多糖共孵育的内皮祖细胞功能的影响
2014-09-13乔鲁军
徐 敏 鲍 芳 乔鲁军
(东营市胜利油田中心医院,山东 东营 257000)
随着老龄化社会的到来,重症医学科(ICU)收治的脓毒症患者亦趋于老龄化,老年患者常并发各种器官功能不全,更易发展为脓毒症休克、多器官障碍综合征(MODS)〔1~3〕。因此治疗药物的选择上更加慎重,乌司他丁作为改善炎症反应的药物,近年来在使用安全上有较好的优势,但其疗效及使用剂量上仍有不同的意见〔4~6〕。本实验通过LPS干预EPCs后加入不同剂量的乌司他丁以检测EPCs增殖、迁移功能,来模拟LPS诱导脓毒症后,乌司他丁对EPCs的作用,以期在细胞水平观察乌司他丁对脓毒症的影响。
1 材料与方法
1.1EPCs来源 采集健康志愿者外周静脉血,采用密度梯度离心法获取单个核细胞,铺板并培养,PBS除去非贴壁细胞并继续培养至7 d。
1.2EPCs鉴定 将贴壁细胞与DiI-acLDL(2.4 μg/ml) (Biomedical公司,美国)在 37℃下共孵育1 h后检测 DiI-acLDL的摄取量。2%多聚甲醛固定细胞10 min后PBS漂洗。37℃下与FITC-UEA-I (10 μg/ml) (Vector 公司,美国) 孵育1 h。最后采用激光共聚焦显微镜(Laser scanning confocal microscope, LSCM,Zeiss公司,德国)观察,若细胞呈现Dil-acLDL和UEA-I双染色阳性,说明EPCs鉴定成功。
1.3实验分组 贴壁细胞随机分成4组:①空白对照组:EGM-2MV标准液培养EPCs 48 h。②LPS组:采用EGM-2MV标准液配置的LPS液(100 ng/ml)培养EPCs 48 h。③乌司他丁-1、-2、-3组:采用EGM-2MV标准液配置的LPS液(100 ng/ml)培养EPCs 24 h后,再用前述LPS液配置的三种不同浓度乌司他丁液(100、200、400 IU/ml)培养EPCs 24 h。因细胞对培养液营养成分的需求,每24小时换液1次。
1.4增殖功能检测 EPCs经过3 d的传代培养,用PBS洗除非贴壁细胞,胰蛋白酶消化并离心(1 500 r/min)。除去上液,将细胞悬浮于EGM-2MV标准液,调节细胞浓度至1×105/ml。接种EPCs到96孔板,每孔加100 μl细胞悬浮液。24 h后去除上清液,加入EGM-2MV使细胞同步化,光学相差显微镜观察每孔内细胞生长均匀。各孔加入10 μl MTT液,4 h后用酶标仪检测490 nm处OD值。
1.5细胞迁移 EPCs经过3 d的传代培养,用PBS洗除非贴壁细胞,再用0.25%胰蛋白酶消化细胞,离心(1 500 r/min)4 min,弃上液,悬浮于EGM-2MV标准液,调节细胞浓度至106/ml。向第1组Transwell下室加入600 μl EGM-2MV标准液、第2~5组加入配置好的LPS液,每组设6个复孔,并将100 μl EPCs 悬液接种到上室,上室与下室之间隔以 8.0 μm 孔径硝酸纤维膜。37℃培养箱内孵育24 h,按实验设计加入相应试剂,再孵育24 h,向下室加入60 μl MTT 液,采用酶标仪检测490 nm处的OD值。
1.6统计学分析 采用SPSS17.0软件进行方差分析,组间比较根据方差齐性检验与否,采用S-N-K法或Tamhane方法。
2 结 果
2.1EPCs鉴定 光学相差显微镜下观察EPCs细胞形态:细胞成簇排列,成短梭状,增殖良好(见图1)。用FITC-UEA-I和Dil-acLDL双染色后采用LSCM观察荧光表达:FITC-UEA-I和DiI-acLDL双染色阳性细胞被认为是正在分化的EPCs,双染阳性细胞的百分率均在94%左右。
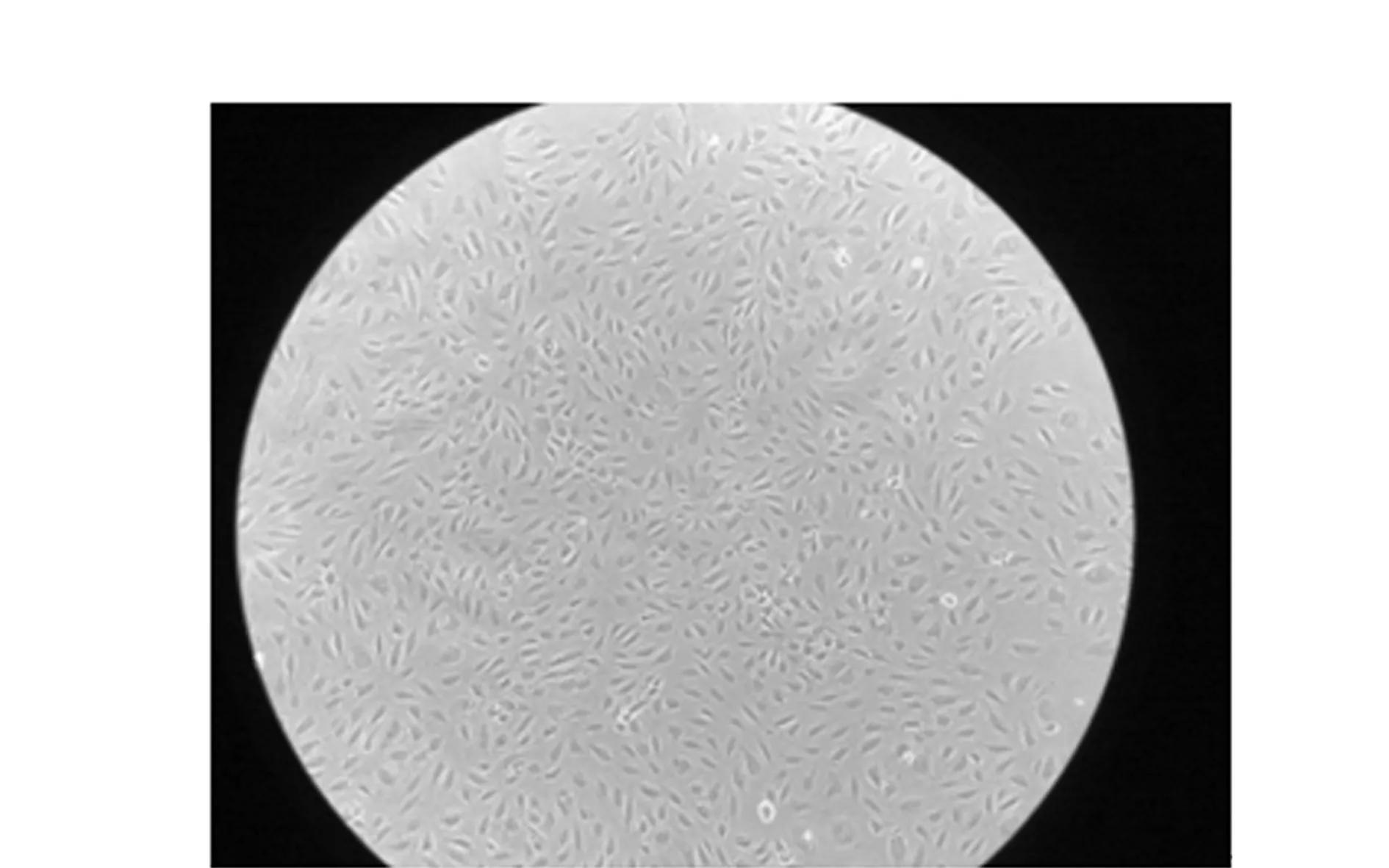
图1 光学相差显微镜观察下的EPCs
2.2细胞增殖 EPCs与LPS共孵育之后细胞增殖能力显著降低(P=0.000)。乌司他丁加入后EPCs的增殖OD值均有提高,且随乌司他丁浓度增加,其增殖能力亦由显著提高,组间比较有统计学差异(P<0.05)。见表1。
2.3对迁移的影响 与空白对照组比较,EPCs迁移OD值在LPS作用后明显降低(P=0.001),与乌司他丁作用后,EPCs迁移能力较LPS组有改善,并见剂量-效应关系。见表1。
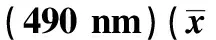
表1 LPS和不同浓度乌司他丁作用下EPCs的增殖、迁移OD值±s,n=10)
3 讨 论
脓毒症是由感染引起的系统性炎症反应综合征,发病机制复杂,涉及炎症、免疫、凝血等一系列基本问题,可以导致脓毒症休克和多器官障碍综合征,是目前全球所有重症医学科病人死亡的主要原因〔7,8〕。各种感染一旦诱发全身反应综合征(SIRS),均称为脓毒症,随着老龄化社会的到来以及医保覆盖人群的增加,ICU病房内,老年患者的床位占有率有逐年升高趋势,老年患者往往存在脏器功能基础差、多重耐药菌定植、易合并院感等特点,脓毒症极易向重症脓毒症、感染性休克转化,“后抗生素时代”往往在这些患者身上得到更好地诠释。EPCs是血管内皮细胞的前体细胞,在生理或病理因素刺激下,可从骨髓动员到外周血参与损伤血管的修复〔9〕。EPCs对脓毒症血管损伤的修复发挥重要作用,研究表明,脓毒症时,EPCs被动员、迁移、黏附在损伤血管处,不断分化为内皮细胞(EC),修复损伤血管,改善微循环〔10~12〕。
乌司他丁是健康成年男性新鲜尿液中分离纯化出来的一种酸性糖蛋白,具有抑制广谱蛋白酶的作用,分子量67 kD,由143个氨基酸残基组成〔13〕。目前研究发现,机体在休克和炎症的时候会产生大量的氧自由基以及炎性介质,造成组织细胞损害,乌司他丁能够抑制氧自由基的产生、抑制多种炎性介质及心肌抑制因子,改善微循环,起到抗炎、抗休克作用,避免疾病恶化〔14~16〕。进一步从分子水平研究发现,乌司他丁可以上调IL-10 水平,抑制 NF-κB活性〔17〕,抑制炎症反应,改善细胞损伤,乌司他丁对内皮细胞的保护已有相关文献报道〔18〕,但对EPCs的作用鲜有研究。
4 参考文献
1Dellinger RP,Levy MM,Rhodes A,etal.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock,2012〔J〕.Intensive Care Med,2013;39:165-228.
2Grimm A,Teschner U,Porzelius C,etal.Muscle ultrasound for early assessment of critical illness neuromyopathy in severe sepsis〔J〕.Crit Care,2013;17:227.
3He XD,Wang Y,Wu Q,etal.Xuebijing protects rats from sepsis challenged with acinetobacter baumannii by promoting annexin A1 expression and inhibiting proinflammatory cytokines secretion〔J〕.Evid Based Complement Alternat Med,2013;2013:804940.
4Jiang GT,Chen X,Li D,etal.Ulinastatin attenuates renal interstitial inflammation and inhibits fibrosis progression in rats under unilateral ureteral obstruction〔J〕.Mol Med Rep,2014;10:1501-8.
5Chen X,Wang Y,Luo H,etal.Ulinastatin reduces urinary sepsis related inflammation by upregulating IL10 and downregulating TNF alpha levels〔J〕.Mol Med Rep,2013;8:29-34.
6Fang Y,Xu P,Gu C,etal.Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response〔J〕.J Trauma,2011;71:1297-304.
7Toya SP,Li F,Bonini MG,etal.Interaction of a specific population of human embryonic stem cell-derived progenitor cells with CD11b+ cells ameliorates sepsis-induced lung inflammatory injury〔J〕.Am J Pathol,2011;178:313-24.
8Martini R,Kempfer CB,Rodrigues MA,etal.Bacterial contamination on platelet concentrates:identification,antimicrobial susceptibility profile and transfusion-related sepsis〔J〕.Rev Soc Bras Med Trop,2010;43:682-5.
9Pelliccia F,Pasceri V,Cianfrocca C,etal.Angiotensin Ⅱ receptor antagonism with telmisartan increases number of endothelial progenitor cells in normotensive patients with coronary artery disease:a randomized,double-blind,placebo-controlled study〔J〕.Atherosclerosis,2010;210:510-5.
10Spiel AO,Mayr FB,Leitner JM,etal.Simvastatin and rosuvastatin mobilize Endothelial Progenitor Cells but do not prevent their acute decrease during systemic inflammation〔J〕.Thromb Res,2008;123(1) :108-13.
11Fan H,Goodwin AJ,Chang E,etal.Endothelial progenitor cells and a stromal cell-derived factor-1alpha analogue synergistically improve survival in sepsis〔J〕.Am J Respir Crit Care Med,2014;189:1509-19.
12Becchi C,Pillozzi S,Fabbri LP,etal.The increase of endothelial progenitor cells in the peripheral blood:a new parameter for detecting onset and severity of sepsis〔J〕.Int J Immunopathol Pharmacol,2008;21:697-705.
13Sato H,Kajikawa S,Kuroda S,etal.Impaired fertility in female mice lacking urinary trypsin inhibitor〔J〕.Biochem Biophys Res Comm,2001;281:1154-60.
14Meng XX,Wang RL,Gao S,etal.Effect of ulinastatin on paraquat-induced-oxidative stress in human type II alveolar epithelial cells〔J〕. World J Emerg Med,2013;4:133-7.
15Nakajima K,Goto Y.Differentiation of the anti-shock effect of ulinastatin from steroid hormone,by the continuous observation of microcirculation dynamics〔J〕.Circ Shock,1992;36:284-9.
16Onumata O,Takahashi T,Sato K,etal.Effects of ulinastatin on hypotension and hepatic circulation in brain dead rabbits〔J〕.Transplant Proc,2000;32:2290-2.
17Li W,Wu X,Yan F,etal.Effects of pulmonary artery perfusion with urinary trypsin inhibitor as a lung protective strategy under hypothermic low-flow cardiopulmonary bypass in aninfant piglet model〔J〕.Perfusion,2013;29(12):2218-9.
18姜晓芬,池胜英,金烈烈,等.乌司他丁对体外循环中内皮细胞的保护作用〔J〕.中国体外循环杂志,2004;2(2) :81-3.
