改良液氮冻伤法建立易损动脉粥样硬化斑块模型
2014-09-13王双双王丽丽杨升华孔根现蒋知新
王双双 王丽丽 杨升华 孔根现 蒋知新
(南方医科大学研究生学院,广东 广州 510515)
在前期工作中,本课题组通过液氮冻伤术结合高脂饮食喂养成功创建了一种操作简单、动物死亡率低、成模满意的与人类斑块相似的动脉粥样硬化(AS)易损/破裂斑块(VP)及血栓模型〔1〕。但在后期实验中发现,该方法高脂饮食饲养时间长(10~12 w达到肉眼明显斑块),易造成动物疾病与死亡。本实验中,对该造模方法进行改良,进一步缩短成模时间,以降低饲养成本。
1 材料和方法
1.1实验动物 SPF级雄性新西兰大白兔24只,体重2.25~2.5 kg,由北京绿洲动物中心提供〔许可证号:SCXK(京)2009-0013〕。
1.2试剂与仪器 高敏C反应蛋白(hs-CRP)酶联管免疫吸附(ELISA)试剂盒购自上海蓝基科技有限公司;基质金属蛋白酶(MMP)-1单克隆抗体及SP超敏试剂盒购自北京冰达生物科技有限公司;高脂饲料(含1% 胆固醇、3%大油、15% 蛋黄和81% 普通饲料)购自北京科澳协力饲料有限公司〔许可证号: SCXK(京)2005- 0007〕;全自动生化分析仪DXC800购自美国贝克曼公司。
1.3方法
1.3.1兔颈动脉内膜液氮冻伤术 参照文献〔1〕,兔耳缘静脉注射3%戊巴比妥钠(30 mg/kg)麻醉,无菌条件下作颈正中切口,分离右颈总动脉,两端以动脉夹阻断血流,24号静脉留置针45倾斜刺入右颈总动脉,刺入后抽出针芯,生理盐水冲洗置换出血管内的血液后抽空血管腔。无菌注射器抽取液氮快速注入右颈总动脉,重复3~5次,每次向外抽出少量静脉留置针管以更换冻伤部位,历时约3 min以造成血管内皮冻伤,放开动脉夹恢复血流,压迫止血,3 d内常规使用抗生素预防感染。
1.3.2动物分组与喂养 24只兔以普通饲料适应性喂养3 d,随机分为两组:改良方法组(A组)和传统方法组(B组)各12只。A 组兔首先高脂饲料喂养1 d,然后实施右颈总动脉内膜液氮冻伤术,术后高脂饲料继续喂养;B 组兔子首先进行液氮冻伤术然后给予高脂饲料继续喂养。6 w末每组各随机取4只兔子颈动脉观察斑块形成情况(A1组及B1组)。A组剩余动物(A2组)给予液氮激发术。B组剩余动物(B2组)继续高脂饲料喂养至10 w末,并给予液氮激发术。液氮激发术后48 h处死所有兔子,留取双侧颈动脉血管。所有兔子均自由饮水,按清洁级动物单笼喂养。
1.3.3血液生化检测 分别于高脂喂养0、3 d、1、2、4、6及10 w耳缘抽取空腹静脉血2 ml,并于二次液氮激发术前后经耳缘静脉抽取空腹血2 ml,离心取上清液,于-80℃冰箱内保存待测,部分用于检测甘油三酯(TG) 、总胆固醇(TC)和低密度脂蛋白(LDL)水平,部分采用ELISA法检测兔血清hs-CRP水平。
1.3.4病理形态学观察 以过量戊巴比妥钠处死兔子,取出右侧颈总动脉约3.0 cm,纵行剖开,生理盐水轻轻冲洗干净后,观察斑块大小及斑块破裂及血栓形成情况。以10%中性福尔马林溶液固定48 h,常规石蜡包埋,血管横截面作4 μm 连续切片,分别做HE染色及免疫组织化学染色,光镜观察斑块的组织结构及斑块部位MMP-1蛋白的局部表达情况。免疫组化采用SP法,DAB 显色,棕黄色颗粒状产物为阳性标记,并设阴性对照(以PBS 代替一抗),具体步骤参照试剂盒说明书进行。
1.4统计学方法 采用SPSS13.0 软件进行方差分析。
2 结 果
2.1一般情况 B组3只动物出现下肢坏疽,其中1只治疗后坏疽得到控制,2只死亡;一只出现耳螨,治疗后好转;共22只兔子完成实验。
2.2血脂变化 高脂饲料喂养3 d后TG、TC及LDL均出现明显增高,第1周内升高幅度最大,第2~10周血脂缓慢增高。与基线血脂水平相比,高脂饲料喂养后3 d、1、2、4、6及10 w的血清TG、TC及LDL均有明显升高(P<0.05)。见表1。
2.3血清hs-CRP水平变化 与实验前相比,高脂喂养1 w后两组兔血浆hs-CRP即明显升高,至激发前进一步升高,激发后hs-CRP较激发前明显升高(P<0.05)。各时间点两组间比较无显著性差异(P>0.05)。见表2。
2.4病理形态学观察
2.4.1肉眼大体观察 B1组兔右颈总动脉轻度僵硬,未见明显串珠样改变,管腔内膜较光滑,肉眼见少量脂样物质沉积,但无明显斑块样隆起。A组及B2组兔右颈总动脉管壁明显僵硬,粗细不均,呈串珠样突出外膜,内膜面见大量黄白色脂样物质向管腔突出,并连成片状。
2.4.2光镜观察 图1可见,A1组可见血管壁内明显向管腔内突出的斑块形成。内皮细胞较完整,斑块内含有大量的泡沫细胞和平滑肌细胞,中膜明显萎缩,平滑肌细胞排列紊乱,呈典型的成熟AS斑块。B1组兔颈总动脉内皮细胞较完整,血管内膜轻度增生,内膜可见少量脂质沉积,少部分内膜可见突出斑块,但斑块面积明显小于A1组。A2组及B2组可见血管内膜脱落,斑块脂质核心较大(或坏死),有大量炎症细胞(如巨噬细胞和淋巴细胞等)浸润,细胞外基质较少,纤维帽较薄。
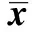
表1 高脂饲料喂养后不同时间血脂变化(mmol/L,±s)

图1 各组不同时期颈动脉斑块形态(HE,×100)
2.4.3免疫组织化学检测 A1组及B1组斑块处有MMP-1的局部表达,而A2组及B2组斑块处均有MMP-1蛋白的大量表达。其中MMP-1阳性细胞主要位于斑块纤维帽及肩部,斑块内部也有其大量表达(图2)。
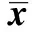
表2 不同时间点血清hs-CRP的变化(ng/ml,±s)
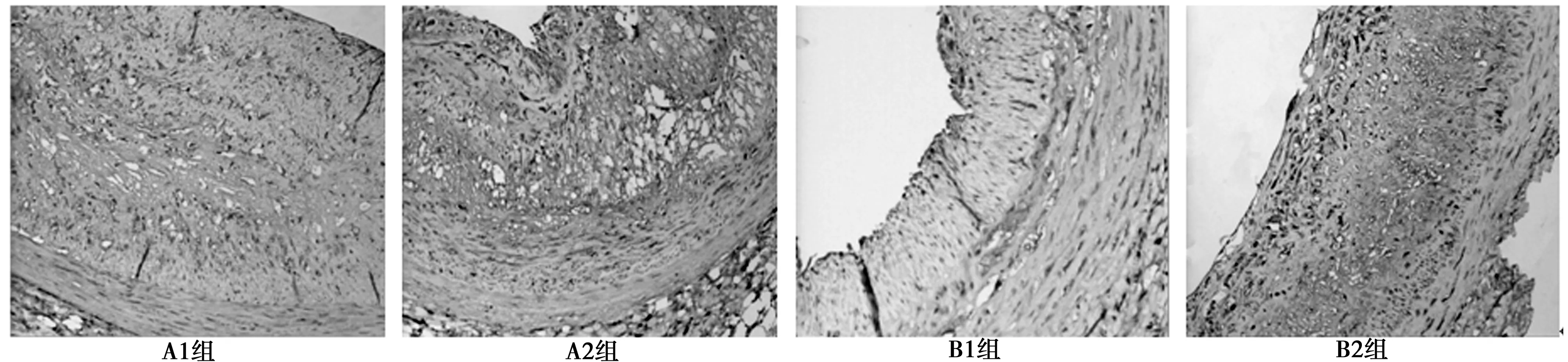
图2 各组颈动脉斑块MMP1的表达水平(免疫组化法,×100)
3 讨 论
AS斑块的破裂和继发血栓形成是急性心血管事件的主要病因〔2〕。VP的早期识别和干预对于急性心血管事件的预防具有十分重要的意义。
本实验结果提示,A1组的动物在高脂饮食6 w即已形成明显颈动脉斑块,内膜大量黄色脂质物沉积,病理观察呈典型的成熟动脉粥样硬化斑块。B1组高脂饮食6 w时可见颈动脉内膜有少量脂质物沉积,病理切片见血管内粥样斑块面积较小。其出现明显差别的原因可能为A1组液氮冻伤损伤血管内膜前动物体内血脂已经达到较高水平,其中TC、LDL升高达基线水平的10余倍,血管局部可能已有脂质沉积。液氮冻伤后,损伤的内皮细胞释放大量细胞因子和趋化因子,招募单核-巨噬细胞在局部聚集吞噬大量脂质形成泡沫细胞。进一步放大局部炎性及吞噬反应,促使AS斑块形成。而在实验中观察到B1组动物液氮冻伤后3 d内进食量减少(考虑与颈部伤口疼痛及饲料更换有关),血脂水平无法迅速升高,而血管内膜损伤后可自我修复,致使内膜损伤和损伤处脂质沉积过程不同步,可能致使斑块形成速度较慢。但是B2组动物证明,延长高脂饮食时间也可导致AS斑块形成。研究表明单纯的高脂饲料喂养也可导致动物体内炎性因子如C反应蛋白(CRP)、肿瘤坏死因子(TNF)-α等增加〔3〕,本实验也验证了这种结果。炎性因子的增加可损伤血管内皮细胞。A组先给予高脂喂养,不但更有利于液氮冻伤术后血管内膜损伤处脂质沉积;也可使体内炎性因子增加,放大并延续液氮损伤术对内膜的损伤作用,使脂质沉积加快,更易形成斑块内较大的脂质核心,有利于不稳定斑块模型的制作。另外,改良方法造模时间相对较短,血管平滑肌分泌胶原含量相对较少,斑块纤维帽相对较薄,更利于制作不稳定斑块模型。而适当缩短高脂喂养时间也可避免斑块过大,使其更接近不稳定斑块的形态和结构。
斑块内炎症是引起斑块不稳定的关键因素〔4〕。本实验结果提示,二次液氮冻伤后,由于内皮损伤、斑块破裂,导致斑块内大量炎性细胞通过黏附分子和化学趋化因子被募集到斑块中并且在氧化脂质、细胞因子等作用下被激活,合成分泌大量的炎性因子(如白细胞介素类,TNF-α)和基质金属蛋白酶(MMPs),前者促进炎症反应,后者主要降解细胞外基质,使斑块内胶原、弹性蛋白含量较少,从而增加斑块的不稳定性〔5〕。国内外研究表明MMP-1与AS斑块破裂之间存在明显的正相关关系,即MMP-1含量越高之处,斑块越易破裂〔6〕。本实验结果提示改良方法传统方法制作的VP与人体内易损斑块MMP-1的变化趋势相同。
另外,在液氮冻伤术采用的器械方面,本实验也进行了调整。前期试验采用1 ml针头刺入血管进行液氮冻伤操作,在二次液氮激发术时,由于血管内已经形成较大斑块,针头刺入后极易损伤斑块,造成斑块器械性破坏,损伤标本。本实验采用24号静脉留置针,虽然针孔较大,需更长时间的按压止血,但是血管内斑块不易被损伤,保证了二次液氮冻伤激发斑块破裂的可靠性。
4 参考文献
1Fang SM,Zhang QH,Jiang ZX. Developing a novel rabbit model of atherosclerotic plaque rupture and thrombosis by cold-induced endothelial injury〔J〕.J Biomed Sci,2009;16(1):39.
2Kumar A,Kar S,Fay WP. Thrombosis,physical activity,and acute coronary syndromes〔J〕.J Appl Physiol,2011;111(2):599-605.
3Aragno M,Meineri G,Vercellinatto I,etal.Cardiac impairment in rabbits fed a high-fat diet is counteracted by dehydroepiandrosterone supplementation〔J〕.Life Sci,2009;85(1-2):77-84.
4Imanishi T,Akasaka T. Novel strategies to target inflammatory processes in atherosclerosis〔J〕.Curr Pharm Des,2013;19(9):1616-25.
5Morgan AR,Rerkasem K,Gallagher PJ,etal.Differences in matrix metalloproteinase-1 and matrix metalloproteinase-12 transcript levels among carotid atherosclerotic plaques with different histopathological characteristics〔J〕.Stroke,2004;35(6):1310-5.
6Fiotti N,Moretti ME,Bussani R,etal.Features of vulnerable plaques and clinical outcome of UA/NSTEMI: Relationship with matrix metalloproteinase functional polymorphisms〔J〕.Atherosclerosis,2011;215(1):153-9.
