脂蛋白(a)与老年退行性心脏瓣膜病的关系
2014-09-13张健瑜黄裕立许顶立
张健瑜 黄裕立 苏 亮 许顶立
(南方医科大学南方医院心内科,广东 广州 510515)
心脏瓣膜钙化性疾病可导致心脏血流动力学紊乱,诱发严重心血管系统并发症,是老年心血管疾病致死的重要原因之一。本研究探讨影响老年瓣膜退行性变的相关因素以及脂蛋白(a) 〔Lp(a)〕与退行性瓣膜病的关系。
1 资料与方法
1.1一般资料 随机选取佛山市第一人民医院心血管内科2012年6月至2013年7月住院的老年及老年前期病人253例,年龄45~93〔平均(71.38±9.29)〕岁,男144例,女108例。排除标准:(1)先前明确诊断为风心病伴心瓣膜病变者;(2)有先天性心瓣膜畸形者;(3)感染性心内膜炎所致的瓣膜病变者;(4)合并恶性肿瘤者;(5)胸部经放射性治疗者;(6)合并免疫性疾病患者;(7)慢性血液透析患者;(8)梅毒患者。住院过程中记录其冠心病、高血压、糖尿病及吸烟史。按年龄分为老年前期组(45~59岁)与老年人组(60~93岁)。按超声心动图结果分为瓣膜钙化组与非瓣膜钙化组。
1.2Lp(a)及其他血脂测定 受检者均抽取空腹静脉血, 使用仪器奥林巴斯AU5400系列全自动生化分析仪测出各指标数值,其中Lp(a)采用免疫投射比浊法检测。
1.3超声心动图检查 所有病例均进行了完整的超声心动图检查,包括二维、M型和多普勒超声心动图。仪器:Aeuson Sequoia C256(探头频率为2.0~3.5 MHz)、Acuson Sequoia C512(探头频率为2.0~3.5 MHz)及Philip IE33(s5.1探头,频率为1~5 MHz)超声仪。瓣膜钙化诊断标准:瓣膜或瓣环局限性增厚、回声增强,瓣叶活动受限,开放幅度减少。
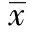
2 结 果
2.1瓣膜钙化的分布特点 钙化组111例患者中,单纯主动脉瓣钙化发生率最高,共检出91例(81.98%),其次是主动脉瓣合并二尖瓣钙化17例(15.32%),单纯二尖瓣钙化3例(2.7%),未检出三尖瓣和肺动脉瓣钙化病变。
2.2钙化瓣膜功能障碍情况 钙化组111例患者中,无瓣膜功能障碍26例(23.42%);单纯瓣膜关闭不全69例(62.16%),所占比例最高;狭窄合并关闭不全12例(10.81%);单纯狭窄4例(3.60%),所有狭窄的病例均为主动脉瓣钙化病例,二尖瓣钙化的病例中未发现有二尖瓣狭窄。
2.3瓣膜钙化组与无瓣膜钙化组临床与生化指标的单因素比较 瓣膜钙化组与无瓣膜钙化组两组间的性别、冠心病、高血压、糖尿病、吸烟、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)无显著差异(P>0.05),两组间的Lp(a)差异有显著性(P=0.018),两组间的年龄差异有显著性(P=0.002)。见表1。
2.4按年龄分层比较两组间Lp(a) 老年组与非老年组间Lp(a)无差异;老年组中瓣膜钙化组的Lp(a)水平显著高于非瓣膜钙化组(P=0.025);非老年组间Lpa(a)无统计学差异(P=0.338)。见表1。
2.5二分类多自变量Logistic回归分析 年龄与Lpa(a)是瓣膜钙化的独立危险因素。

表1 瓣膜钙化组与非瓣膜钙化组比较±s)
3 讨 论
退行性瓣膜病发病的机制学说很多,但确切机制尙未完全明确,也未达到完全共识〔1〕。有研究显示,老年退行性瓣膜病变的发生有家族聚集性与遗传倾向〔2〕。近年来的研究对瓣膜钙化提出“钙磷代谢异常论”,认为心脏瓣膜的钙化具有与动脉粥样硬化类似的特点,是一个伴有钙化的动脉粥样硬化过程。鉴于钙化是老年钙化性瓣膜病的主要表现,因此,有些学者用微量元素测定法测定了程度不一的钙化瓣膜中钙、磷及镁的含量,结果发现,钙化瓣膜中的钙主要以非晶形的磷酸氢钙形式沉积在瓣膜上,并随钙化的严重程度而增高〔3〕。有研究显示年龄因素是心脏瓣膜钙化的独立危险因素。本研究的结果与此一致。其主要原因可能是由于老年人维生素D缺乏,甲状旁腺激素分泌增加,引起钙离子从骨组织向软组织迁移,使细胞内钙增加所致。
目前已公认Lp(a)是动脉粥样硬化疾病的独立危险因素。Lpo(a)的遗传性状主要由载脂蛋白Apo(a)基因决定,该基因位于人第6 号染色体长臂2 区6 带至7 带(6q26-27),与纤维蛋白溶解酶原(PLG)基因紧密连锁,所以两者有着高度的同源性。Apo(a)基因具有遗传多态性,由此产生不同分子量表型,其多态性主要由Apo(a)基因中KringleⅣ2段结构重复数目的不同而引起。人群中血浆Lp(a)的浓度变化范围高达1 000倍,从<0.1 mg/dl至>100 mg/dl,这种差异主要是由Lp(a) 基因的多态性决定的。Lp(a)的血浆浓度在正常个体的一生中相当稳定,受年龄、性别、饮食及物理因素影响非常小,但个体之间水平差异性较大,主要由遗传因素决定〔4,5〕。Lp(a)基因的变异会影响Lp(a)的水平。Lp(a)的升高及其基因的变异会增加主动脉瓣钙化的风险,但该结果未在所有不同种族的人群中得到证实〔6〕。在本研究中,证实老年人中瓣膜钙化组Lp(a)水平明显高于非瓣膜钙化组,Logistic回归分析结果也显示Lp(a)是瓣膜退行性变的危险因素。
Lp(a)在致瓣膜退行性变的机制是否与致动脉粥样硬化性疾病相类似从而使瓣膜纤维层脂质聚集、胶原纤维和弹性纤维聚集,纤维层增厚及钙质沉积还有待以后的研究进一步明确。Lp(a)在人群中呈明显的偏态分布,主要与遗传因素决定。在不同的人群中Lp(a)的血浆水平也有差异。本研究结果显示在瓣膜退行的患者中Lp(a)升高间接支持了发病机制中的遗传学说,提示退行性瓣膜病变的发生可能与遗传相关。但在非老年组中瓣膜钙化组与对照组间Lp(a)无统计差异,Lp(a)在非老年人瓣膜钙化过程中是否有作用还待以后进一步扩大样本量研究。
既往曾认为钙化性心瓣膜病是一种退行性变,是不可修复的,但随着对此病认识的提高及病理组织学的观察,发现它也伴随炎性细胞的参与及脂质浸润。动物实验表明,高TC血症可以使心瓣膜变厚,内皮细胞下损伤,钙沉积,而降低TC可使退行性瓣膜病改善〔7〕。而在人钙化的瓣膜中发现了氧化的LDL〔8〕。故有学者认为高脂血症可以引起瓣膜钙化的过程〔9〕。由于研究显示炎症及血脂均可能参与了动脉粥样硬化及瓣膜退行性变,因此有学者尝试用他汀类调脂药来降低血浆LDL,观察是否能延缓退行性瓣膜病变的进程,但都并没有得到满意的结果〔10~12〕。由此推测虽然动脉粥样硬化及瓣膜退行性变有相似的致病背景,但却由于不同因素(机械应力,遗传因素,炎症细胞和钙化介质)间的相互作用各有其独特的演化过程。
综上所述,本研究中证实了年龄及Lp(a)与心脏瓣膜钙化病变有关,Lp(a)水平的变化是否因基因变异所致及其基因变异在中国人群中对心脏瓣膜退行性变的作用有待日后的研究。
4 参考文献
1张怀勤.老年性退行性心脏瓣膜病研究近况〔J〕.心脑血管病防治,2011;11(4):257-8.
2Probst V,Le Scouamec S,Legendre A,etal.Familial aggregation of calcific aortic valve stenosis in the western part of France〔J〕.Circulation,2006;113(6):856-60.
3Adler Y,Levinger U,Koren A,etal.Relation of nonobstructive aortic valve calcium to carotid arterial atherosclerosis〔J〕.Am J Cardiol,2000;86(10):1102-5.
4马依彤.心脏标志物临床应用进展〔M〕.北京:人民卫生出版社,2009:446-9.
5张晓蕾.脂蛋白(a)与动脉粥样硬化关系研究进展〔J〕.科技视界,2013;(33):382-3.
6Kamstrup PR,Tvbiaerq-Hansen A,Nordestgaard BG.Elevated Lipoprotein(a) and risk of aortic valve stenosis in the general population〔J〕.J Am Coll Cardiol,2014;63(5):470-7.
7Rajamannan NM,Subramaniam M,Caira F,etal.Atorvastatinin inhibits hypercholesterolemia induced calcification in the aortic valves via the Lrp5 receptor pathway〔J〕.Circulation,2005;112(9):1229-34.
8Olsson M,Thyberg J,Nilsson J.Presence of oxidized low density lipoprotein in nonrheumatic stenotic aortic valves〔J〕.Arterioscler Thromb Vasc Biol,1999;19(5):1218-22.
9Stritzke J,Unsel-Nitschke P,Markus MR,etal.Association between degenemtive aonic valve disease and loog-term exposure to cardiovascular risk factors:results of the longitudinal population-based KORA/MONICA survey〔J〕.Eur Heart J,2009;30(16):2044-53.
10Cowell SJ,Newby DE,Prescott RJ,etal.A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis〔J〕.N Engl J Med,2005;352(23):2389-97.
11Chan KL,Teo K,Dumesnil JG,etal.Effect of Lipid lowering with rosuvastatin on progression of aortic stenosis:results of the aortic stenosis progression observation:measuring effects of rosuvastatin (ASTRONOMER) trial 〔J〕.Circulation,2010;121(2):306-14.
12Novo G,Faio G,Viscontic C,etal.Atherosclerosis,degenerative aortic stenosis and statins〔J〕.Curr Drug Targets,2011;12(1):115-21.
