大肠侧向发育型肿瘤患者疾病特征及内镜诊断和治疗价值
2014-09-13闫振坤张金萍李长锋
闫振坤 李 颖 张金萍 孙 旭 李长锋
(吉林大学中日联谊医院内镜中心,吉林 长春 130033)
大肠侧向发育型肿瘤(LST) 是指肿瘤直径大于10 mm,而且呈侧向扩展而不是垂直上下生长的大肠表浅型病变〔1,2〕,诊断较困难。本研究探讨LST的疾病特征及内镜诊治的意义。
1 材料与方法
1.1病例 我中心2011年1月至2012年1月LST患者105例,男65例,女40例,年龄34~79〔平均(59.9±10.2)〕岁。根据病情分为内镜下黏膜切除术(EMR)组53例、内镜下黏膜分片切除术(EPMR)组44例、内镜下黏膜剥离术(ESD)组8例。
1.2材料 日本Olymlpus公司CF-Q260AZI和CF-260AI电子肠镜,ME系统和 NBI 放大系统,Olympus 主机,Olympus 公司PSD-30 型高频电发生器,Olympus 公司一次性电圈套器,SD-16U-1 型Olympus EMR 专用带针电圈套器,MAJ-254型尼龙绳圈(直径30 mm),Olympus公司的HX-110QR 型和HX-110UR 型夹子装置本体,Olympus公司的各种型号钛夹〔3〕,热活检钳,HX-6UR-1夹子推送器与止血夹子,KD-611L 型IT刀,OLYMPUS SZX9-31实体显微镜。
1.3内镜检查 术前准备后行大肠镜检查,内镜下检查发现病变或者可疑病变后,充分显露病灶,采用0.4%靛胭脂染色黏膜,以观察病灶类型,并用放大内镜观察,确定病变腺管开口分型后再进一步行充吸气,从而适当掌握病灶侵犯深度。
1.4病理组织学检查 术后标本送病理科组织学检查确诊。
1.5统计学方法 采用SPSS13.0软件进行χ2检验。
2 结 果
2.1LST大体分型与腺管开口,病理分型 颗粒均一型和结节混合型均以Ⅳ型开口为主,扁平隆起型以ⅢL型开口为主,假凹陷型以ⅤA型为主。不同大体分型之间腺管开口情况有统计学差异(χ2=64.951,P<0.001)。颗粒均一型和结节混合型均以绒毛状腺瘤为主,扁平隆起型以管状绒毛状腺瘤为主,假凹陷型以黏膜内癌为主。不同大体分型之间病理分型情况有统计学差异(χ2=52.611,P<0.001)。见表1。ⅢL型腺管开口以管状腺瘤为主,Ⅳ型开口以绒毛状腺瘤为主,ⅤA型则全为黏膜内癌。不同病理分型之间腺管开口情况有统计学差异(χ2=102.703,P<0.001)。见表2。
2.2颗粒型LST(LST-G)与非颗粒型LST(LST-NG)分布特征 LST-G较LST-NG更易出现于直肠(P<0.05);LST-G开口多为Ⅳ型,而LST-NG多为ⅢL型(P<0.001);LST-G以绒毛状腺瘤为主,而LST-NG以管状绒毛状腺瘤为主(P<0.001)。见表3。
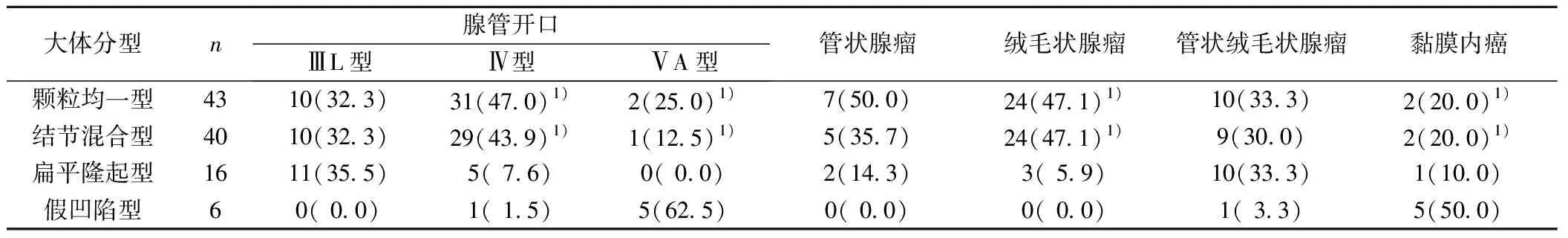
表1 LST大体分型与腺管开口、病理分型〔n(%)〕
2.33种术式比较 ESD组均分布在直肠,而EMR组和EPMR组主要分布于直肠和结肠(P=0.002);ESD和EPMR治疗组直径较大,而EMR组较小(P<0.001)。ESD组和EPMR组直径均>20 mm,而EMR组相对较小(P<0.001),见表4。
2.4术中、术后并发症比较 术中出现即刻出血者2例(1.9%),即刻电凝止血后上钛夹未再出血。术后3 d迟发出血6例(5.7%)。出现术中或术后出血者,经内镜下注射1∶10 000肾上腺素和采用金属钛夹,内科输注止血药及加用抗生素保守治疗后,均成功止血。未采用输血治疗,无术后感染出现,无肠穿孔并发症发生。

表2 LST腺管开口与病理分型〔n(%)〕
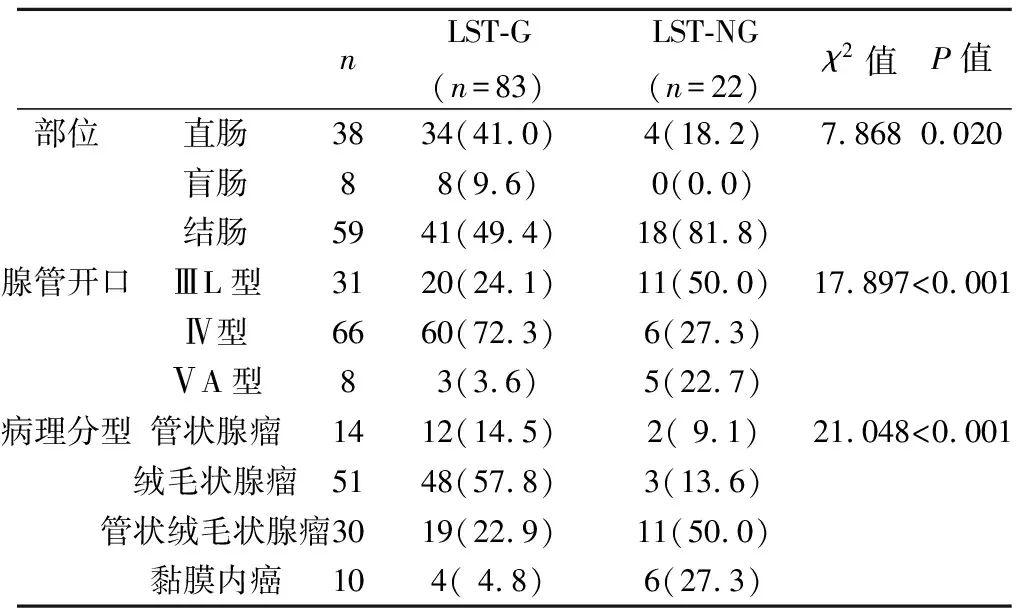
表3 LST-G与LST-NG定性资料比较〔n(%)〕
2.5随访结果 术后3、6及12个月各复查肠镜1次。创面愈合较好,创口呈红或白色瘢痕、部分愈合较好创口不见瘢痕,随访期内无复发或再发。无溃疡、出血、穿孔、狭窄等。
3 讨 论
病变是否为肿瘤性,主要依赖于对腺管开口的判断。根据Kudo的腺管开口分类法〔4〕,可将LST表面结构形态分为I型、Ⅱ型、ⅢL、Ⅲs、Ⅳ型、Ⅴ型等类型。许秋泳等〔5〕研究中,Ⅳ型腺管开口19个(61.3%),与本文结果相似。在肿瘤性病变中,ⅢL型腺管开口以管状腺瘤和管状绒毛腺瘤为主,Ⅳ型开口以绒毛状腺瘤更多见〔6〕。还有文献报道〔7〕,V型腺管开口没有规则的形态,腺管开口无序、紊乱,且一旦发现开口不规则或不对称改变等Ⅴ型腺管开口征象时,提示极易出现黏膜内癌。
颗粒均一型和结节混合型均以绒毛状腺瘤为主,扁平隆起型以管状绒毛状腺瘤为主。但不同文献〔8〕报道各不相同,而假凹陷型以黏膜内癌为主,这可能是由于假凹陷型形态学上与凹陷型肿瘤相似,而有研究〔9〕认为凹陷型肿瘤具有黏膜肌层较薄这一特点,因此癌细胞极易穿过黏膜肌层浸润到黏膜下层。LST-G较LST-NG更易出现于直肠,这与文献报道相似〔10〕。
EMR适用于直径小于20 mm的病变,在病变周边将注射针刺入黏膜下层,然后注入无菌生理盐水注射液,注入的剂量当以将病变黏膜完全形成隆起并与黏膜下层分离为宜,最好是将病变位于隆起的最顶端。然后将圈套器的开口完全置于病变隆起的黏膜周边并压紧,轻轻抽气让病变周围的一部分正常黏膜也一同套入到圈套器内,适当收紧圈套器,当感觉有一定的抵抗感后,用高频电发生器选择电切电流。EPMR适用于直径超过20 mm的平坦型病变,按照EMR方法于病变边缘选择1~2点进行注射,每点注射生理盐水5~10 ml,使病变完全隆起并与黏膜下分离,然后用带钩圈套器分多次套取病变,分次切除,最后完整切除病变。ESD在病变范围外0.5 cm的位置,用针状刀做一个环状标记,并在标记外0.5 cm黏膜下层的深度注射适当无菌生理盐水,使病灶周围完全隆起,再用针状刀沿病灶周围环状切开,使正常黏膜与病灶周围分离,肿瘤四周被充分切开后,如果肿瘤较小,有时可使用圈套器剥离切除病灶;但如果肿瘤较大时,病变被充分抬举后,利用IT-Knife或flex-knife进行黏膜下剥离。
ESD操作时间明显延长,难度较大,较容易引起严重并发症;另外器械要求较高,同时要求医师经过严格的技术培训以降低操作风险,其经济成本也相对较高。目前,行ESD治疗结直肠病变,缺乏统一的操作规范和指南,其对消化道病变的治疗效果仍需要循证医学研究的证实。直肠不易穿孔,更容易进行ESD治疗。ESD和EPMR组LST直径较大,而EMR组直径较小,结果与文献报道相似〔11〕。这是因为EPMR采用分片多次切除,ESD采用整片剥离,适合较大的LST病变。而对于大病变,EMR圈套器无法一次性完整切除,故EMR只适合较小的LST病变。对于较大的LST病变,需要使用EPMR和ESD,EPMR适合容易穿孔的结肠、盲肠病变治疗,但容易残留病变,导致复发;而ESD采取整片切除,能够解决传统 EMR 切除时病变残留和复发的问题,但其手术时间长,术后并发症的发生风险高。因此,对于LST患者,特别是巨大的LST病变,采取何种治疗方法,应进行周全的考虑〔12〕。
4 参考文献
1Kudo S.Early colorectal cancer〔M〕.Tokyo:Igaku-shoin,2006:2-67.
2杜林枫,蒋 军,刘 娟.色素内镜联合内镜黏膜切除术诊治结直肠侧向发育型肿瘤的临床研究〔J〕.胃肠病学,2013;18(1):43-4.
3Kudo S,Hirota Y,Nakajima T,etal.Colorectal tumours and pit pattern〔J〕.Clin Pathol,1994;47(10):880.
4刘宇虎,柳 娟,陈桂权.结直肠侧向发育型肿瘤内镜诊断与治疗〔J〕.现代消化及介入诊疗,2012;17(5):264-7.
5许秋泳, 许向农, 陈俊杰. 大肠侧向发育型肿瘤内镜下的诊断及治疗〔J〕. 临床研究,2009;3(4):5-9.
6Kudo S,Tamura S,Nakajima T,etal.Diagnosis of colorectal tumorous lesions by magnifying endoscopy〔J〕.Gastrointest Endosc,1996;44(1):8-14.
7姜 泊,刘思德,智发朝,等.染色内镜和放大内镜诊治大肠侧向发育型肿瘤〔J〕.中华消化内镜杂志,2006;23(3):203-5.
8Kudo S,Kashida H,Tamura T,etal.Endoscopic diagnosis and treatment of early colorectal cancer〔J〕.World J Surg,1997;21:694-701.
9赵晓晏,付兰英,王 雷,等.内镜黏膜剥离术治疗41例大肠侧向发育型肿瘤的疗效分析〔J〕.第三军医大学学报,2012;21(12):2200-3.
10朱 浩,孙明军.大肠侧向发育型肿瘤内镜下的诊断与治疗〔J〕.临床消化病杂志,2011;6(4): 343-6.
11Kaku E,Oda Y,Murakami Y,etal.Proportion of flat-and-depressed-type and laterally spreading tumor among advanced colorectal neoplasia〔J〕.Clin Gastrornterol Hepatol,2011;9:503-8.
12袁 珂,吴俊超. 大肠侧向发育型肿瘤的内镜形态及内镜下治疗〔J〕. 基层医学论坛,2013;16(10):2049-51.
