巨大儿胎盘组织中HO- 1、IGF- 1的变化及其意义
2014-09-12李真真魏碧蓉薛海燕娄伟
李真真,魏碧蓉,薛海燕,娄伟
(莆田学院医学院,福建 莆田 351100)
巨大儿是指出生体重≥4 000 g的活产新生儿[1]。妊娠糖尿病(gestational diabetes mellitus,GDM)是巨大儿最常见的原因。巨大儿的具体发生机制尚不明确,近年来,多种调控胎儿生长过度的细胞因子被陆续发现和证实。血红素氧合酶- 1(heme oxygenase- 1,HO- 1)亦称热休克蛋白32(heat shock protein,HSP32),广泛分布于胎盘绒毛组织中,在多种因素刺激下能保护胎盘组织细胞,增加子宫胎盘的血流灌注,以保证胎儿在宫内有足够的营养供应。研究[2]证实,胰岛素样生长因子- 1(insulin- like growth factor- 1,IGF- 1)与胎儿及生后早期的促生长相关,是导致巨大儿的重要物质之一。HO- 1与IGF- 1在胎盘组织均有表达[3- 4],推测胎盘中两者的表达状态及其水平与巨大儿的发生有关。本研究通过观察巨大儿胎盘组织中HO- 1、IGF- 1的改变情况,探讨HO- 1与IGF- 1的相互关系,为深入了解它们在巨大儿发生中的作用提供依据。
1 对象与方法
1.1 研究对象
随机选择我院附属医院妇产科2012年5月至9月出生的新生儿60例,其中12例确诊为GDM[5]母亲分娩的巨大儿(巨大儿A组),18例为健康孕妇分娩的巨大儿(巨大儿B组),新生儿出生体重均≥4 000 g;将30例健康孕妇同期分娩的正常出生体重(2 500~4 000 g)新生儿作为对照组。3组研究对象均为足月单胎,胎龄37~42周,无宫内感染、窒息史及先天畸形,系自然分娩或剖宫产(均因胎位、社会因素或符合巨大儿剖宫产指征)。所有产妇无高血压、心脏病、肝病等疾病;无胎盘、脐带等异常。
巨大儿A组中男7例(58.33%),女5例(41.67%);自然分娩2例(16.67%),剖宫产10例(83.33%);平均出生体重为(4 412.50±303.86) g。巨大儿B组中男6例(33.33%),女12例(66.67%);自然分娩7例(38.89%),剖宫产11例(61.11%);平均出生体重为(4 109.44±94.90) g。对照组中男11例(36.67%),女19例(63.33%);自然分娩25例(83.33%),剖宫产5例(16.67%);平均出生体重(3 386.67±127.94) g。3组产妇的年龄、孕周有可比性。
1.2 研究方法
1.2.1 胎盘组织的采集
胎儿及胎盘娩出后立即检查脐带及胎盘有无异常,无菌操作下于胎盘中间带取1 cm×1 cm×1 cm大小的组织:包括绒毛膜板胎盘的全厚度胎盘组织,用无菌生理盐水漂洗后吸干水分,一部分固定于10%的甲醛溶液,用于免疫组化的测定;另一部分立即存放在-80 ℃超低温冰箱中,用于ELISA检测。同时由专人精确测量新生儿体重、胎盘重量等,所有研究对象标本的采集均经产妇知情同意。
1.2.2 检测方法
山羊多克隆HO- 1抗体(SC- 1796)购自美国Santa Cruz公司,SP试剂盒、DAB显色剂购自上海生工公司,人IGF- 1定量酶联免疫试剂盒、人HO- 1酶联免疫试剂盒购自美国DSL公司。
1.2.2.1 免疫组织化学检测 胎盘标本用10%甲醛固定24 h以上,经石蜡包埋切片,分别行常规HE染色及HO- 1、IGF- 1免疫组织化学染色。再于光镜下观察HO- 1及IGF- 1的分布及表达,以细胞内出现棕黄色颗粒为阳性细胞,每张切片随机采集5个视野,参照Karan等[6]的细胞染色强度结合阳性细胞百分比法评分标准进行判断。细胞染色强度以胞浆或胞核出现深棕色颗粒为强阳性记3分,出现淡黄色颗粒为弱阳性记1分,介于两者之间者为中度阳性记2分;记录阳性染色细胞百分数,阳性细胞数≥76%为4分,51%~75%为3分,26%~50%为2分,6%~25%为1分,≤5%为0分。染色强度记分与阳性细胞百分数记分乘积为每个视野得分,每个视野平均值为最后免疫组化积分。
1.2.2.2 ELISA检测 采用双抗体夹心ELISA法。从-80 ℃超低温冰箱中取出胎盘组织标本,研磨、超声波粉碎制成匀浆,离心取上清液。在96孔板上分别包被HO- 1抗体或IGF- 1抗体0.1 ml(含抗体0.1 μg),4 ℃过夜。洗涤后分别加入1∶2~1 000倍比稀释的组织上清液,同时设立空白对照、阴性对照及阳性对照孔,37 ℃孵育1 h。洗涤后分别加入HO- 1抗体或IGF- 1抗体0.1 ml(含抗体0.1 μg),37 ℃孵育1 h,洗涤后加入TMB底物显色。孵育后终止反应,在ELISA检测仪上测各孔浓度。
1.3 统计学处理
2 结 果
2.1 胎盘组织HO- 1、IGF- 1表达比较
见图1、2。
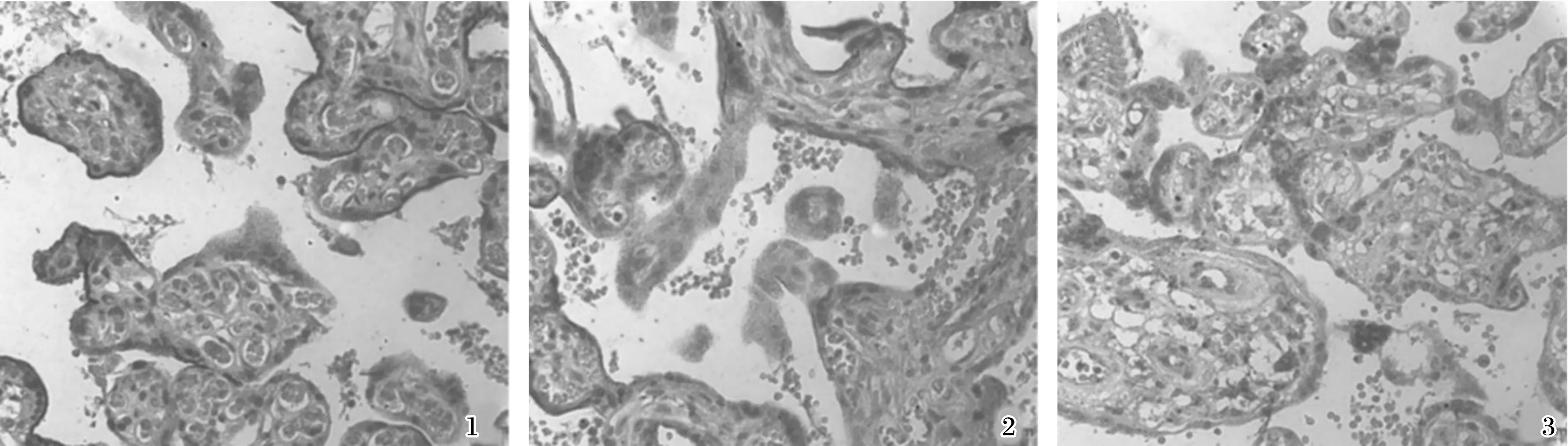
1.巨大儿A组; 2.巨大儿B组; 3.对照组
图1胎盘HO- 1的表达免疫组化染色×400
Fig1Expressionofhemeoxygenase- 1intheplacentasofmacrosomiagroupA(1),macrosomiagroupB(2)andcontrolgroup(3)

1.巨大儿A组; 2.巨大儿B组; 3.对照组
图2胎盘IGF- 1的表达免疫组化染色×400
Fig2Expressionofinsulin-likegrowthfactor- 1intheplacentasofmacrosomiagroupA(1),macrosomiagroupB(2)andcontrolgroup(3)
3组HO- 1、IGF- 1均有不同程度的表达,HO- 1主要定位于胎盘滋养细胞及绒毛间质细胞的胞浆中,血管内皮细胞有少量表达;IGF- 1主要定位于滋养层上皮细胞及部分血管内皮细胞,以细胞膜、细胞浆为主。经方差分析,3组胎盘组织中HO- 1、IGF- 1表达有明显差异(均P<0.05),两两比较结果提示,巨大儿A组及B组HO- 1、IGF- 1表达均明显高于对照组,差异有统计学意义(均P<0.05)。而巨大儿A组与B组HO- 1、IGF- 1比较,差异无统计学意义(均P>0.05)。3组胎盘组织HO- 1、IGF- 1免疫组化积分比较见表1。
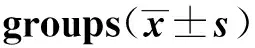
组 别nHO-1积分IGF-1积分巨大儿A组1213.33±4.7212.27±1.61巨大儿B组1811.72±2.9511.89±2.07对照组306.98±3.668.95±3.69F值0.9780.816P值0.0240.043
2.2 胎盘组织中HO- 1、IGF- 1水平比较
胎盘HO- 1、IGF- 1定量分析结果见表2。

Tab 2 Comparison of the enzyme linked immunosorbent assay in the placentas of heme oxygenase- 1,insulin- 1ike growth factor- 1 between the three ng·ml-1
3组新生儿HO- 1、IGF- 1水平差异均有统计学意义,进一步多重比较显示,巨大儿A组和B组HO- 1水平较对照组均明显增高(MD=0.056,P<0.05;MD=0.045,P<0.05),巨大儿A组与B组胎盘HO- 1水平比较,差异无统计学意义(MD=0.010,P>0.05)。巨大儿A组和B组中IGF- 1水平较对照组均明显增高(MD=0.033,P<0.05;MD=0.027,P<0.05),巨大儿A组与B组胎盘IGF- 1水平比较,差异无统计学意义(MD=0.006,P>0.05)。
2.3 胎盘HO- 1与IGF- 1水平的相关性分析
对3组胎盘中HO- 1与IGF- 1水平进行Pearson相关分析,对照组HO- 1与IGF- 1水平无相关性(r=0.284,P=0.095),巨大儿A组、B组HO- 1和IGF- 1的水平呈正相关(r=0.895,P=0.000;r=0.878,P=0.000)。
3 讨 论
血红素氧合酶(heme oxygenase,HO)是催化血红素氧化分解为胆红素、一氧化碳(CO)、Fe2+的起始酶和限速酶,在体内有HO- 1、HO- 2、HO- 33 3种同工酶[7]。其中HO- 1亦称热休克蛋白32(HSP32),分子量约为32 000。人的HO- 1染色体定位于22q12,诱导性表达于机体各组织细胞的微粒体内,血管平滑肌和子宫平滑肌中均有表达[8]。诱导因素包括血红素、缺氧、金属离子、细胞因子以及激素如胰岛素、地塞米松等。现有资料表明,胎盘组织富含HO- 1。Yoshiki等[9]发现,在足月妊娠胎盘HO- 1主要表达于绒毛合体滋养细胞,其次分布于绒毛间质细胞及血管内皮细胞。由于胎盘绒毛滋养细胞和内皮细胞分别与母血、胎血中高浓度血红蛋白接触,血红蛋白和游离血红素均可发生自动氧化而产生超氧化物和其他自由基,而HO一方面能清除血红素及其产生的有害物质,另一方面催化生成很强的抗氧化剂,对胎盘和胎儿组织细胞具有保护作用。本研究用免疫组化方法检测亦显示,HO- 1高水平表达于胎盘滋养细胞及绒毛间质细胞,除了使母体中的营养物质能更好地通过滋养细胞运至脐静脉外,还可能与胎盘血管发育有关,从而维持血管的正常分化发育以及充足的胎盘灌注来保证胎儿健康发育。有研究[4]表明,胎儿宫内发育迟缓(intrauterine growth retardation,IUGR)的产妇胎盘滋养细胞HO- 1表达降低,分解血红素产生内源性CO减少,使胎盘血管收缩,胎儿微血管阻力增加,影响胎盘供血,导致胎儿生长受限。本研究显示,不管是GDM母亲分娩的巨大儿还是健康母亲分娩的巨大儿,胎盘HO- 1的表达均明显高于正常出生体重新生儿。ELISA检测HO- 1水平也得到类似结果。可能是巨大儿在宫内相对缺氧导致胎儿红细胞生成较多,微血管阻力增加,诱导HO- 1表达增加;HO- 1通过促进CO的生成起到舒张血管的作用,有利于胎儿从母体及胎盘获取充足的营养,促进胎儿发育,最终表现为胎儿生长过度。而巨大儿中有相当一部分母亲患妊娠期糖尿病,处于氧化应激状态,胎盘滋养细胞受到母血中高血糖、高胰岛素等刺激,使宫内慢性缺氧环境加剧。在对自发性糖尿病大鼠的研究中发现,HO/CO系统对胰岛细胞及慢性高血糖诱发的氧化性损伤具有保护作用[10]。因此,GDM母亲分娩的巨大儿胎盘HO- 1表达也增加,同时生成胆红素、CO增多,从而增强胎儿抗氧化损伤的能力。
有研究表明,胰岛素是真正的胎儿生长激素,具有IGF- 1受体介导的促进生长的作用[11]。在无糖尿病的产妇中,IGF- 1是导致巨大儿的重要物质。Lauszus等[12]也发现,糖尿病孕妇外周血IGF- 1水平与新生儿出生体重呈正相关。本研究结果显示,在巨大儿胎盘组织中IGF- 1表达强度高,胎盘IGF- 1水平明显高于对照组(P<0.05),均提示胎盘IGF- 1水平增加可能与巨大儿形成密切相关。母体过多的营养物质通过胎盘到达胎儿体内,刺激胎儿B细胞分泌胰岛素量增加,导致高胰岛素血症,同时高血糖可能激活了血糖- 胰岛素- 胰岛素样生长因子轴,胰岛素和IGF- 1的增多共同导致巨大儿的产生[13]。
另外,GDM母亲分娩巨大儿胎盘组织中HO- 1与IGF- 1表达高于健康母亲分娩巨大儿的,但差异均无统计学意义(P>0.05)。这可能与病例数过少有关。HO- 1与IGF- 1是否与其他原因所致巨大儿的发生有关,有待进一步探讨。
Kreiser等[14]发现,妊娠大鼠被转染HO- 1基因后,所分娩的鼠仔的平均体重明显增加,并且随着转染组HO- 1表达的增高,胎盘中血管内皮生长因子(VEGF)、胰岛素样生长因子结合蛋白- 1(IGFBP- 1)及其受体的表达也相应增加,说明HO- 1及其代谢产物不仅能直接增加胎盘血流灌注,还能通过信号传导系统增加胎盘相关生长因子的表达,进一步改善胎盘循环,促进胎儿发育。本研究也初步探讨了胎盘中HO- 1水平与IGF- 1水平的相关性,结果显示两者呈显著正相关(P<0.05)。提示HO- 1水平增高可能通过IGFBP- 1途径,使IGF- 1水平升高,从而参与巨大儿的发生,胎盘HO- 1与IGF- 1在胎儿生长发育过程中发挥了重要作用。
[1] 吴菊芬,白淑芬,王效梅,等.东南大学附属第二医院近10年巨大儿临床资料分析[J].现代医学,2013,41(7):492- 494.
[2] JAKSIC J,MIKULANDRA F,PERISA M,et al.Effect of insulin and insulin- like growth factor Ⅰ on fetal macrosomia in healthy women[J].Coll Antropol,2001,25(2):535- 543.
[3] JONES H N,CROMBLEHOLME T,HABLI M.Adenoviral- mediated placental gene transfer of IGF- 1 corrects placental insufficiency via enhanced placental glucose transport mechanisms[J].PLoS One,2013,8(9):e74632.
[4] 王伊鹏,余艳红.胎儿宫内发育迟缓患者胎盘滋养细胞表面内源性血红素氧化酶的表达[J].第一军医大学学报,2002,22(7):637- 639.
[5] KUZUYA T,NAKAGAWA S,SATOH J,et al.Report of the Committee on the classification and diagnostic criteria of diabetes mellitus[J].Diabetes Res Clin Pract,2002,55(1):65- 85.
[6] KARAN D,CHEN S J,JOHANSSON S L,et al.Dysregulated expression of MIC- 1/PDF in human prostate tumor cells[J].Biochem Biophys Res Commun,2003,305(3):598- 604.
[7] 张涛,白芳云,白飞虎.HO- 1 siRNA表达载体的构建及其稳定转染SGC7901细胞系的建立[J].东南大学学报:医学版,2012,31(5):542- 545.
[8] BAINBRIDGE S A,SMITH G N.HO in pregnancy[J].Free Radic Biol Med,2005,38(8):979- 988.
[9] YOSHIKI N,KUBOTA T,ASO T.Expression and localization of heme oxygenase in human placental villi[J].Biochem Biophys Res Commun,2000,276(3):1136- 1142.
[10] COSSO L,MAINERI E P,TRAVERSO N,et al.Induction of heme oxygenase 1 in liver of spontaneously diabetic rats[J].Free Radic Res,2001,34(2):189- 191.
[11] 王旭,李海浪.GH/IGF- 1促生长轴与特发性中枢性性早熟的治疗[J].东南大学学报:医学版,2006,25(2):125- 129.
[12] LAUSZUS F F,KLEBE J G,FLYVBJERG A.Macrosomia associated with maternal serum insulin- like growth factor- Ⅰ and- Ⅱ in diabetic pregnancy[J].Obstet Gynecol,2001,97(5 Pt 1):734- 741.
[13] 王娜,孙正芸,王合丽,等.妊娠糖尿病母亲新生儿及健康巨大儿血糖、胰岛素和皮质醇水平的变化[J].山东大学学报:医学版,2011,49(6):8- 14.
[14] KREISER D,NGUYEN X,WONG R,et al.Heme oxygenase- 1 modulates fetal growth in the rat[J].Lab Invest,2002,82(6):687- 692.
