戊型肝炎病毒ORF2截短蛋白p154在毕赤酵母中的分泌性表达及其抗原性
2014-09-12徐明杰张建华孟继鸿
徐明杰,张建华,孟继鸿
(东南大学 医学院,江苏 南京 210009)
戊型肝炎(hepatitis E,HE)是由戊型肝炎病毒(hepatitis E virus,HEV)感染引起的常见的消化道传染病。HEV基因组全长约7.2kb,含有3个开放读码框架(ORFs):ORFl、ORF2、ORF3[1]。由ORF2编码的pORF2是一个含有660个氨基酸的糖基化蛋白,分子质量约72kDa,其近羧基末端的区域含有HEV主要的抗原决定簇,是HEV特异性中和性抗原表位的所在区域,可以采用基因工程技术在原核或真核表达系统中表达 ORF2编码蛋白研发重组戊型肝炎疫苗[2- 5]。
酵母表达系统是基因工程研究中最常用的表达系统之一,但目前国内外尚未见应用毕赤酵母表达系统分泌性表达HEV结构蛋白进行疫苗研发的报道。为了探讨戊型肝炎基因工程疫苗生产的新途径,我们利用毕赤酵母表达系统进行了戊型肝炎病毒的截短结构蛋白表达的初步研究。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 大肠杆菌DH5α为东南大学医学院基因诊断与疫苗研发实验室保存。Pichiapastoris菌株GS115、酵母表达载体pPICZαA购自Invitrogen公司。
1.1.2 工具酶和试剂EcoRⅠ、NotⅠ酶购于美国Fermentas 公司;高保真酶购于美国Roche 公司;SacⅠ、T4DNA Ligase 购于大连宝生物工程有限公司;Zeocin购于美国Invitrogen公司;甲醇购于国药集团化学试剂有限公司;酵母抽提物、胰蛋白胨购于英国COXOID公司;HRP- 羊抗小鼠IgG、HRP- 羊抗兔IgG购于美国KPL公司。
1.1.3 引物设计与合成 利用DNASTAR软件系统中的MegAlign Program模块对GenBank中已知的各基因型HEV代表株进行计算机辅助序列分析,在不同基因型HEV保守区合成的一组通用性引物,位于HEV ORF2 区域,能有效地扩增1、2、3、4型HEV的基因片段。JM2:5′- CCGACAGAATTGATTTCGTCG GC- 3′;JM3:5′- TYGTCTCRGCCAATGGCGAGC- 3′;JM35:5′- CGRCAYTCMGGGCARAARTCATC- 3′;JM36:5′- CATYTTAAGRCGCTGMAGCTCAGC- 3′。引物由美国疾病控制和预防中心(CDC)合成,工作浓度10pmol·μl-1。
利用Primer 5.0分别设计上下游寡核苷酸引物,在分泌表达载体pPICZαA上游引物的5′端和下游引物的3′端分别引入酶切位点EcoRⅠ和NotⅠ。上游引物5′- TTTGAATTCATGCCTACCCCCTCGCCTG- 3′,下游引物5′- TTTGCGGCCGCTCAAGAATGAGGTGC- 3′,引物由Invitrogen 上海贸易有限公司合成,工作浓度为10 pmol·μl-1。
1.2 方法
1.2.1 标本采集及病毒RNA提取与RT- PCR鉴定 采集南京市第二医院住院戊型肝炎患者粪便标本进行RT- PCR检测和测序鉴定,并依此为模板扩增ORF2 p154基因。QIAamp 病毒RNA抽提试剂盒(QIAGEN)提取病毒RNA。采用一步法RT- PCR试剂盒(QIAGEN)进行扩增,一步法RT- PCR的反应体系为20μl,包括引物JM2、JM36各0.5μl,One Step RT- PCR 缓冲液4μl,dNTP 0.8μl,一步法酶混合液0.8μl,RNA 10μl,用DEPC水补足至20μl。一步法RT- PCR的扩增条件为:50℃逆转录45min;95℃预变性15min;94℃变性30s,50℃退火30s,72℃复性延伸80s,50个循环;72℃延伸8min。第2轮PCR反应体系为25μl,包括引物JM3和JM35各0.5μl、10倍PCR缓冲液2.5μl、dNTP混合液0.5μl、高保真DNA聚合酶0.5μl、第1轮PCR产物 2μl,用DEPC水补足至25μl。第2轮PCR的扩增条件为:94 ℃预变性2min;94℃变性30s,60℃退火30s,72℃复性延伸80s,35个循环;72℃延伸8min。PCR产物用1.0%琼脂糖凝胶进行电泳分析。切胶回收DNA后送 Invitrogen公司上海分公司完成测序。
1.2.2 标本的基因序列分析和构建系统进化树利用生物信息学软件DNAStar Lasergene 7.0 对正、反向核苷酸序列进行整理和比对。从GenBank下载基因1至4 型毒株序列,用MEGA 5.0软件包进行多序列比对以及构建系统进化树。为了评估进化树绘制的可靠性,采用一株禽HEV(GenBank 号:AY535004)作为对照。
1.2.3 PCR扩增HEV ORF2p154 (aa 452~605)基因 PCR的反应体系为25μl,包括上、下游引物各1.0μl,高保真DNA 聚合酶0.5μl,高保真酶缓冲液2.5μl,dNTP 1.0μl,HEV RNA 1.0μl,用DEPC水补足至25μl。PCR的扩增条件为:94℃预变性2min;94℃变性30s,54℃退火30s,72℃复性延伸1min,35个循环;72℃延伸10min。PCR产物用1.0%琼脂糖凝胶进行电泳分析。Qiagen胶回收试剂盒回收。
1.2.4 pPICZαA/p154重组表达载体的构建 用EcoRⅠ/NotⅠ双酶切酵母表达载体pPICZαA和 PCR片段, 双酶切后的产物经Qiagen胶回收试剂盒回收。T4DNA 连接酶将双酶切后的载体pPICZαA和 PCR片段相连,转化入大肠杆菌DH5α。将能在LB (25μg·ml-1Zeocin+) 平板上生长的单菌落进行菌落PCR 鉴定,并送Invitrogen公司上海分公司测序。将测序正确的阳性菌落进行摇菌培养后用Biomiga公司的EZ geneTM抽提试剂盒抽提质粒。
1.2.5 电转化及阳性克隆筛选 将上述重组表达质粒用SacⅠ进行单酶切,后电转化入酵母细胞GS115。并用100、500、1000、2000μg·ml-1Zeocin+的YPDS平板进行含高拷贝质粒酵母菌的筛选。将能在YPDS (μg·ml-1Zeocin+) 平板上生长的单菌落进行菌落PCR 鉴定。
1.2.6 诱导表达 筛选具有高Zeocin抗性且菌落PCR阳性的菌株作为表达株。接种单克隆至4ml YPD培养基中于30℃,260r·min-1摇菌培养至OD600=1。取3 ml菌液转种到50ml BMGY培养基,30℃、260r·min-1摇菌至OD600=15~20。室温、1500×g、5min离心收集菌体,用无菌双蒸水洗涤菌体,离心后重悬于10ml的BMMY,30℃、260r·min-1加甲醇诱导培养,连续诱导120h,期间每隔12h补加甲醇于培养基中至终浓度为0.5%,每24h取样1ml,4℃、13000 r·min-1离心20min。将上清于-80℃冰箱保存,留待检测。
1.2.7 表达产物的检测 SDS- PAGE检测:配制12%分离胶、5%浓缩胶,样品经煮沸5min后上样,考马斯蓝染色。蛋白质印迹法鉴定:SDS- PAGE电泳结束后转移至NC膜,以0.25mA恒流转移90min后,5%牛奶TBST室温封闭1h。加入一抗(HEV感染兔恢复期血清,HEV单克隆抗体6F9,均为1︰200稀释),4℃过夜。TBST洗涤后加入二抗(为HRP- 羊抗兔IgG与HRP- 羊抗小鼠IgG,均为1︰2000稀释),室温孵育2h。DAB显色,待膜上出现清晰的棕色条带后,立即以蒸馏水冲洗终止反应。
2 结 果
2.1 HEV毒株的基因扩增和序列分析
将本次采集的南京市第二医院住院戊型肝炎患者粪便标本命名为JS1533,用套式PCR获得HEV ORF2 691bp片段,经测序后与已知基因1~4型毒株进行核苷酸同源性比对,并构建系统进化树。JS1533与已知基因1、2、3、4型HEV的核苷酸同源性为76.06%~78.87%、75.45%、78.07%~80.89%、82.94%~90.54%。系统进化(图1)分析显示,JS1533与基因4型处于同一分支,说明JS1533为基因4型。将序列提交至GenBank数据库,GenBank登录号为JX847414。
2.2 外源基因整合到酵母细胞基因组的鉴定
纯化后的线性重组载体电转化入毕赤酵母细胞GS115,并用递增的Zeocin浓度筛选高拷贝的重组菌。最终选择在2000μg·ml-1Zeocin 的YPDS平板上生长的单菌落,用pPICZαA上的引物进行菌落PCR 鉴定,筛选阳性克隆。转化菌可扩增出729bp的目的条带,与预期大小一致。
2.3 重组蛋白的诱导表达
将菌落PCR阳性的重组菌在培养基中经过发酵培养后进行甲醇诱导表达[6],每24h取样,连续诱导120h。SDS- PAGE分析显示,重组菌能将目的蛋白分泌至上清中,目的蛋白在诱导后72 h表达量达到高峰,见图2。将菌株命名为GS115/p154。p154的分子质量为22 kDa,分子质量大小比预期的17 kDa要大,原因可能为p154的N562在Asn- 562发生糖基化,修饰的糖链使蛋白分子质量增加。与BSA定量比较后显示,目的蛋白在诱导后72 h时上清中的表达量可达到200μg·ml-1。
2.4 蛋白质印迹法分析重组蛋白的抗原性
用HEVHEV感染兔恢复期血清及HEV单克隆抗体6F9与目的蛋白进行蛋白质印迹反应,结果显示p154均在与SDS- PAGE一致的位置出现特异性反应条带,无非特异性反应,见图3。表明目的蛋白具有良好的抗原性。
3 讨 论
我国的HE以流行和散发两种形式存在[7],列入我国法定报告的乙类传染病进行管理。由于缺少稳定可靠的HEV体外培养系统,HEV灭活或减毒疫苗的研发受到限制,因此HE疫苗研究主要采用基因工程重组蛋白。至今多种pORF2重组蛋白已在大肠杆菌和昆虫表达系统中获得成功[2- 5],但是pORF2在大肠杆菌原核细胞表达时常以包涵体形式存在,蛋白质很难正确折叠,无法形成和保持天然的空间构象;昆虫表达系统缺点是要用血清培养,成本比较高,且昆虫蛋白本身的异源性也成为其作为疫苗研发的一个弊端。本研究的创新点在于选择了新的表达系统毕赤酵母表达系统,酵母属于低等真核微生物,当前对酵母特性和遗传背景的研究较清楚:(1) 基因重组易操作;(2) 易于在营养成份简单的培养基中高密度发酵培养,适于工业化生产;(3) 具有分泌型表达模式,能正确折叠和修饰;(4) 发酵液中杂蛋白少,产物易于纯化;(5) 无热原和其它病原体,且不含癌基因,表达产物的安全性高。目前全世界大规模生产和使用的乙型肝炎疫苗也是由酵母表达系统的产物制成。因此如何利用酵母表达系统生产高表达、低成本的戊型肝炎基因工程疫苗对我国戊型肝炎流行的控制十分重要。
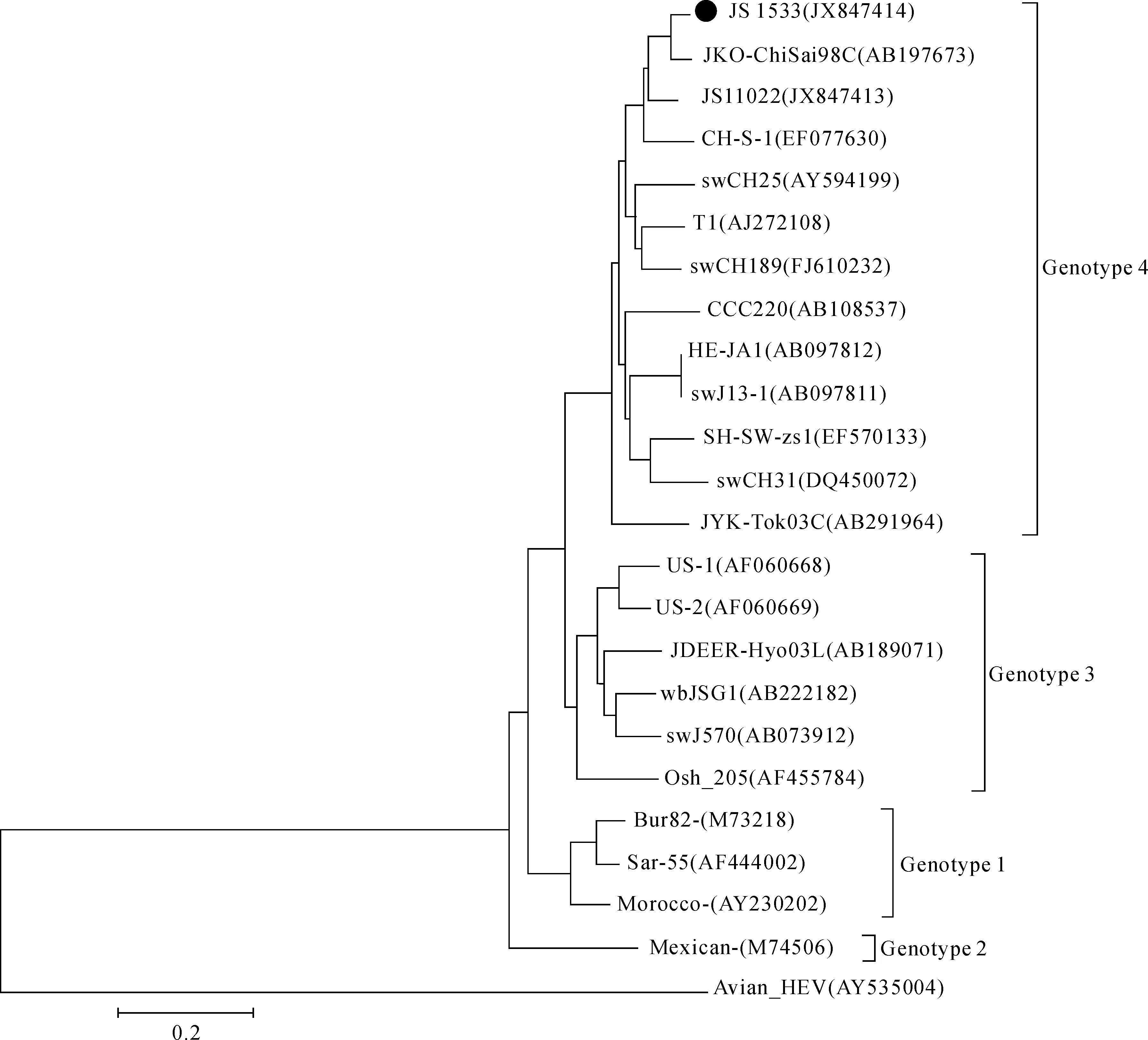
图1基于JS1533与基因1、2、3、4型HEV、禽HEVORF2部分核苷酸序列(nt6348-7038,691bp)构建的系统进化树
Fig1PhylogenetictreebasedonpartialnucleotidesequencesofHEVORF2ofJS1533,genotype1,2,3,4andavianHEVstrains
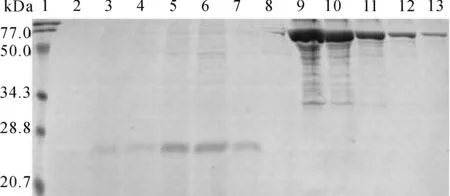
1. 蛋白分子质量标记;2~7.pPICZaA/p154- GS115培养上清,依次诱导表达0、24、48、72、96、120 h;8. pPICZαA- GS115对照菌培养上清, 诱导表达72 h;9~13.BSA浓度依次为1000、500、250、125、62.5 μg·ml-1
图2HEV重组菌表达产物SDS-PAGE电泳分析
Fig2SDS-PAGEanalysisofp154inthesupernatant
2000年Schofield 等[8]利用噬菌体展示技术将2个中和性单抗的表位定位在HEV ORF2 编码蛋白的第578~607位氨基酸之间,认为HEV中和抗原表位是一个线性表位。几乎同时我们[9]将HEV 的中和抗原表位定位在HEV ORF2 编码蛋白的452~617 位氨基酸,确认HEV中和抗原表位是构型依赖性表位,不是线性表位。这一研究结果得到了美国国立卫生研究院 Zhou等[10]的证实,他们将中和性抗原表位的定位缩短至458~607位氨基酸。但作者所在实验室张红梅等[11]发现,HEV中和性抗原表位可继续缩短至460~605位氨基酸,是目前文献报道中含有HEV 中和抗原表位的最短ORF2 编码蛋白片段,理论上含有该片段的pORF2蛋白均能诱导中和抗体,可以成为HE疫苗的候选品。厦门大学研究人员利用大肠杆菌以包涵体形式表达的HEV 1型ORF2蛋白片断p239(aa368~606) 已完成疫苗三期临床试验并成功上市[4]。本研究中我们选择了HEV ORF2编码的p154(452~605aa,154个aa),既包含中和抗原表位又比p239片段小,目的是期望得到分泌性表达的可溶性蛋白,保持它的天然构象和活性。
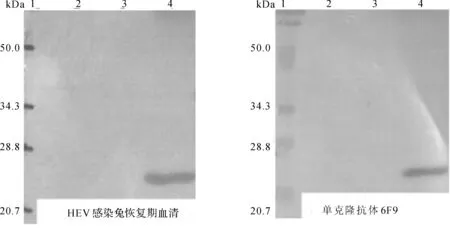
1. 蛋白分子质量标记;2. 诱导表达前;3. pPICZαA- GS115诱导表达72 h培养上清;4. pPICZαA/p154- GS115诱导表达72 h培养上清
图3HEV重组蛋白p154与HEV感染兔恢复期血清和HEV单抗的蛋白质印迹法分析
Fig3Westernblottinganalysisofp154reactedwiththerecoveryserumofrabbitinfectedbyHEVandmonoclonalantibody6F9
在本研究中我们利用基因重组技术成功构建了含HEV p154片段的pPICZαA重组质粒,并在毕赤酵母菌株GS115中实现了p154的分泌性表达。表达蛋白的分子质量约为22 kDa,与预期结果相比偏大,原因可能与p154中存在的Asn- 562潜在糖基化位点发生糖基化修饰有关,增加的糖链使目的蛋白分子质量变大。与已知浓度牛血清白蛋白定量分析相比,上清中目的蛋白的表达量可达到200μg·ml-1,如果使用发酵罐高密度培养,其表达量将有成倍提高。蛋白质印迹法分析结果显示,目的蛋白可与HEV感染兔恢复期血清及HEV单克隆抗体6F9进行反应,表明目的蛋白具有良好的抗原性和特异性。HEV p154重组蛋白在毕赤酵母中的成功表达为如何利用酵母表达系统生产高表达、低成本的戊型肝炎基因工程疫苗提供了实验基础,有待进一步深入研究。
[1] TAM A W,SMITH M M,GUERRA M E,et al.Hepatitis E virus(HEV): molecular cloning and sequencing of the full- length viral genome[J].Virology,1991,185(1):120- 131.
[2] PURCELL R H,NGUYEN H,SHAPIRO M,et al.Pre- clinical immunogenicity and efficacy trial of a recombinant Hepatitis E vaccine[J].Vaccine,2003,21(19- 20):2607- 2615.
[3] SHRESTHA M P,SCOTT R M,JOSHI D M,et al.Safety and efficacy of a recombinant hepatitis E vaccine[J].N Engl J Med,2007,356(9):895- 903.
[4] ZHU F C,ZHANG J,ZHANG X F,et al.Efficacy and safety of a recombinant hepatitis E vaccine in healthy adults: a large- scale,randomised,double- blind placebo- controlled,phase 3 trial[J].Lancet,2010,376(9744):895- 902.
[5] 董晨,孟继鸿.一种新型戊型肝炎病毒样颗粒的表达、纯化及其免疫原性[J].细胞与分子免疫学杂志,2006,22(3):339- 342.
[6] BATRA G,GURRAMKONDA C,NEMANI S K,et al.Optimization of conditions for secretion of dengue virus type 2 envelope domain Ⅲ using Pichia pastoris[J].J Biosci Bioeng,2010,110(4):408- 414.
[7] AYE T T,UCHIDA T,MA X Z,et al.Complete nucleotide sequence of a hepatitis E virus isolated from the Xinjiang epidemic(1986- 1988) of China[J].Nucleic Acids Res,1992,20(13):3512.
[8] SCHOFIELD D J,GLAMANN J,EMERSON S U,et al.Identification by phage display and characterization of two neutralizing chimpanzee monoclonal antibodies to the hepatitis E virus capsid protein[J].J Virol,2000,74(12):5548- 5555.
[9] MENG J,DAI X,CHANG J C,et al.Identification and characterization of the neutralization epitope(s) of the hepatitis E virus[J].Virology,2001,288(2):203- 211.
[10] ZHOU Y H,PURCELL R H,EMERSON S U.An ELISA for putative neutralizing antibodies to hepatitis E virus detects antibodies to genotypes 1,2,3,and 4[J].Vaccine,2004,22(20):2578- 2585.
[11] 张红梅,孟继鸿,戴星,等.一个能诱生戊型肝炎病毒中和抗体的ORF2编码蛋白短片段[J].分子与细胞免疫学,2007,23(6):483- 487.
