急性早幼粒白血病细胞ATRA耐药株HL- 60R、NB4R的构建及鉴定
2014-09-12张亚芬张莹缪凤琴张建琼
张亚芬,张莹,缪凤琴,张建琼
(东南大学医学院 病原生物学与免疫学系,发育与疾病相关基因教育部重点实验室,江苏 南京 210009)
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓系白血病中的M3亚型,占所有急性髓系白血病的10%~15%[1]。全反式维甲酸(all- trans retinoic acid,ATRA)联合以蒽环类药物为主的化疗方案是临床上APL诱导缓解的首选疗法[2- 4],而ATRA治疗时耐药性的产生是导致其治疗失败的主要原因。本实验以ATRA为诱导药物,采用浓度递增间歇诱导法建立了APL细胞的ATRA耐药株HL- 60R、NB4R,并对耐药细胞的生物学性状进行了初步探讨。该细胞系的建立为深入探讨人急性早幼粒细胞白血病细胞ATRA耐药机制提供了工具细胞。
1 材料与方法
1.1 材料
1.1.1 试剂 ATRA(Sigma公司)、依托泊苷(etoposide,VP- 16,江苏恒瑞医药股份有限公司)、硫酸长春新碱(vincristine sulfate,VCR,浙江海正药业股份有限公司)、阿糖胞苷(cytarabine,Ara- C,辉瑞制药有限公司)、多柔比星(doxorubicin,ADM,辉瑞制药有限公司)、RPMI- 1640培养基(Gibco公司)、胎牛血清(Hyclone公司)、青霉素(山东鲁抗医药股份有限公司)、链霉素(Thermo Scientific公司)、CCK8(Dojindo公司)。
1.1.2 细胞 人APL细胞系HL- 60购自中国科学院细胞库,人APL细胞系NB4由南京市鼓楼医院惠赠。
1.2 方法
1.2.1 细胞培养 HL- 60、NB4细胞以RPMI- 1640培养基(含10%胎牛血清、青霉素120μg·ml-1、链霉素100μg·ml-1)于37℃、体积分数为5%的CO2培养箱中培养。
1.2.2 ATRA耐药细胞株的诱导 根据文献报道采用浓度递增间歇诱导法进行耐药细胞株的构建[5- 6]:取对数生长期细胞,在含10-9mol·L-1ATRA培养基中培养48h;以普通培养基培养2~3代后提高ATRA浓度1倍,如此反复,最终诱导出在含10-6mol·L-1ATRA培养基中仍能保持增殖和分化状态的细胞系,分别命名为HL- 60R、NB4R,且细胞始终培养于含10-6mol·L-1ATRA培养基中用于实验。
1.2.3 HL- 60R、NB4R细胞对ATRA耐药性的鉴定 以HL- 60R细胞为例,设置4组:HL- 60、HL60+ATRA、HL- 60R、HL- 60R+ATRA组,以每孔5000个细胞接种于96孔板,培养48h后每孔加入10μl CCK8溶液,继续培养4h,酶标仪读取吸光度值,并计算各组细胞的存活率。
1.2.4 生长曲线测定 以HL- 60、HL- 60R细胞为例,取对数生长期的HL60、HL60R细胞,以每孔1000个细胞接种至6孔板,分别在普通培养基或含10-6mol·L-1ATRA培养基中培养,于第1、2、3、4、5、6天进行细胞计数,绘制生长曲线,并根据Patterson公式计算细胞的群体倍增时间。
1.2.5 耐药谱分析 以HL- 60R细胞为例,取对数生长期HL- 60及HL- 60R细胞,以每孔5000个细胞接种于96孔板,每孔加入不同浓度的各化疗药物(VCR、ADM、VP- 16、Ara- C),药物终浓度参照临床使用时的血浆峰浓度(peak plasma concentration,PPC)[7],培养48h后每孔加入10μl CCK8溶液,继续培养4h,酶标仪读取吸光度值并计算各化疗药物对细胞的抑制率。
参照药敏试验评价标准[8],若药物对细胞的抑制率﹥50%,代表细胞对药物敏感;若药物对细胞的抑制率为30%~50%,代表细胞对药物部分耐受;若药物对细胞的抑制率﹤30%,代表细胞对药物耐受。
1.3 统计学处理
采用SPSS18.0统计软件进行分析,样本均数比较用两独立样本t检验,P<0.05则差异具有统计学意义。
2 结 果
2.1 构建HL- 60R、NB4R耐药细胞株
本实验采用浓度递增间歇诱导法,历时4.5个月,成功建立了HL- 60、NB4细胞相应的ATRA耐药株,并以CCK8法对其ATRA耐药性进行了鉴定(图1);且耐药株经冻存复苏后的生长状态良好,耐药性保持稳定。
2.2 HL- 60R、NB4R细胞的生物学性状
2.2.1 细胞形态学观察 光镜下(未染色)观察发现(图2),亲代及耐药细胞均悬浮生长,耐药细胞体积有所增大,且大小不一;此外HL- 60细胞呈单个生长,而相应的耐药株HL- 60R则出现少量成团生长现象。
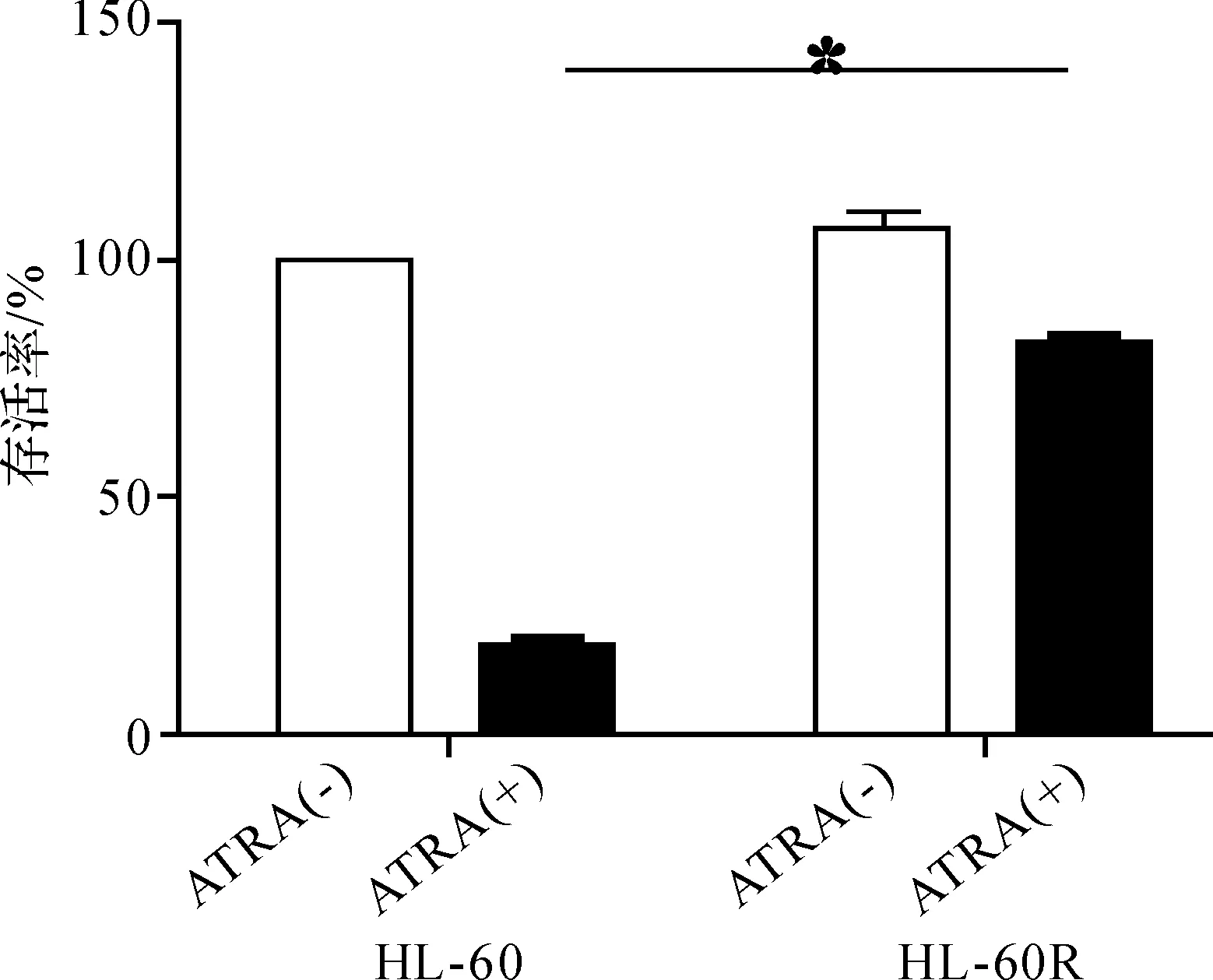
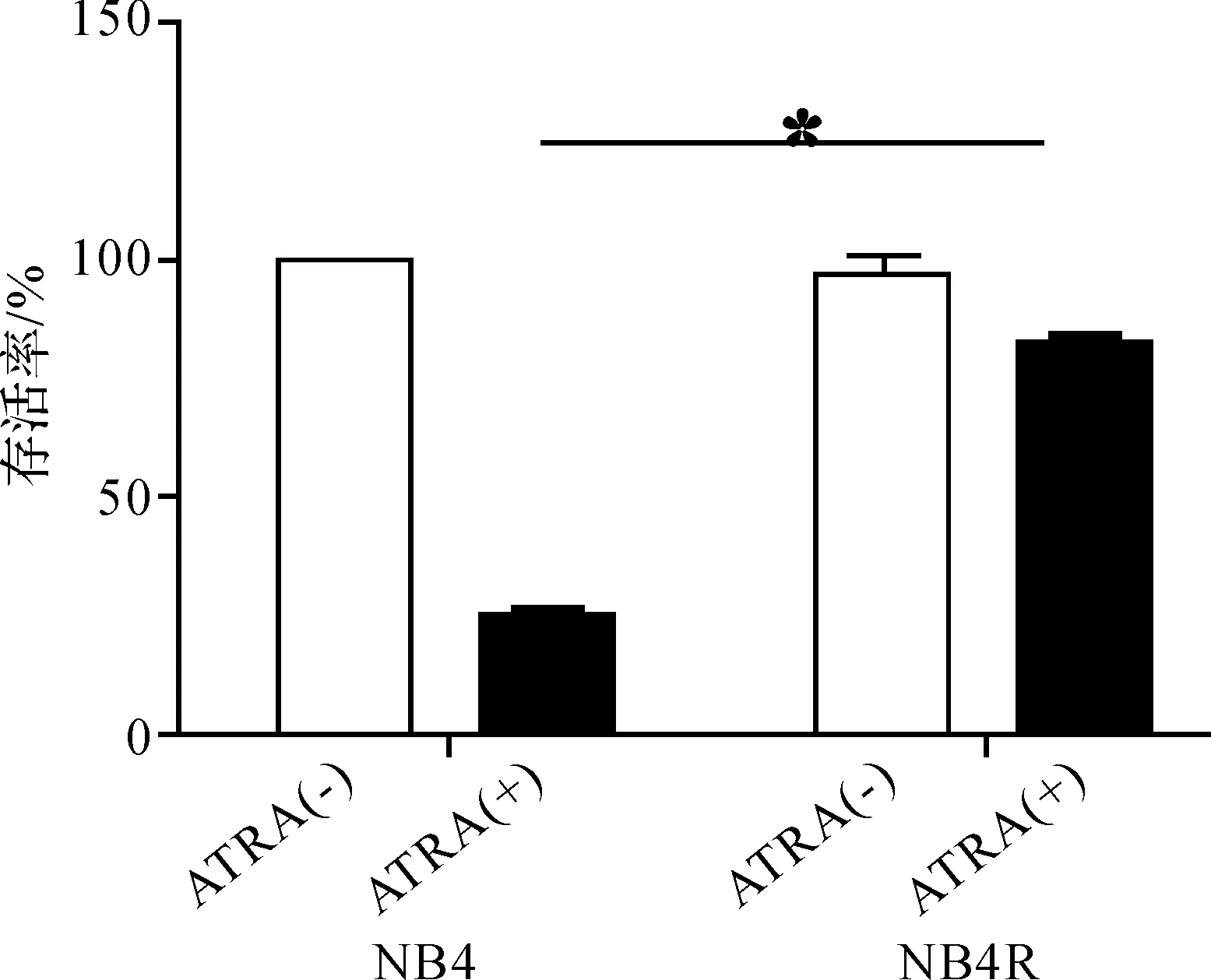
图1HL- 60R和NB4R细胞的ATRA耐药性鉴定
Fig1IdentificationofHL- 60RandNB4Rcells’ATRAresistance

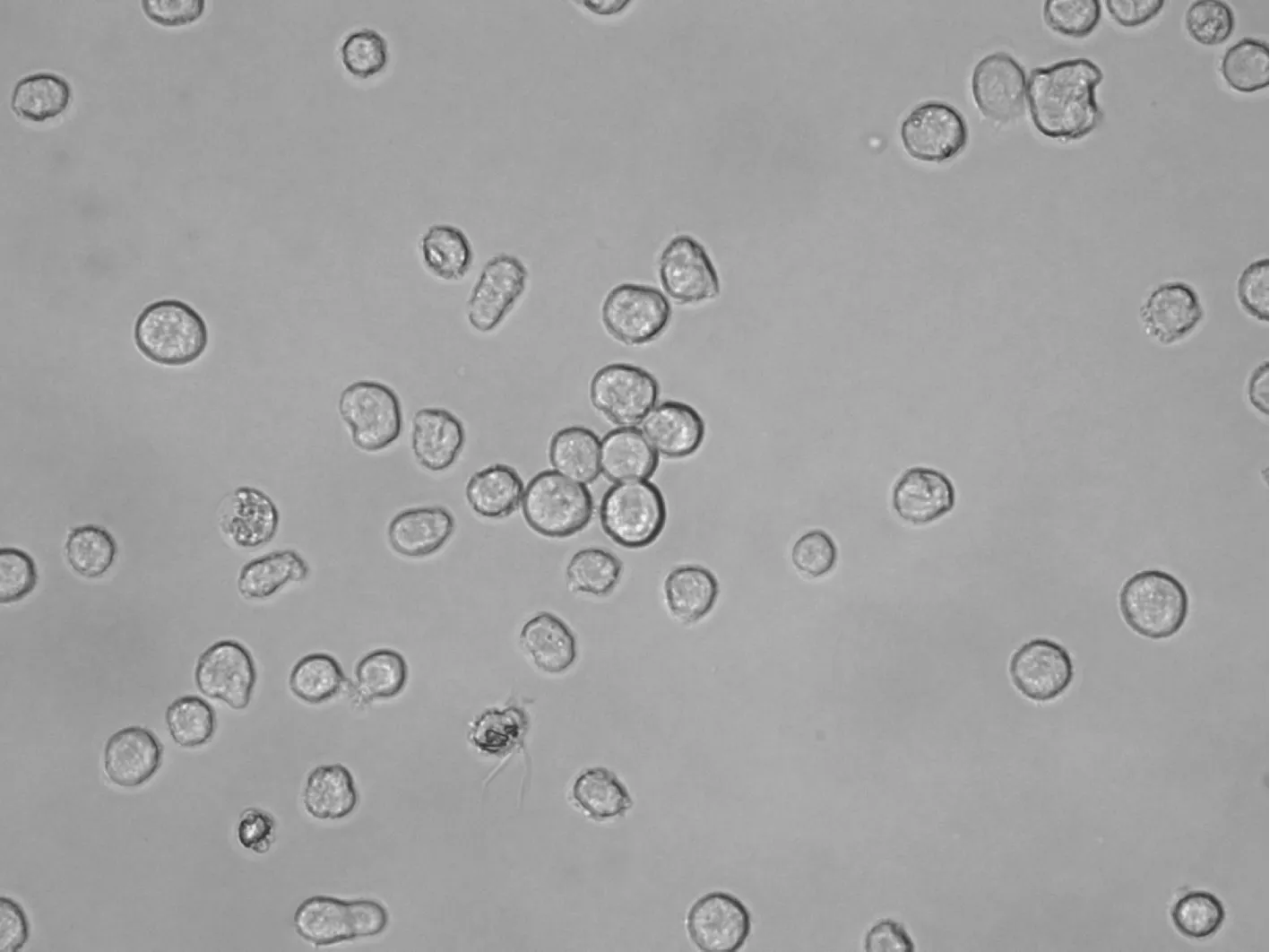
图2光镜下的的HL- 60和HL- 60R细胞
Fig2HL- 60andHL- 60Rcellsunderlightmicroscope
2.2.2 HL- 60R、NB4R细胞的生长曲线 亲代及耐药细胞在相同培养基下增殖情况有一定差异:在普通培养基下耐药细胞的生长速度减慢,生长曲线的斜率减小(图3),群体倍增时间延长(HL- 60为21.86h,HL- 60R为27.5h,NB4为20.75h,NB4R为25.94h);在含ATRA培养基中亲代细胞培养72h后几乎全部死亡,而耐药细胞则生长良好。
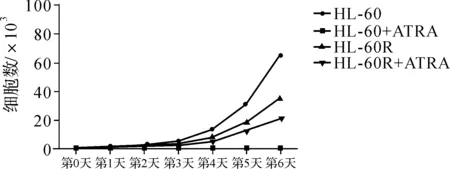

图3HL-60R和NB4R细胞的生长曲线
Fig3ThegrowthcurvesofHL-60andHL-60R
2.3 HL- 60R、NB4R细胞呈现多药耐药性
从图4的耐药谱来看,参照药敏试验的评价标准,HL- 60R细胞对VP- 16、ADM这两种化疗药物具有耐药性,对VCR、Ara- C具有部分耐药性;而NB4R细胞对这4种化疗药物均具有部分耐药性。
3 讨 论
目前临床上APL治疗的首选方法是ATRA联合蒽环类药物为主的化疗,该方法能够使患者的初治完全缓解率达80~95%[2,9- 10],是肿瘤诱导分化疗法最成功的模式。然而,用ATRA进行治疗时20%~30%的APL患者会产生耐药反应,在完全缓解后3~6个月内复发,且再次缓解后的3年总体生存率仅为50%左右,严重影响了ATRA的疗效,甚至导致治疗失败[11- 12]。因此,ATRA耐药性的产生是目前临床上APL化疗失败的主要原因,所以研究ATRA的耐药机制并寻求逆转耐药的有效措施是目前APL研究的一大方向。而构建理想的耐药细胞系是研究耐药细胞生物学变化、耐药发生机制以及探索逆转耐药的新型药物的重要基础。
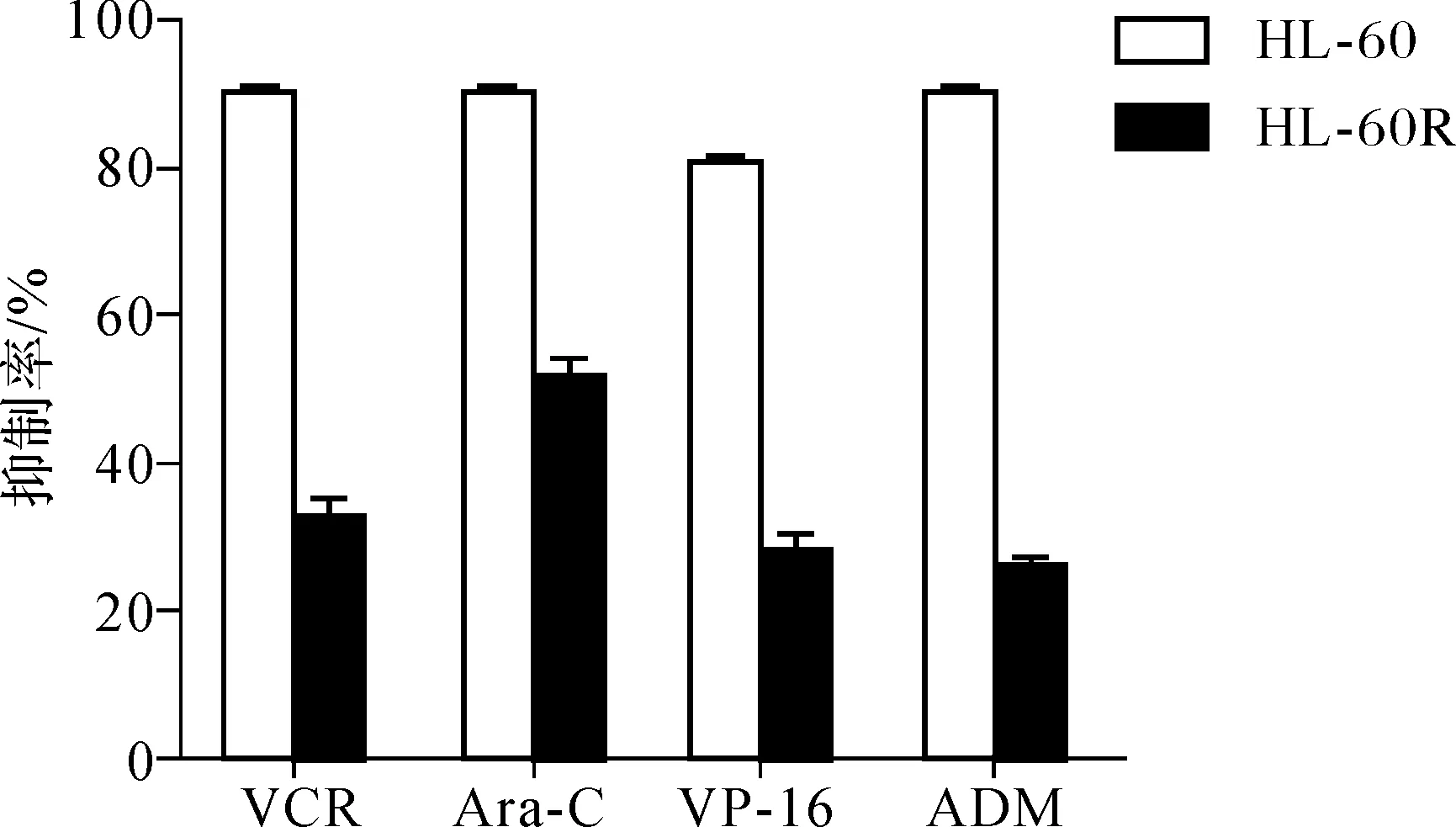
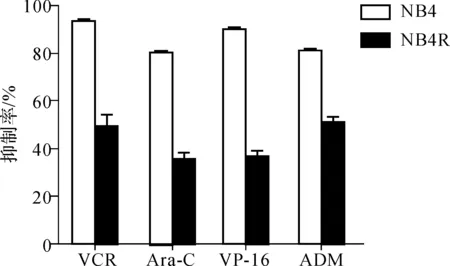
图4HL-60R和NB4R细胞的耐药谱
Fig4Cross-drugresistanceprofilesofHL-60RandNB4R
本研究采用浓度递增间歇诱导法,历时4.5个月,成功建立了具有多药耐药特征的ATRA耐药细胞株HL- 60R、NB4R。这两株耐药细胞在含10-6mol·L-1ATRA培养基中生长良好,且经冻存复苏后耐药性仍保持稳定。耐药细胞株的诱导过程实际上是筛选细胞的过程,由于细胞的异质性,大部分对药物敏感的细胞被杀死,仅有少数不敏感的细胞存活下来并得以扩增。
比较亲代细胞及耐药细胞的生物学特性发现,与亲代细胞相比耐药细胞体积有所增大,且大小不一;对VP- 16、ADM、VCR、Ara- C等其它化疗药物也产生了一定程度的耐药性,即耐药细胞株HL- 60R、NB4R具有多药耐药特征。
此外,通过绘制细胞生长曲线并计算细胞的群体倍增时间发现,相较于亲代细胞耐药细胞株HL- 60R、NB4R的生长增殖速度减慢、群体倍增时间明显延长。研究表明肿瘤细胞的群体倍增时间越短,其对化疗药物越敏感,疗效越好;反之,细胞群体倍增时间延长,表明其对化疗药物的敏感性降低[13]。这与我们的结果相一致。
综上所述,本研究构建了APL细胞的ATRA耐药株HL- 60R、NB4R,其耐药性稳定且具备一定的多药耐药性状。这两株ATRA耐药细胞的成功构建为进一步从细胞和分子水平研究APL细胞的多药耐药机制提供了有效的细胞模型,为寻找APL细胞多药耐药的逆转策略及筛选或开发新的APL治疗药物等提供了必要的实验材料,同时对于预防和延缓APL临床耐药性的发生、提高APL的治疗效果具有重要意义。
[1] SHAFFER B C,GILLET J P,PATEL C,et al.Drug resistance:still a daunting challenge to the successful treatment of AML[J].Drug Resistance Updates,2012,15(1- 2):62- 69.
[2] LALLEMAND- BREITENBACH V,ZHU J,CHEN Z,et al.Curing APL through PML/RARA degradation by As2O3[J].Trends in Molecular Medicine,2012,18(1):36- 42.
[3] FANG J,CHEN S J,TONG J H,et al.Treatment of acute promyelocytic leukemia with ATRA and As2O3:a model of molecular target- based cancer therapy[J].Cancer Biology & Therapy,2002,1(6):614- 620.
[4] 贺白,顾伟英,曹祥山,等.急性早幼粒细胞白血病患者早期死亡的临床分析[J].现代医学,2011,39(2):169- 172.
[5] 蔡倩,徐酉华,刘筱梅,等.HSP90β在ATRA诱导的白血病细胞株HL60耐药中的作用研究[J].重庆医科大学学报,2010,35(11):1658- 1661.
[6] 薛芳,成志勇,杨琳,等.白血病耐药细胞系U937/ADR的建立及其生物学性状[J].中国生物工程杂志,2009,29(7):17- 21.
[7] 陈新峰,杨菁.用MTT法进行白血病体外药物敏感性检测的临床意义[J].福建医科大学学报,2009,43(2):169- 171,177.
[8] 苏祖禄,苏海,张毅,等.脑胶质瘤化疗药物的体外敏感性试验研究[J].第三军医大学学报,2013,35(13):1420- 1423.
[9] SANZ M A,LO- COCO F.Modern approaches to treating acute promyelocytic leukemia[J].Journal of Clinical Oncology,2011,29(5):495- 503.
[10] CORNELL R F,PALMER J.Adult acute leukemia[J].Disease- a- month :DM,2012,58(4):219- 238.
[11] ARTEAGA M F,MIKESCH J H,QIU J,et al.The histone demethylase PHF8 governs retinoic acid response in acute promyelocytic leukemia[J].Cancer Cell,2013,23(3):376- 389.
[12] 陈赛娟.白血病发病原理和靶向治疗研究——从急性早幼粒细胞到其他类型白血病[J].中华血液学杂志,2010,31:3- 6.
[13] 张南文,许建华.人结肠癌耐药细胞系SW480/L- OHP的建立及其耐药机制初探[J].福建医科大学学报,2013(4):228- 231.
