彩色多普勒超声与CT诊断小儿神经母细胞瘤的对比分析
2014-09-12国兰兰史鹏丽马灵芝
国兰兰,史鹏丽,马灵芝
(中国医科大学附属第四医院 超声科,辽宁 沈阳 110032)
神经母细胞瘤(neuroblastoma)小儿常见。本病发生部位隐匿,症状无特异性,临床诊断较困难,早期即可发生转移,且预后差, 因此影像学检查对其早期诊断非常重要。在可疑神经母细胞瘤患儿中,彩色多普勒超声常为首选检查,超声检查不仅能发现原发病灶,而且能清晰显示病灶的范围、内部结构、与相邻脏器的关系以及有无转移。CT作为诊断的重要方法之一也起着不可替代的作用。本文中作者总结了我院2011年6月至2013年6月间诊治的36例神经母细胞瘤患儿的彩色多普勒超声和CT图像表现,着重探讨本病超声与CT诊断的特点,提高对本病的认识,为今后临床诊断提供参考。
1 资料与方法
1.1 一般资料
本组病例为2011年6月至2013年6月我院诊治的36例神经母细胞瘤患儿,均经手术或穿刺活检病理证实,其中因肿瘤过大暂不能手术切除只经活检证实者15例,21例经手术切除证实,上述病例中有7例经骨穿证实有瘤细胞转移。36例中男20例,女16例,男女比例为1.25∶1;年龄4个月~14岁,平均(4.23±2.83)岁。临床表现:腹部包块,腹胀、腹痛,四肢及躯干疼痛,部分患儿伴有发热、贫血、消瘦、乏力等症状。所有患者均行彩色多普勒超声及CT检查。
1.2 仪器和方法
采用美国 GE- LOGIQ9及GE- VOLUSON E6 超声诊断仪(3.5MHz探头)行超声检查。检查前患儿需空腹,检查时取仰卧或侧卧位,对肿瘤各切面连续扫察,观察肿瘤大小、位置、形态、边界、内部回声及彩色多普勒(CDFI)血流信号。依据Adler分级方法对肿瘤内部血流显示情况进行分级[1]:0 级为肿瘤内未见确切血流信号;Ⅰ级为少量血流,肿瘤内可见点状血流信号;Ⅱ级为中量血流,一个断面上可见一条主要血管(其长度超过肿瘤的半径)或 2~4个点状血流信号;Ⅲ级为丰富血流,肿瘤内可见4条以上血管或弥漫性交织呈网状血流显示。观察肿瘤与腹腔周围血管及周围脏器的关系,并注意肝肾及腹膜后有无转移等。CT 检查采用 SIE- MENS 16 排螺旋 CT 和 GE 64 排螺旋 CT , 层厚5mm,层距5mm, 扫描范围上自剑突下至耻骨联合。增强扫描:对比剂为欧乃派克(300), 以1.5ml·kg-1静脉注射。3岁以下不能配合的小儿检查前做镇静等准备。
2 结 果
2.1 肿瘤部位
本组共36例病例,其中起源于肾上腺24例,腹部交感神经链9例,盆腔3例。
2.2 肿瘤超声图像表现
2.2.1 大小、形态与边界 本组病例中超声测量肿瘤最小者范围约2.7cm×1.4cm,最大者范围约为18.9cm×11.3cm,平均直径约为(6.7±3.67)cm,跨越中线者12例。肿瘤形态多呈不规则形、结节状、分叶状或融合状。边界不清15例,边界欠清11例,边界清10例。见图1。
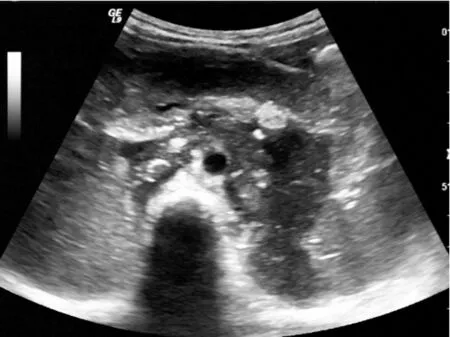
图1脊柱前方实性肿物,肿块形态不规整,边界不清,内呈不均低回声伴散在强回声,肿块生长跨越中线
2.2.2 超声内部回声及血流显示 本组病例中33例呈不均低回声,3例呈中等及稍高回声。肿瘤内钙化29例,肿瘤内液性区10例,血流显示0级3例,Ⅰ级11例,Ⅱ~Ⅲ级22例。
2.2.3 瘤体转移、与周边血管及脏器关系 本组病例中肾脏受侵犯2例,肝脏受侵犯4例,胰腺受侵犯1例,腹膜后淋巴结肿大19例。肾脏及输尿管受压出现不同程度肾积水6例,肿瘤包绕血管17例,部分血管受压迫,受压处管腔狭窄,血流信号变细。见图2。

图2纵切矢状面可见肿块包绕腹腔干、肝总动脉、脾动脉,向后压迫腹主动脉使其管腔变窄
2.3 肿瘤CT图像表现
2.3.1 大小、形态与边界 本组病例中CT测量肿瘤断层最小者范围约为2.1cm×1.5cm,最大者范围约为15.6cm×12.1cm,平均直径约为(5.31±2.50)cm,跨越中线者12例。肿瘤形态多呈不规则形、类圆形、分叶形。边界不清19例,边界欠清10例,边界清7例。见图3。
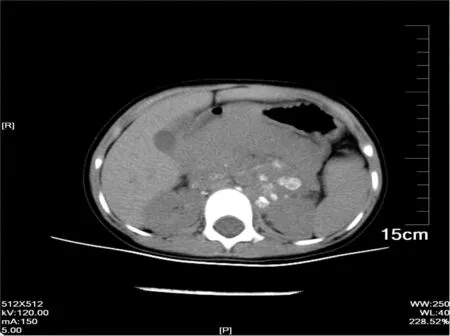
图3与图1为同一患者,本图可见CT增强扫描示肿瘤越过中线生长,可见结节状钙化
2.3.2 CT密度及强化程度 本组病例中不均混杂密度35例,囊性低密度1例。肿瘤内钙化33例,增强后强化程度无强化2例,轻度强化14例,中度及明显强化20例。见图3。
2.3.3 瘤体转移、与周边血管及脏器关系 本组病例中肾脏受侵犯2例,肝脏受侵犯4例,胰腺受侵犯1例,腹膜后淋巴结肿大22例,骨转移4例。肾脏及输尿管受压出现不同程度肾积水5例,肿瘤包绕血管20例。 见图4。
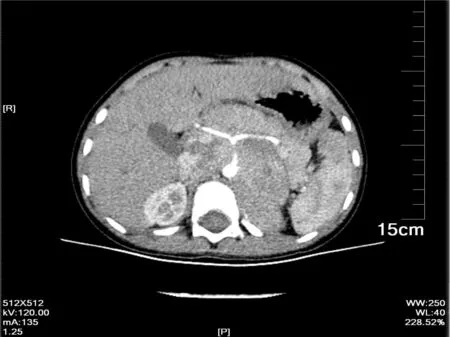
图4与图3为同一患者,本图为横切,可见肿块包绕腹腔干、肝总动脉、脾动脉,向后压迫腹主动脉使其管腔变窄
2.4 超声与CT诊断对比
见表1。
表1对神经母细胞瘤超声与CT诊断对比
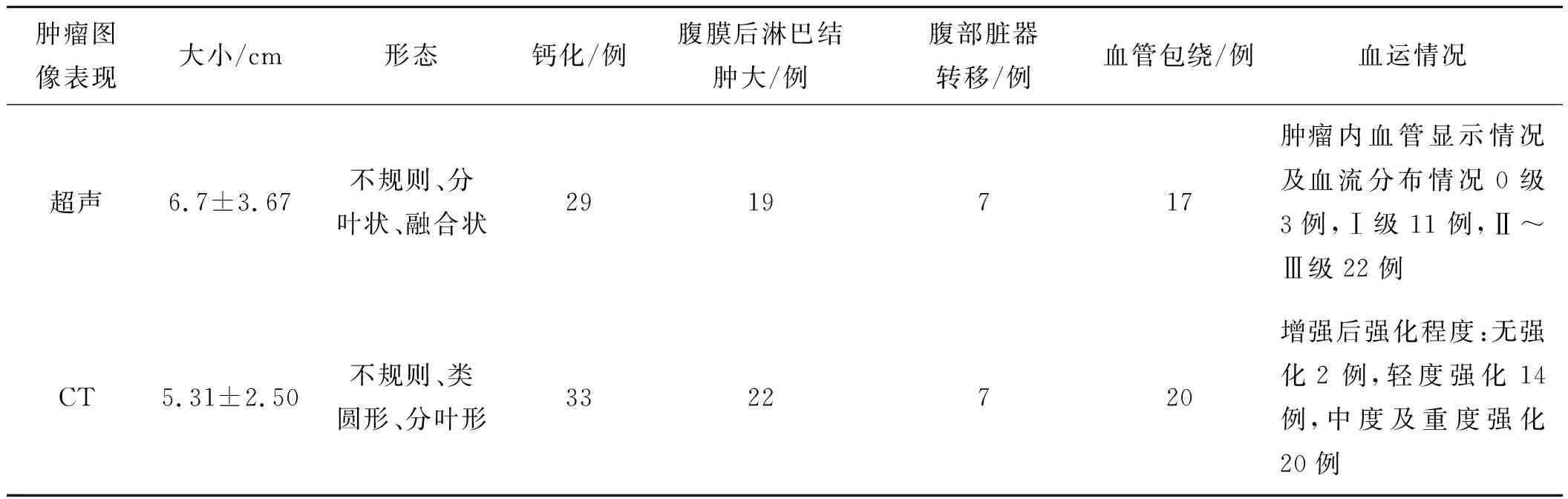
肿瘤图像表现大小/cm形态钙化/例腹膜后淋巴结肿大/例腹部脏器转移/例血管包绕/例血运情况超声6.7±3.67不规则、分叶状、融合状2919717肿瘤内血管显示情况及血流分布情况0级3例,Ⅰ级11例,Ⅱ~Ⅲ级22例CT5.31±2.50不规则、类圆形、分叶形3322720增强后强化程度:无强化2例,轻度强化14例,中度及重度强化20例
3 讨 论
神经母细胞瘤是小儿常见的恶性肿瘤,它来源于肾上腺髓质或脊椎旁交感神经系统的未成熟的胚胎细胞,有66%~80%发生于肾上腺髓质[2],也可发生于肾上腺外的交感神经节细胞,如椎旁交感神经系统、纵隔、盆腔等处。神经母细胞瘤多发生于1~5岁小儿,其中2岁左右为发病高峰期[3],男性患儿略多于女性[4]。神经母细胞瘤肿瘤生长迅速,发现时多已呈巨块,常跨越中线生长。本组病例中跨越中线12例,此征象对本病诊断也具有一定价值,是本病与其他疾病鉴别时的特点之一。
神经母细胞瘤超声表现为分叶状不均质实质性肿块,内部一般呈低回声为主,伴点状及斑块状强回声以及散在无回声区。CT表现为不规则软组织肿块,密度不均,内可见散在分布斑片样钙化灶。两种检查方法图像对比:(1) 钙化:肿瘤钙化是神经母细胞瘤的特异性表现,是鉴别诊断的重要依据[5],肿瘤钙化率常可高达70%~80%[3],神经母细胞瘤肿瘤内的钙化与肿瘤大小无关。本组病例中超声检出钙化29例(约占80.6%),CT检出钙化33例(约占91.7%),CT对钙化的显示优于超声。(2) 边界:由于肿瘤生长迅速,常在短期内突破包膜,超声与CT表现边界多不清晰。(3) 肿瘤血运情况:由于恶性肿瘤内有促血管生成因子刺激肿瘤床血管生长,使肿瘤组织中血管相对增多[6]。超声无需使用造影剂,通过彩色多普勒可以显示肿瘤内部或周边血流情况。增强CT对于肿瘤内部血管显示需通过肿瘤强化程度判断血运情况,超声相对于CT更直观、更方便。(4) 肿瘤与周围脏器及血管关系:肿瘤压迫、包绕血管是神经母细胞瘤典型特征之一[7],随着肿瘤不断增大,常使肝、肾受压移位。常见被肿瘤推移、包绕的血管为腹主动脉、下腔静脉、腹腔干、肠系膜上动脉等。增强CT较超声更能清晰显示肿瘤与周围血管的位置关系。(5) 转移情况:肿瘤可向周围组织浸润生长,40%~70%患儿初诊时已发生转移[8]。本组病例中超声检出腹部脏器转移7例,其中1例肝转移患者超声显示肝脏内多处低回声病灶,CT 平扫未见,于增强CT中仅显示单一病灶。在腹膜后淋巴结检出方面,由于超声易受腹腔气体干扰,超声检出率(52.8%)低于CT(61.1%),对于远处转移如骨转移、纵隔转移CT明显优于超声。
此外,CT在断层切面上测量瘤体大小时不易测得肿瘤的最大径,超声检查可以通过改变探头方向对肿瘤进行连续扫查,很容易探测病灶最大切面, 相比CT 而言, 超声探测肿瘤和计算肿瘤的大小更加方便。另外,CT存在辐射, 由于患儿处于生长发育阶段,浅表腺体及生殖系统对于放射线非常敏感,易受射线损害,不适合短期内重复检查。超声由于其安全特性,在临床中可以弥补CT在此方面的不足,常被用于患儿的多次随访检查。更重要的是超声可以诊断胎儿期的神经母细胞瘤[9],本组病例中有2例患儿为胎儿期诊断,使得病变早期即被发现治疗,争取了最佳的治疗时机,对患儿预后良好具有很大意义。
综上所述,神经母细胞瘤的影像学表现有一定特征性,超声与CT诊断方法各有优点,有着不同的临床价值。联合应用 CT 与超声检查可以提高神经母细胞瘤的诊断准确率,正确掌握神经母细胞瘤的超声及CT诊断特点对今后的临床诊断工作有重要指导意义。
[1] ADLER D D,CARSON P L,RUBIN J M,et al.Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J].Ultrasound in Medicine and Biology,1990,16(6):553- 559.
[2] 周永昌,郭万学.超声医学[M].6版.北京:人民军医出版社,2011:1040.
[3] 潘恩源,陈丽英.儿科影像诊断学[M].北京:人民卫生出版社,2007:736- 940,855- 858.
[4] 高建.80例神经母细胞瘤的临床诊治疗效及预后影响因素分析[D].郑州:郑州大学,2013.
[5] 邵虹.神经母细胞瘤的影像学诊断[J].国外医学:放射医学核医学分册,2002,26(4):148- 151.
[6] 王珉鑫,张宏伟,王小婷.彩色多普勒超声诊断小儿腹膜后肿瘤的应用价值[J].基层医学论坛,2013,17(28):3757- 3758.
[7] 叶滨滨,舒红,陈丽英,等.小儿腹膜后成神经细胞瘤影像学与病理的对照研究[J].中华放射学杂志,2000,34(2):114- 117.
[8] 边昕,王振常,鲜军舫,等.儿童神经母细胞瘤颅面骨转移的影像表现[J].中华放射学杂志,2009,43(3):258- 261.
[9] CASTEL V,GRAU E,NOGUERA R,et al.Molecular biology of neuroblastoma[J].Clinical and Translational Oncology,2007,9(8):478- 483.
