基于甲基乙烯基醚/马来酸酐共聚物水凝胶三维培养卵巢癌细胞的研究
2014-09-12陈峻崧陈登宇窦骏张天柱杨翠萍侍方方顾宁
陈峻崧,陈登宇,窦骏,张天柱,杨翠萍,侍方方,顾宁
(1.东南大学医学院 病原生物学与免疫学系,江苏 南京 210009; 2.东南大学 生物科学与医学工程学院,江苏 南京 210096; 3.东南大学附属中大医院 肿瘤科,江苏 南京 210009)
人体内组织为三维(three-dimensional,3D)结构,但是在研究人体组织结构功能时却往往依赖体外的二维(two-dimensional,2D)培养和动物模型。过去常利用普通2D细胞培养来研究肿瘤发生发展机制,但此法与体内真实环境有很大不同,如细胞与基质间相互作用、细胞分化等[1]。而动物模型由于与人体存在种属差异,不能很好地重复人体肿瘤生长转移、药物治疗反应、免疫反应等特性,因此需要一种新的细胞培养方式能够充分地模拟人体内环境。3D细胞培养技术则能适应这种需求,并具有普通2D细胞培养简单易行的优势。3D培养用途已在抗肿瘤药物筛选领域得到了认可,将来有望成为肿瘤发生及转移机制研究、抗肿瘤药物筛选和肿瘤干细胞培养的标准方法[2]。
本研究课题组应用聚甲基乙烯基醚/马来酸酐(PMVE-co-MAH)水解产物甲基乙烯基醚/马来酸共聚物(PMVE-co-MA)和交联剂聚乙二醇进行交联反应,制得可适合用作多种肿瘤细胞3D培养基质的水凝胶TZ028和TZ029培养基[3]。通过对比市售商品化胞外基质(BME)胶和胶原蛋白Ⅰ(CollagenⅠ)3D培养基,研究人卵巢癌SKOV-3细胞在生长曲线、细胞迁移和侵袭、抗肿瘤药物耐药实验等方面的差异度,确定自制的水凝胶是否像BME和胶原蛋白Ⅰ培养基一样,可模拟体内细胞环境,为分析卵巢癌SKOV-3细胞生物学特性和药物筛选等研究提供细胞3D培养模型。
1 材料与方法
1.1 材料
BME培养基(3D culture BME cell proliferatio,美国Trevigen公司,批号3445-096-K),胶原蛋白Ⅰ培养基(3-D culture MatrixTMrat collagen Ⅰ,美国Trevigen公司,批号3447-020-01),millicell聚酞酸酯嵌入式培养皿(millicell polycarbonate,美国Millipore公司),人卵巢癌细胞株SKOV-3细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,DMEM完全培养液为含体积分数10%胎牛血清(FBS Gibco公司)和1%青链霉素溶液的DMEM(Gibco公司)培养液。
1.2 方法
1.2.1 交联多聚水凝胶为PMVE-co-MAH与交联剂聚乙二醇PEG20000进行交联反应 通过调整PMVE-W-MA中羧基和交联剂中羟基的比例,获得不同交联密度的凝胶,交联后凝胶中多余的羧基再用聚乙二醇单甲醚进行酯化,最后将获得的凝胶配成0.1wt%~10wt%之间的水凝胶分散体系。TZ028和TZ029材料为PMVE-co-MAH与交联剂聚乙二醇PEG20000分别按照羧基的量n-COOH∶羟基的量n-OH=128∶1和256∶1进行交联所获得的水凝胶[3]。
1.2.2 肿瘤细胞3D培养生长曲线 分别取TZ028和TZ029材料在冰上,用无菌滴管吸取50 μl(每孔)加入96孔板中,放入37 ℃、体积分数5%的 CO2培养箱中60 min孵育形成凝胶状;用DMEM的完全培养基悬浮SKOV-3细胞计数到1×105个·ml-1;按组别分别加入TZ028和TZ029材料使其体积分数分别达到5%;快速取上述混合液100 μl(每孔)分别滴加入含有TZ028和TZ029材料的96孔板中,使得每孔细胞数达到1×104个;放入37 ℃、体积分数5%的CO2培养箱中培养。抽取样品分别于第1、5、10、15、20 天加入20 μl(每孔)MTT溶液(5 mg·ml-1,即0.5% MTT),放入培养箱中孵育4 h后,加入50 μl(每孔)SDS三联溶解液。在酶联免疫检测仪570 nm处测量各孔的OD值,同时设置对照孔。
1.2.3 肿瘤细胞迁移和侵袭实验 分别用35 μl(每孔)BME培养基和胶原蛋白Ⅰ培养基与TZ028和TZ029材料包被Transwell小室底部膜的上室面,4 ℃风干。Transwell小室上室加入100 μl的已经过3 d无血清培养的SKOV-3细胞悬液,每孔含有1×104个细胞;下室加入DMEM的完全培养基。放入培养箱中孵育24 h后,用棉签拭去上室的细胞和凝胶,并用PBS冲洗2遍;于4%甲醛中固定,用0.4%的台盼蓝染色,显微镜下对穿透细胞进行计数。每孔随机取5位点细胞计数,取平均值计数。
1.2.4 紫杉醇耐药实验 SKOV-3细胞分别加入含有BME培养基、 胶原蛋白Ⅰ培养基、TZ028和TZ029材料的96孔板中,每孔1×104个细胞;放入培养箱培养72 h。96孔板中按照组别加入含紫杉醇的DMEM的完全培养基100 μl(每孔),使其终浓度分别达到100 μmol·L-1。培养箱中培养72 h后,加入20 μl(每孔)MTT溶液反应4 h,加入50 μl(每孔)SDS三联溶解液。在酶联免疫检测仪570 nm处测量各孔的OD值,同时设置2D培养组及空白对照孔。
1.3 主要观察指标
(1) SKOV-3细胞在TZ028和TZ029材料中生长情况,绘制生长曲线;
(2) 对比BME培养基和胶原蛋白Ⅰ培养基,研究SKOV-3细胞在TZ028和TZ029材料中的迁移、侵袭能力;
(3) 对比2D培养,SKOV-3细胞在TZ028、TZ029、BME培养基和胶原蛋白Ⅰ培养基中3D培养对紫杉醇的耐药性研究。
1.4 统计学处理
以上实验全部重复3次,取平均值,所有数据均采用SPSS 17.0统计分析软件包进行处理,P<0.05为差异有统计学意义。
2 结 果
SKOV-3细胞在TZ028和TZ029培养基中培养72 h后,呈黏附、生长、增殖,形成细胞团块结构(图1A),两材料间无明显差别。于第1~10天细胞团块不断增大,结构致密,细胞表现出快速生长状态(图1B)。第10~15天细胞增长处于平台期,更换培养液已无法维持细胞团块的进一步增长,细胞生长处于缓慢或停滞状态(图1C)。其后至第20天,由于3D培养基及更换培养液不能再继续支持细胞团块的生长和增大,细胞开始出现皱缩、凋亡(图1D)。SKOV-3细胞生长曲线(图2)显示,TZ028和TZ029培养基中3D培养SKOV-3细胞至第10~15天,细胞生长状态好,处于平稳阶段,适合进行药物筛选和肿瘤细胞学的相关研究。

图1SKOV-3细胞在TZ029培养基中进行培养×100
A.第1天; B.第10天; C.第15天; D.第20天; 刻度单位:100 μm
Fig1ObservationofSKOV-3cellsculturedinTZ029(×100)
A.1st day; B.10th day; C.15th day; D.20th day; Scale bar:100 μm

图2SKOV-3细胞在TZ028和TZ029培养基中3D培养的生长曲线
Fig2StandardgrowthcurvesofSKOV-3cells3DculturedinTZ028orTZ029
Transwell实验结果表明,SKOV-3细胞在TZ028(图3A)和TZ029(图3B)培养基中表现出强于BME(图3C)和类似于胶原蛋白Ⅰ(图3D)培养基的细胞侵袭力(P>0.05),说明对SKOV-3细胞迁移力的影响类似。经过特定区域的细胞计数结果(图4)显示,TZ028和TZ029培养基中SKOV-3细胞侵袭力优于BME培养基组(P<0.05),但前两者之间没有差异(P>0.05)。表明TZ028和TZ029培养基与市售的3D培养基相比,能够模拟体内的肿瘤细胞迁移和侵袭所需的内环境。由于市售的BME培养基的浓度(15.04 mg·ml-1)大于胶原蛋白Ⅰ培养基(10 mg·ml-1),SKOV-3细胞为较大体积肿瘤细胞(直径范围50~70 μm)难以快速地在BME培养基中迁移,表现出Transwell实验结果数值明显低于其他材料组。

图3SKOV-3细胞Transwell实验×100
A.TZ028组; B.TZ029组; C.BME组; D.胶原蛋白Ⅰ组; 刻度单位:100 μm
Fig3OpticalmicroscopeimagesofmigratedSKOV-3cellsthroughTZ028,TZ029,CollagenⅠ,andBMEhydrogel(×100)
A.TZ028; B.TZ029; C.BME hydrogel; D.CollagenⅠ;Scale bar:100 μm
紫杉醇耐药实验结果(图5)表明,SKOV-3细胞在TZ028和TZ029材料中形成3D结构对紫杉醇的耐药性要高于2D细胞培养模型(P<0.05)。而在不同的3D培养基中培养的SKOV-3细胞针对紫杉醇的耐药性无明显差别,表现为TZ028和TZ029材料与BME和胶原蛋白 Ⅰ 培养基耐药结果上差异无统计学意义(P>0.05)。
3 讨 论
为了克服卵巢癌耐药和提高疗效,临床上越来越多地使用药物联合治疗方案[4-6],但是怎样才能寻找到最佳的联用方案?在开展昂贵的临床试验前,模拟体内环境的3D培养模型可能成为方便快速的筛选联合用药最佳方案[7]。3D培养模型中候选药物与肿瘤基质相互作用的研究,可能会有助于分析肿瘤细胞对药物敏感性和耐药性的实际情况。到目前为止,用于肿瘤细胞3D培养的主要是动物性凝胶,如胶原蛋白Ⅰ[8]、明胶[9]、BME提取的BME 胶[10]、少量的合成生物材料如多孔微球或功能化葡聚糖等[11-12]。商业产品如Trevigen公司的胶原蛋白Ⅰ和BME 胶,BD公司的Matrigel 胶,大多都取自鼠尾肿瘤组织或其他动物组织。动物性凝胶的优势在于适合肿瘤细胞的3D生长,但缺点也较明显。如其中含有大量的未鉴定成分,批次间存在差异,影响了对肿瘤细胞的客观和精确的评价;此外,动物性凝胶价格相对昂贵,不利于推广和大规模化应用。合成生物材料中应用最广泛的是水凝胶[13-14],因为水凝胶材料能够比较真实地模拟天然细胞外微环境的很多特征,所以水凝胶类支架材料引起了广泛的注意。PMVE-co-MAH及其水解产物PMVE-co-MA是对人体和动物无毒无害的高分子材料,具有良好的化学稳定性和生物相容性优点,在医药卫生领域中有着非常广泛的应用,如作为药用黏合剂和缓释剂等。本研究自制了TZ028和TZ029材料,一种类似于3D培养的水凝胶,用于SKOV-3细胞若干特性的研究,并与市售BME胶和胶原蛋白Ⅰ胶培养基对比,试图以此水凝胶替代商品化的3D培养基。

aP<0.05; bP>0.05
图4SKOV-3细胞Transwell实验细胞计数
Fig4ThenumberofmigratedSKOV-3cellsthroughTZ028,TZ029,collagenⅠ,andBMEhydrogelinappointedarea
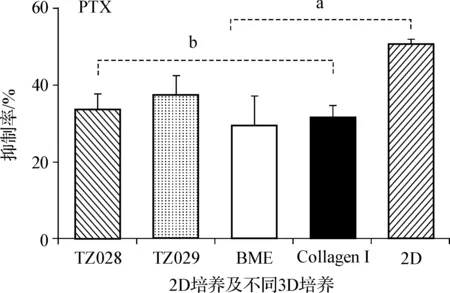
aP<0.05; bP>0.05
图5SKOV-3细胞在不同3D培养和2D培养条件下对紫杉醇耐药实验比较
Fig5EvaluationofthechemoresistanceeffectofTaxolonSKOV-3cellsindifferent3Dculturesystermversus2Done
应用PMVE-co-MAH水解产物PMVE-co-MA和交联剂聚乙二醇进行交联反应,制得可适合用作多种肿瘤细胞3D培养基质的水凝胶。本研究结果显示,SKOV-3细胞可以在TZ028和TZ029 3D培养的水凝胶中黏附、生长、增殖,形成细胞团块结构,第10~15天时达到平台生长期,第15~20天后出现凋亡。提示第10~15天3D细胞培养为最佳细胞模型期,可进行肿瘤细胞生物学、抗肿瘤药物筛选等多项研究。SKOV-3细胞在TZ028和TZ029水凝胶培养中表现出与胶原蛋白Ⅰ培养基相似的细胞侵袭力,且优于BME培养基。在紫杉醇耐药实验中,TZ028和TZ029 3D培养的SKOV-3细胞表现出与胶原蛋白Ⅰ培养基和BME3D培养类似的耐药性,明显比2D培养的SKOV-3细胞更为耐药(P<0.05)。本研究提示,自制的TZ028和TZ029水凝胶与市售的BME培养基和胶原蛋白Ⅰ培养基对细胞迁移和侵袭的影响作用相比,要优于或类似于市售产品,体现较好的生物相容性和体内环境的模拟性。在本实验室,另外一组实验采用人卵巢癌细胞HO8910细胞株,在TZ028和TZ029水凝胶与市售的BME培养基及胶原蛋白Ⅰ培养基的对比研究中,也取得了类似的结果[3]。TZ028和TZ029水凝胶材料与现有的生物来源的细胞3D培养材料相比具有成本更低、生产批次间质量差异小的优点以及多种细胞培养的可重复性,形成的3D培养环境更接近于体内环境。对于药物研究和新药筛选具有更为准确的预测作用,有望广泛应用于医药领域抗肿瘤药物的高通量筛选。
[1] NELSON C M,BISSELL M J.Of extracellular matrix,scaffolds,and signaling:tissue architecture regulates development,homeostasis,and cancer[J].Annu Rev Cell Dev Biol,2006,22:287-309.
[2] 陈峻崧,窦骏.肿瘤细胞及肿瘤干细胞3D培养应用研究进展[J].中国免疫学杂志,2010,26(10):953-956.
[3] ZHANG T Z,CHEN J S,ZHANG Q Y,et al.Poly(ethylene glycol)-cross linked poly(methyl vinyl ether-co-maleicacid)hydrogels for three-dimensional human ovarian cancer cell culture[J].Colloids and Surfaces A:Physicochem Eng Aspects,2013,422:81-89.
[4] CANNISTRA S A.Cancer of the ovary[J].N Eng J Med,2004,351:2519-2529.
[5] ATTAR R,ATTAR E.Use of hematopoietic stem cells in obstetrics and gynecology[J].Transfus Apher Sci,2008,38:245-251.
[6] CHEN J S,WANG J,CHEN D Y,et al.Evaluation of characteristics of CD44+CD117+ovarian cancer stem cells in three dimensional basement membrane extract scaffold versus two dimensional monocultures[J].BMC Cell Biology,2013(14):7.
[7] WEIGELT B,BISSELL M J.Unraveling the microenvironmental influences on the normal mammary gland and breast cancer[J].Semin Cancer Biol,2008,18(5):311-321.
[8] BESSEA L,COULOMB B,LEBRETON-DECOSTER C,et al.Production of ordered collagen matrices for three-dimensional[J].Biomaterials,2002,23(1):27-36.
[9] WANG L S,CHUNG J E,CHAN P P,et al.Injectable biodegradable hydrogels with tunable mechanical properties for the stimulation of neurogenesic differentiation of human mesenchymal stem cells in 3D culture[J].Biomaterials,2010,31(6):1148-1157.
[10] WEAVER V M,LELIEVRE S,LAKINS J N,et al.Beta4 integrin-dependent formation of polarized three-dimensional architecture confers resistance to apoptosis in normal and malignant mammary epithelium[J].Cancer Cell,2002,2(3):205-216.
[11] 张启英,张天柱,胡克,等.多孔微球在三维细胞培养中的研究进展[J].东南大学学报:医学版,2013,32(1):90-94.
[12] 朱长皓,张天柱,胡克,等.功能化葡聚糖用于三维细胞培养及发展前景[J].东南大学学报:医学版,2013,32(1):80-84.
[13] 孟庆斌,刘克良.肽类自组装研究进展[J].化学进展,2009,21(11):2411-2422.
[14] 刘子佳,米坤,千贵侠,等.自组装纳米短肽RADAl6-I水凝胶在肿瘤细胞三维培养中的应用[J].中国组织工程研究与临床康复,2009,13(8):1468-1471.
