玉屏风散对Hepa1-6肝癌荷瘤小鼠免疫调节的影响
2014-09-12张露蓉姚霏江国荣
张露蓉,姚霏,江国荣
(苏州市中医医院 中医药研究所,江苏 苏州 215009)
大量的免疫学研究证明,肿瘤一旦在机体内发生发展,机体的免疫系统可能通过多种途径参与抗肿瘤的免疫效应,以消除肿瘤细胞或控制肿瘤的生长。中医药抗肿瘤的免疫机制多与其提高机体免疫有关[1-4],如增加巨噬细胞吞噬能力、自然杀伤细胞的杀伤能力,促进淋巴因子、白细胞介素-2(IL-2)的产生,增加T细胞表面IL-受体(IL-2R)的表达、促进T细胞增殖,纠正T细胞亚群紊乱等。
玉屏风散由黄芪、白术、防风组成,具有扶正固表、标本兼治的治疗作用,是增强卫气的首选方剂。现代医学认为卫气与免疫功能紧密相关,药理学研究也证明玉屏风散具有广泛的免疫调节作用[5-6],但其对肿瘤状态下的机体免疫调节报道很少[7-8]。作者所在实验室前期研究结果表明,玉屏风散可抑制Hepa1-6肝癌荷瘤小鼠肿瘤生长,该作用是增强机体免疫和微弱的直接诱导肿瘤细胞凋亡的综合效应(另文发表)。本研究在保证玉屏风散一定抑瘤效应的前提下,观察与分析玉屏风散对肝癌小鼠机体免疫的调节作用及促进抗肝癌免疫反应的特点,为玉屏风散在临床抗肝癌中的合理应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SPF级近交C57BL/6纯系小鼠,雄性,体重18~22 g,购自苏州爱尔麦特科技有限公司实验动物中心,许可证号:SCXK(苏)2009-001。
1.1.2 实验药物 玉屏风散,由黄芪、白术、防风组成。黄芪、白术购自苏州市春晖堂药业有限公司,批号均为100601;防风购自苏州市天灵中药饮片有限公司,批号101115-1。按黄芪∶白术∶防风为3∶1∶1的比例,加入8倍量低温水,浸泡0.5 h,回流提取2次,每次1 h。合并两次滤液,浓缩,得浓度为1.0 g生药·ml-1浓缩液,-4 ℃密封保存备用。
1.1.3 试剂 DMEM培养液(GIBCO公司,批号1320158),胎牛血清(杭州四季青生物工程材料有限公司,批号100511),氟化钠(上海化学试剂供应站,批号890425),FITC的小鼠CD4抗体(eBioscience,批号E00078-133),PerCP-Cy5.5的小鼠CD8a抗体(eBios-cience,批号E08300-1630),FITC的小鼠CD11b抗体(eBioscience,批号E033742),APC的小鼠CD19抗体(eBioscience,批号E030718),PE的小鼠CD80抗体(eBioscience,批号E01355-1630),顺铂(冻干型,山东齐鲁制药有限公司,批号0070171DB),香菇多糖注射液(金陵药业股份有限公司福州梅峰制药厂,批号101001-1),碳酸氢钾、氯化铵、EDTA-Na2等试剂(均为国产分析纯)。
1.1.4 主要仪器 贺利二氧化碳培养箱(美国科峻仪器公司),Leica DMIL倒置显微镜(德国莱卡仪器有限公司),Z 320 K低温高速离心机(德国HERMLE公司),电子天平(瑞士梅特勒-托利多公司),FACS Calibur流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养 小鼠肝癌细胞株Hepa1-6由苏州大学生物医学研究院惠赠,采用含体积分数10%胎牛血清的DMEM(pH 7.0)完全培养液,在37 ℃、体积分数5%CO2条件下常规培养。
1.2.2 Hepa-6肝癌荷瘤小鼠模型的建立和分组处理 小鼠适应性饲养3 d后用于种瘤。取对数生长期的Hepa1-6细胞,消化后用PBS稀释成1× 107ml-1的细胞悬液,接种于小鼠右腋皮下,每只接种体积为0.2 ml。当扪及接种小鼠皮下结节直径约达5 mm时进行随机分组,分为模型对照组(生理盐水组), 阳性药顺铂组(5 mg·kg-1)和香菇多糖组(1.25 mg·kg-1),玉屏风散20、25、30 g生药·kg-1组,每组5只小鼠。分组当天开始给药,顺铂组每3 d腹腔注射1次;其余组每日灌胃2次(间隔12 h进行)。连续给药两周,末次给药12 h后称重,放血后断髓处死小鼠。解剖剥离瘤体、脾脏和胸腺,称重并记录。分别计算抑瘤率、脾脏指数和胸腺指数。计算公式:抑瘤率=[1-(药物组平均瘤质量/模型对照组平均瘤质量)]×100%;脾脏指数=脾脏质量(mg)/小鼠体重(g)×10;胸腺指数=胸腺质量(mg)/小鼠体重(g)×10。
1.2.3 脾细胞悬液的制备 取称重后的小鼠脾脏,剪碎,在毛玻片上磨细,过200目尼龙网,收集滤液,1 000 r·min-1离心5 min,弃上清,加入10~15 ml红细胞裂解液,混悬脾细胞,静置10~20 min后1 000 r·min-1离心5 min,弃上清,再用PBS洗1遍细胞,最后加1 ml流式细胞缓冲液重新悬浮细胞。以上操作均在冰上进行。
1.2.4 免疫荧光标记法测定细胞亚群 于96孔板中加入50 μl 用流式细胞缓冲液悬浮好的脾细胞(每孔1×105~1×106个细胞),加入50 μl已经用流式细胞缓冲液稀释好的各抗体(CD4、CD8、CD11b、CD19和CD80),混匀后4 ℃避光孵育30 min。每孔加入200 μl 流式细胞缓冲液洗涤细胞3遍,1 200 r·min-1离心5 min,弃200 μl上清。再加200 μl 流式细胞缓冲液,转移到流式管中,流式细胞仪检测。每个样本收集10 000个细胞用于数据分析,采用FLOWJO软件处理样品数据。
1.3 统计学处理
2 结 果
2.1 玉屏风散对Hepa1-6肝癌荷瘤小鼠肿瘤生长的抑制
与模型对照组比较,玉屏风散组的肿瘤质量呈现下降趋势,且具有一定的剂量依赖性(玉屏风散20、25和30 g生药·kg-1组的抑瘤率依次为18.86%、28.81%和37.44%);其抑瘤效应与香菇多糖组(35.19%)相近,明显弱于顺铂组(54.19%)。见图1,提示玉屏风散可抑制Hepa1-6肝癌荷瘤小鼠的肿瘤生长。
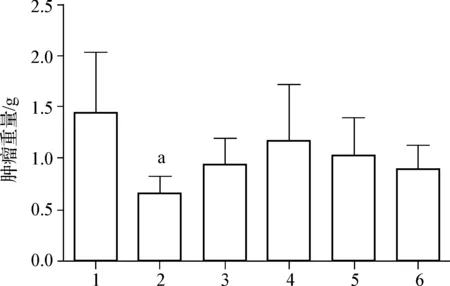
1.模型对照组; 2.顺铂组; 3.香菇多糖组; 4.玉屏风散20 g生药·kg-1组; 5.玉屏风散25 g生药·kg-1组; 6.玉屏风散30 g生药·kg-1组; a 与模型对照组比较,P<0.05
图1玉屏风散对Hepa1-6肝癌小鼠肿瘤生长的抑制作用
Fig1YPFsuppressedthetumorgrowthintheHepa1-6hepatoma-bearingmice
2.2 玉屏风散对Hepa1-6肝癌荷瘤小鼠胸腺和脾脏的影响
与模型对照组相比,玉屏风散组胸腺质量和胸腺指数均无显著变化;脾脏质量和脾脏指数呈现上升趋势,玉屏风散30 g生药·kg-1组较模型对照组差异有统计学意义(P<0.05)。见图2,表明玉屏风散在抑制肿瘤时对脾脏有促进作用,但对胸腺无影响。
2.3 玉屏风散对Hepa1-6肝癌小鼠脾脏中B细胞活化的影响
以CD19+代表B细胞,CD19+CD80+代表活化的B细胞分析:与模型对照组相比,玉屏风散组CD19+B细胞比例无变化,但其数量有所增加;其中玉屏风散25、30 g生药·kg-1组CD19+B细胞数量显著增加(P<0.05)。见图3。进一步研究显示,玉屏风散25、30 g生药·kg-1组CD19+CD80+细胞比例显著增加(P<0.01)。结果显示玉屏风散使用后可促进肝癌小鼠脾脏中B细胞的活化,提示玉屏风散能够促进肿瘤状态下体液免疫细胞的活化。


A B
A.玉屏风散对胸腺和脾脏质量的影响; B.玉屏风散对胸腺和脾脏指数的影响; 1.模型对照组; 2.玉屏风散20 g生药·kg-1组; 3.玉屏风散25 g生药·kg-1组; 4.玉屏风散30 g生药·kg-1组; a 与模型对照组比较,P<0.05
图2玉屏风散对Hepa1-6肝癌荷瘤小鼠胸腺和脾脏的影响
Fig2EffectofYPFontheweightandcoefficientofthymusandspleenintheHepa1-6hepatoma-bearingmice
A.Effect of YPF on the weight of thymus and spleen; B.Effect of YPF on the coefficient of thymus and spleen
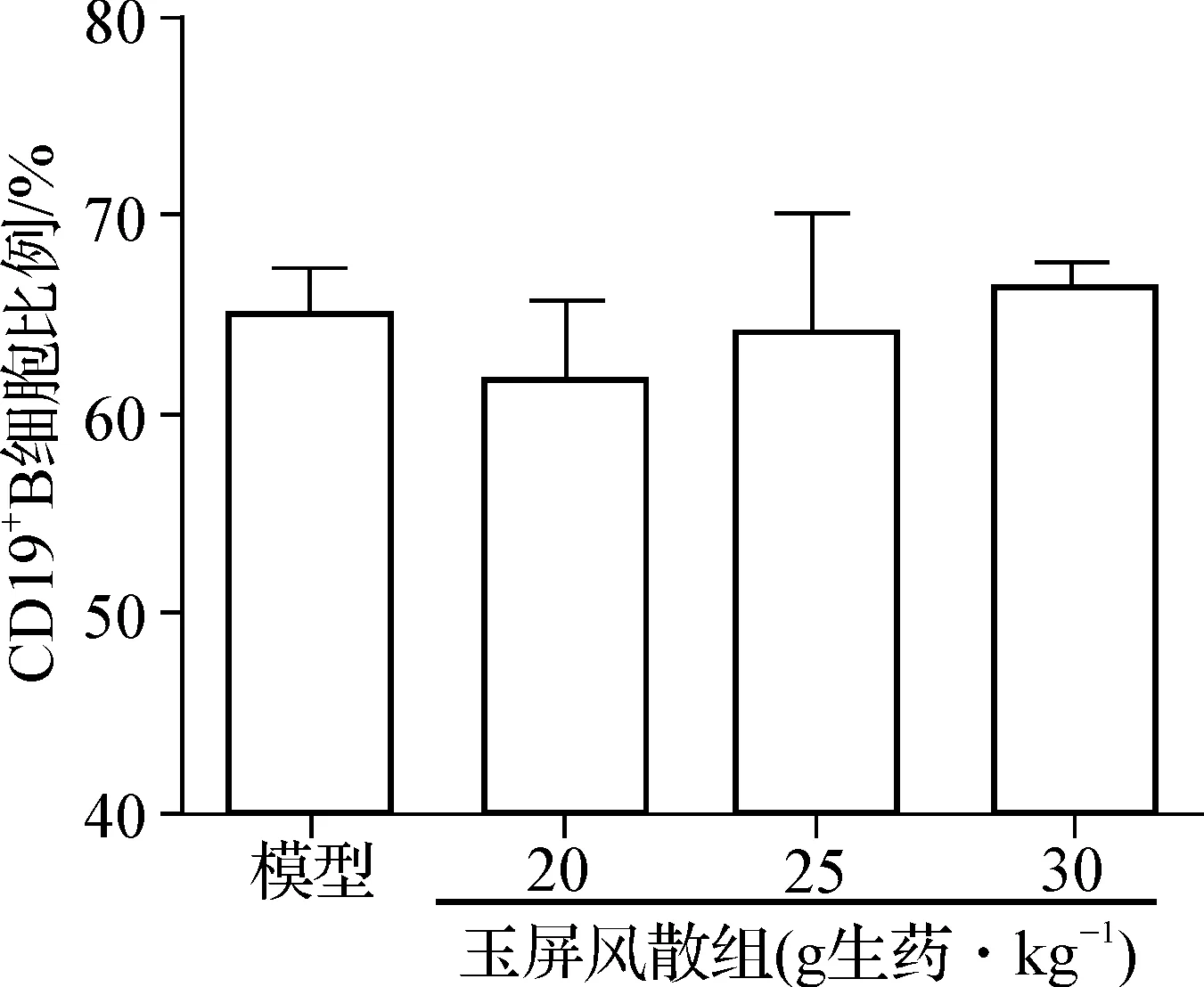


A B C
A.玉屏风散对CD19+B细胞比例的影响; B.玉屏风散对CD19+B细胞数量的影响; C.玉屏风散对CD19+CD80+B细胞比例的影响;与模型对照组比较:aP<0.05,bP<0.01
图3玉屏风散对Hepa1-6肝癌荷瘤小鼠脾脏B细胞的影响
Fig3EffectofYPFonthespleenBcellsintheHepa1-6hepatoma-bearingmice
A.Effect of YPF on the CD19+B cells proportion;B. Effect of YPF on the CD19+B cells number;C.Effect of YPF on the CD19+CD80+B cells proportion
2.4 玉屏风散对Hepa1-6肝癌小鼠脾脏中巨噬细胞的影响
以CD11b+代表活化的巨噬细胞,与模型对照组比较,玉屏风散组脾巨噬细胞比例和数量均增加,其中玉屏风散20、30 g生药·kg-1组差异具有统计学意义(P<0.05,P<0.01,图4)。结果显示玉屏风散使用后可增加肝癌小鼠的脾巨噬细胞比例和数量,且随着剂量增大有所增加,提示玉屏风散能促进肿瘤状态下非特异性免疫细胞的活化。
2.5 玉屏风散对Hepa1-6肝癌小鼠T细胞的影响
2.5.1 玉屏风散对Hepa1-6肝癌小鼠脾脏中T细胞的影响 与模型对照组比较,玉屏风散组脾脏中CD4+T和CD8+T细胞比例均无变化(P>0.05);而CD4+T和CD8+T细胞数量均为增加,其中玉屏风散25、30 g生药·kg-1组差异具有统计学意义(P<0.05)。见图5。结果表明玉屏风散使用后,可增加肝癌小鼠脾脏中的T细胞数量。
2.5.2 玉屏风散对Hepa1-6肝癌小鼠肿瘤中T细胞的影响 与模型对照组比较,玉屏风散组肿瘤组织中


A B
A.玉屏风散对巨噬细胞比例的影响; B.玉屏风散对巨噬细胞数量的影响; 与模型对照组比较:aP<0.05,bP<0.01
图4玉屏风散对Hepa1-6肝癌荷瘤小鼠脾脏中巨噬细胞的影响
Fig4EffectofYPFonthespleenmacrophagecellsintheHepa1-6hepatoma-bearingmice
A.Effect of YPF on the macrophage cells proportion; B.Effect of YPF on the macrophage cells number


A B
A.玉屏风散对CD4+和CD8+T细胞比例的影响; B.玉屏风散对CD4+和CD8+T细胞数量的影响; 1.模型对照组; 2.玉屏风散20 g生药·kg-1组; 3.玉屏风散25 g生药·kg-1组; 4.玉屏风散30 g生药·kg-1组; a与模型对照组比较,P<0.05
图5玉屏风散对Hepa1-6肝癌荷瘤小鼠脾脏中CD4+T和CD8+T细胞的影响
Fig5EffectofYPFonthespleenCD4+TandCD8+TcellsintheHepa1-6hepatoma-bearingmice
A.Effect of YPF on the CD4+and CD8+T cells proportion; B.Effect of YPF on the CD4+and CD8+T cells number
CD4+T和CD8+T细胞比例均显著增加(P<0.05,P<0.01,图6),表明使用玉屏风散可使肿瘤组织中T细胞比例增加,提示玉屏风散可能促进大量T细胞募集至肿瘤组织。
3 讨 论
在整体抑瘤实验中,玉屏风散20、25、30 g生药·kg-13个剂量组均表现出一定的抑瘤作用,抑瘤率依次为18.86%、28.81%和37.44%,低于化疗药顺铂组的54.19%,与免疫增强剂香菇多糖组(35.19%)相近。而前期实验结果显示,玉屏风散25 g生药·kg-1对Hepa1-6荷瘤裸鼠的肿瘤无抑制作用,30 g生药·kg-1则呈现微弱的抑制作用(抑制率为9.55%)。裸鼠由于无胸腺,为免疫缺陷的小鼠。肿瘤移植于裸鼠,能保持其生物学特性,用于研究药物直接杀伤肿瘤细胞的效应。而C57小鼠为免疫健全小鼠,其体现的药物抗肿瘤效应为直接杀伤和免疫增强的综合作用。因此,玉屏风散对裸鼠和C57小鼠抗肝癌效应的差异,可推测玉屏风散的抗肝癌作用主要是通过增强机体免疫功能而发挥的抑瘤效应。因此,本研究针对玉屏风散调节肝癌小鼠机体抗肿瘤免疫反应展开研究。
一些免疫抑制剂可使胸腺、脾脏等免疫器官萎缩;而免疫增强剂可使它们增重。因此,免疫器官质量的变化可作为观察药物对免疫影响的指标之一[9]。本研究选用中枢免疫器官胸腺和外周免疫器官脾脏,观察肝癌小鼠给予玉屏风散后对它们质量及脏器指数的影响。结果显示玉屏风散对胸腺质量和胸腺指数均无影响。胸腺是T细胞分化发育的场所,发育成熟的T细胞再经血液迁移到脾、淋巴结等。本研究同时观察到玉屏风散可增加肝癌小鼠脾脏中的T细胞数量和肿瘤组织中的T细胞比例,推测玉屏风散在促进胸腺T细胞成熟的同时,可促进成熟T细胞向脾脏、肿瘤等迁移,表现出对肝癌小鼠胸腺无影响的现象。本研究还观察到玉屏风散可以增高脾脏质量和脾脏指数,但脾脏质量和指数还不能完全反映免疫系统的活化程度,因此后续的流式细胞术检测免疫细胞亚群的活化更能够反映免疫系统的活化程度。

1.模型对照组; 2.玉屏风散20 g生药·kg-1组; 3.玉屏风散25 g生药·kg-1组; 4.玉屏风散30 g生药·kg-1组; 与模型对照组比较:aP<0.05,bP<0.01
图6玉屏风散对Hepa1-6肝癌荷瘤小鼠肿瘤中CD4+T和CD8+T细胞比例的影响
Fig6EffectofYPFontheproportionofCD4+TandCD8+TcellsintheneoplastictissuesoftheHepa1-6hepatoma-bearingmice
CD19是B细胞表面的糖基化Ⅰ型跨膜蛋白,在骨髓B祖细胞即开始表达,持续整个B细胞成熟期,是最早发现的B细胞系表面标志;而CD80在静息B细胞不表达或低表达,在活化B细胞表达增强。CD11b是CD11c-β2整合素黏附分子,活化的巨噬细胞表面表达CD11b。因此,本研究选用CD19+CD80+和CD11b+分别作为B细胞和巨噬细胞的活化评价指标。研究结果显示:使用玉屏风散,可显著增加脾脏中CD19+细胞数量和CD19+CD80+细胞比例,以及活化的巨噬细胞比例和数量(P<0.05,P<0.01),提示玉屏风散具有促进肿瘤状态下B细胞和巨噬细胞的活化从而抑制肿瘤生长的效应。
目前认为机体抗肿瘤的免疫机制主要是细胞免疫,体液免疫通常仅在某些情况下起协同作用;而且发挥细胞免疫效应的免疫细胞主要包括T淋巴细胞、NK细胞、巨噬细胞等,其中T细胞介导的特异性免疫应答在对抗原性较强的肿瘤细胞所产生的免疫应答中起很重要的作用。本研究结果显示,使用玉屏风散可增加肝癌小鼠脾脏中CD4+T和CD8+T细胞数量以及肿瘤组织中的比例(P<0.05,P<0.01)。表明玉屏风散在促进脾脏T细胞数量增多的同时,有助于T细胞募集至肿瘤组织等免疫效应,而发挥其抗肿瘤的作用。
综上研究结果提示,玉屏风散的干预可促进肝癌荷瘤小鼠的抗肿瘤免疫反应,提高其体液免疫和细胞免疫应答水平,从而发挥其抑制肿瘤生长的效应。玉屏风散通过以提高特异性细胞免疫为主的多环节、协同免疫调控,体现了玉屏风散“扶正固本,标本兼治”的巧妙组方。本研究为玉屏风散在临床抗肝癌中的合理应用提供了实验依据。
[1] 杜鹃.中药抗肿瘤免疫的进展[J].中医药临床杂志,2004,16(5):507-509.
[2] 杜建.中药抗肿瘤机制研究进展[J].福建中医学院学报,2009,19(4):1-5.
[3] 林琳,沈洪,王立新,等.黄芪甲苷、β-榄香烯对小鼠树突状细胞免疫功能的影响[J].东南大学学报:医学版,2011,30(2):294-297.
[4] MENG M B,CUI Y L,GUAN Y S,et al.Traditional Chinese medicine plus transcatheter arterial chemoembolization for unresectable hepatocellular carcinoma[J].J Altern Complement Med,2008,14(8):1027-1042.
[5] 周若梅,李来秀.玉屏风散口服液的药理学研究[J].陕西中医,2004,25(1):71-73.
[6] 周春权,姚欣,林静瑜,等.玉屏风散粗多糖的提取及药理实验[J].海峡药学,2004,16(2):38-40.
[7] 张红军,鞠宝玲,胡艳君,等.玉屏风散对荷瘤小鼠肿瘤生长及IL-2与IL-2R基因表达的影响[J].医学信息,2008,21(5):656-659.
[8] 张红军,唐小云,鞠宝玲,等.玉屏风散对S180荷瘤小鼠肿瘤生长及免疫功能的影响[J].细胞与分子免疫学杂志,2008,24(7):683-685.
[9] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:712-713.
