内皮素-1与CGRP对血管平滑肌细胞表型转化及增殖的影响及机制
2014-09-12温世奇
温世奇 陈 泉
(甘肃省人民医院血管外科,甘肃 兰州 730000)
血管平滑肌细胞(VSMC)由收缩型向合成型转化而导致增殖增加是动脉粥样硬化及血管成型术后再狭窄等多种心血管疾病的共同基础〔1,2〕。血管成型术后,局部损伤的内皮细胞可以产生大量内皮素1(ET-1),从而影响血管中膜平滑肌细胞的表型及增殖。而在体内应用CGRP可明显减少内皮剥脱术后血管平滑肌细胞增殖及内膜增厚,且CGRP可抑制由ET诱导的VSMC增殖,但ET-1与CGRP影响VSMC表型转化及增殖的分子机制尚不十分清楚〔3〕。另外,在发生表型转化的过程中,存在细胞骨架重构,而细胞骨架重构又是VSMC发生表型转化过程中细胞发生迁移增殖等过程的基础〔4〕。ET-1与CGRP是否可通过细胞骨架蛋白影响VSMC的增殖和表型转化有待进一步研究。本文拟探讨ET-1与CGRP之间的相互作用,及通过细胞骨架蛋白对细胞表型转化、增殖产生的影响。
1 材料与方法
1.1试剂 胎牛血清,购自杭州四季清生物公司,M199培养基购自Gibco公司,real-time PCR试剂盒购自大连TaKaRa公司,ET-1与CGRP均购自Calbiochem公司,引物由北京博奥森生物工程公司合成。
1.2细胞鉴定及培养 首先取脐动脉中膜层,运用组织块培养法,将其剪成1 mm3小块,并转移至培养瓶内进行贴壁培养。将细胞传代5代以上用于实验。运用免疫细胞化学法鉴定分离细胞是否为VSMC。在VSMC胞质内可见到棕黄色颗粒,细胞核呈蓝色,即可证明是VSMC〔5〕。
1.3MTT法测定ET-1及加入CGRP对VSMC生长的影响 实验分为对照组(不加ET-1或CGRP),ET-1组,ET-l+CGRP组。按2.0×104/cm2浓度将VSMC种植于96孔板,每组3个复孔,并且在不同时间段运用酶标仪测其OD值。
1.43H-TdR法检测ET-1及加入CGRP对VSMC DNA合成的影响 取处于对数生长期的细胞,将细胞以4×104/ml浓度接种于96孔培养板中,分组同上,ET-1组每孔加入含有100 nmol/L ET-1,ET-1+CGRP组每孔加100 nmol/L ET-1和200 nmol/L CGRP的培养液。在不同时间段各取6个孔细胞,并向每孔中加1 μmol/L Ci3H-TdR、0.3 ml 0.3 mol/L NaOH处理,用液闪仪测定每分钟脉冲数(cpm)。
1.5流式细胞仪测ET-1及加入CGRP对VSMC增殖周期的影响 以5×105接种细胞于培养瓶内且使细胞同步化,48 h后再换成含ET-1(100 nmol/L)或ET-1(100 nmol/L)+ CGRP(200 nmol/L) 培养基继续培养,分别在12、24、36、48、72 h收集一瓶细胞,运用流式细胞仪测定细胞周期(FCM)。
1.6实时荧光定量法测ET-1及加入CGRP对VSMC骨架蛋白及表型的影响 在ET-1或ET-1+CGRP作用1、2、3、6、7 d后抽提mRNA。先运用逆转录法合成cDNA,再进行实时定量PCR扩增。按照TaKaRa试剂盒说明书采用实时荧光定量PCR检测法检测VSMC骨架蛋白α肌动蛋白(α-SMA)、Desmin及SM22α基因的表达,引物序列:SM22α上游5′-TTCTGCCTCAACATGGCCAAC-3′,下游5′-CACCTTCACTGGCTTGGATC-3′;α-SMA上游5′-GTGGTCAGGAATAGATGTG-3′,下游5′-CTAGCTGTGAAGTCAGTGT-3′;Desmin上游5′-TCTTTATTGTTTCTGTCCAGGG-3′,下游5′-GGAAGGTCAAGAGAGAATGTCG-3′;GAPDH上游5′-TCCCTCAAGATTGTCAGCAA-3′,下游5′-AGATCCACAACGGATACATT-3′。
1.7统计学处理 采用SPSS18.0软件行t检验。
2 结 果
2.1ET-1及CGRP对VSMC生长的影响 随培养时间延长,ET-1组对VSMC生长的促进作用明显优于对照组及ET-1+CGRP组(P<0.05),加入CGRP明显逆转ET-1的促增殖作用(P<0.05),见图1。
2.2ET-1及CGRP对VSMC DNA合成的影响 与对照组比较,ET-1可以明显促进VSMC DNA的合成,并于48 h达到高峰,之后进入平台期(P<0.05),加入CGRP后明显逆转ET-1促进DNA合成作用(P<0.05),见图2。
2.3ET-1及CGRP对VSMC增殖周期的影响 随时间延长,12、24、36、48、72 h ET-1组细胞G0/G1期比例减少,S期细胞比例增多(P<0.05),ET-1+CGRP组与ET-1组比较明显降低S期细胞比例(P<0.05),见图3。
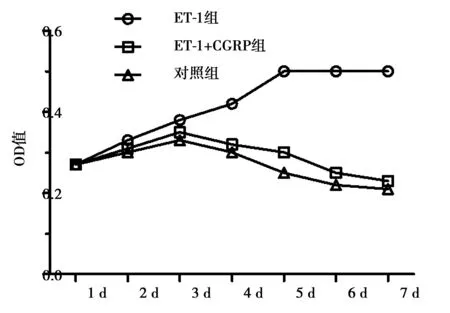
图1 ET-1及加入CGRP后对VSMC生长的影响
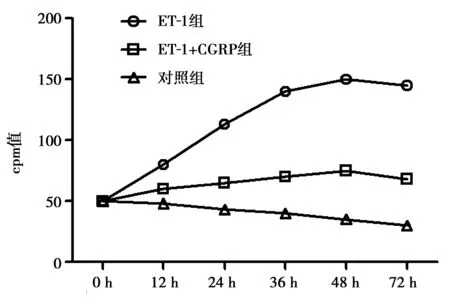
图2 ET-1及加入CGRP后对VSMC DNA合成的影响

图3 ET-1作用及加入CGRP后对VSMC增殖周期的影响
2.4ET-1及CGRP对VSMC表型及骨架蛋白的影响 ET-1及CGRP作用于VSMC 48 h后,与对照组及ET-1+CGRP组比较,ET-1组明显降低收缩型VSMC表面标记SM22α mRNA表达量(P<0.05);ET-1+CGRP组与对照组相比,SM22α mRNA表达量没有显著变化(P>0.05);ET-1及CGRP作用于VSMC 48 h后,与对照组相比,ET-1组能明显降低细胞骨架蛋白α-SMA及Desmin的表达量(P<0.05),而ET-1+CGRP组无明显变化(P>0.05);ET-1+CGRP组与ET-1组比较明显能增加α-SMA及Desmin的表达(P<0.05),见图4。
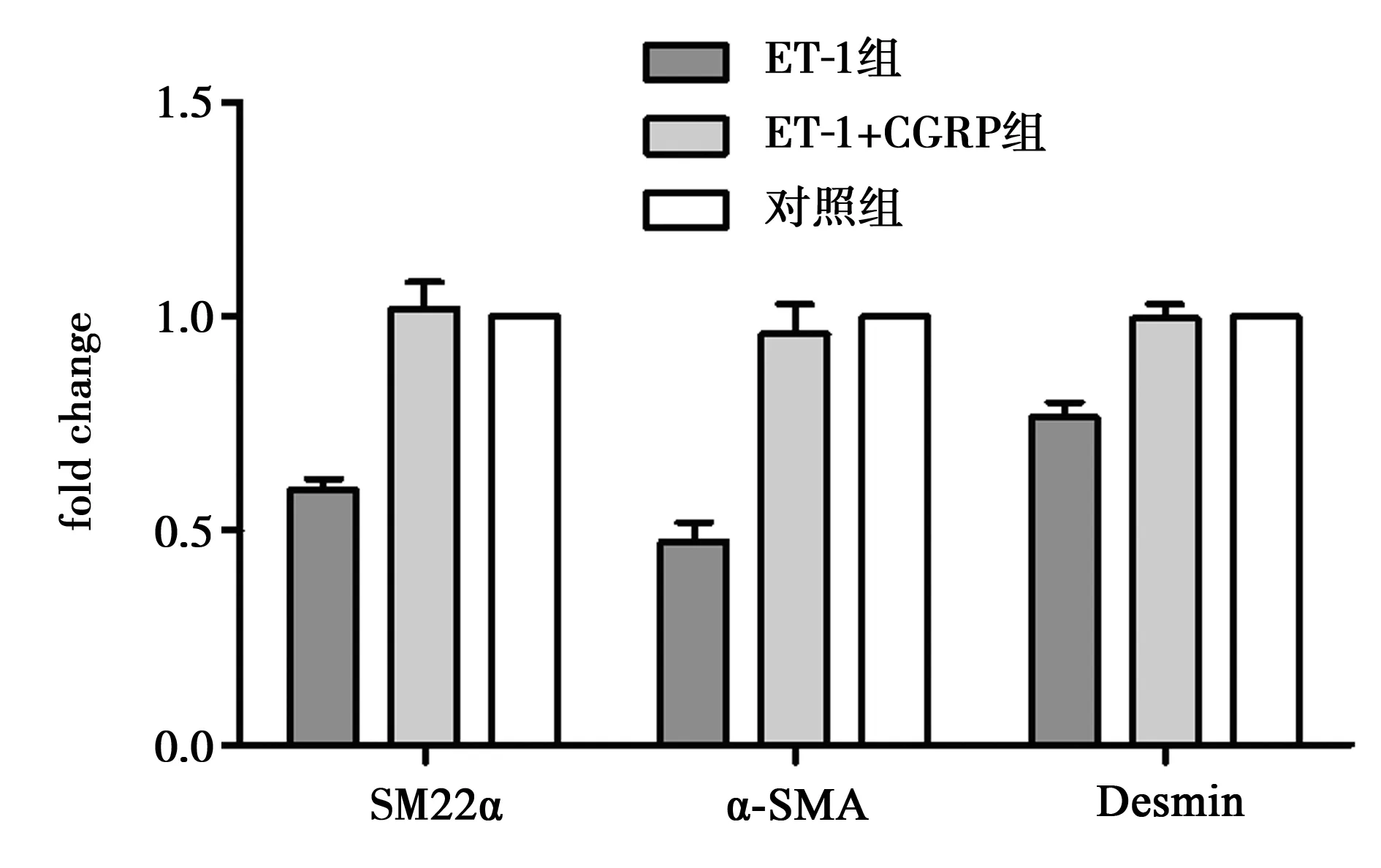
图4 ET-1及加入CGRP后对VSMC细胞表型及骨架蛋白的影响
3 讨 论
研究显示,血管内皮损伤后,可释放出多种细胞因子诱导VSMC发生表型转化及增殖〔6〕,当细胞由收缩型转化为合成型后极易进入细胞周期而发生增殖,从而由中膜向内膜迁移〔7〕。SM22α为收缩型VSMC的标志基因,仅在收缩型VSMC中表达,它的表达量上调与下调标志着收缩型VSMC数量的增加与减少。
本研究发现,ET-1可促进VSMC的生长,在加入ET-1后,细胞生长明显加快,在第5天即达高峰,而不加ET-1及ET-1+CGRP组细胞生长较慢。另外,ET-1对VSMC DNA的合成也具有促进作用,还可促进平滑肌细胞增殖周期,使G0/G1期细胞比例随着增殖时间的延长而逐渐减少,S期细胞比例逐渐增高。ET-1可使 SM22α基因表达降低,并且细胞骨架蛋白α-SMA及Desmin表达量也降低,促进VSMC由收缩型向合成型的转化。因此,若针对VSMC增殖的S期运用ET-1拮抗剂可能阻断细胞增殖,进而达到预防动脉粥样硬化、再狭窄等作用。
另外,本研究发现以上ET-1产生的促进效应均可被CGRP逆转,它可拮抗ET-1引起的VSMC细胞增殖及表型转化,提示CGRP对VSMC具有保护作用。动物实验证明,CGRP能够拮抗ET-l引起的血管收缩效应;也有人证实CGRP和ET-1对VSMC的表型转化和增殖具有相互调节的拮抗作用〔3〕,但具体机制尚不十分清楚。另外,在发生表型转化的过程中,存在细胞骨架重构,而细胞骨架重构又是VSMC发生表型转化过程中细胞迁移增殖等过程的基础〔4〕。SM22α是收缩型VSMC标志基因之一,它仅表达于收缩型VSMC中,这种表达特点提示该蛋白可能参与VSMC表型转化的调控过程,从而影响VSMC的增殖过程。目前,有关血管重塑过程中SM22α调节VSMC表型转化的研究尚不多见。有研究发现,SM22α可阻止VSMC由收缩型向合成型转化进而限制动脉粥样硬化斑块的生长〔8〕。另有研究〔9〕显示,不同的培养条件可影响骨架蛋白表达及VSMC的表型转化。
本实验还发现ET-1下调SM22α,促进其表型由收缩型向合成型转变,而CGRP上调SM22α,阻止其表型由收缩型向合成型转变。在VSMC中,α-SMA是构成微丝的基本成分,SM22α及α-SMA均属于肌动蛋白,Desmin是中间丝蛋白,对细胞骨架蛋白Z形连接以及质膜和细胞核间的连接发挥重要作用。本实验发现这两种基因变化趋势与SM22α一致,在ET-1组处于低水平状态,而在ET-1+CGRP组处于上调状态,这些结果均提示,ET-1及CGRP可能通过SM22α、α-SMA及Desmin调节VSMC表型转化和增殖。
但是,本实验只是定性探讨了CGRP对ET-l诱导的VSMC表型变化和增殖有抑制作用,有必要下一步在剂量依赖性和时间依赖性上进一步研究,以期进一步了解其作用机制。
4 参考文献
1刘沙沙,赵连友,胡中伟,等.拉西地平对高温高湿应激大鼠血管平滑肌细胞GRP78和CHOP表达的影响〔J〕.现代生物医学进展,2011;11(7):1241-5.
2牛建平,周志斌,史树海,等.分化型血管平滑肌细胞的原代培养〔J〕.中华老年心脑血管病杂志,2008;10(12):928-30.
3徐红涛.ET-1和CGRP对大鼠血管平滑肌细胞表型转化和增殖的影响〔D〕.苏州:苏州大学,2007.
4喻 丹,张培军,Zhan XS,等.肌动蛋白及微丝相关蛋白2/3复合物介导的细胞运动的分子机制〔J〕.生命的化学,2005;25(3):226-8.
5张英民,党红波,王克强,等.ET-1促进人血管平滑肌细胞的表型变化和增殖〔J〕.解剖学杂志,2003;26(3):215-8.
6贺 蕾,于 建,杨雨旺,等.辛伐他汀对不稳定性心绞痛患者血管内皮功能纤溶活性的影响〔J〕.辽宁医学院学报,2012;33(3):251-2.
7邓志生,朱鹏立.血管紧张素Ⅱ对血管平滑肌细胞增殖、迁移作用的信号通路研究〔J〕.心血管康复医学杂志,2011;20(3):286-9.
8程云会,韩 梅,温进坤,等.收缩蛋白在血管新生内膜形成过程中的表达变化及其对血管收缩力的影响〔J〕.中国病理生理杂志,2005;21(11):2111-5.
9徐益荣,刘 斌,杨亚安,等.不同体外条件培养对大鼠血管平滑肌细胞表型、增殖和细胞骨架的影响〔J〕.解剖学报,2010;41(2):241-6.
