氧化樟脑注射液对心肺复苏后大鼠心、脑、肾细胞超微结构的保护作用
2014-09-12贾秋颖
贾秋颖
(长春中医药大学附属医院,吉林 长春 130000)
近年国外对心肺复苏(CPR)后心脏、大脑单个器官研究发现〔1〕,CPR后引起器官急性损伤的原因很多,但主要为心跳骤停期间组织严重缺血缺氧以及复苏后组织再灌注所致,也称再灌注损伤,缺血再灌注可导致全身炎症反应综合征,过度炎症反应可导致多器官功能障碍,出现多器官功能障碍综合征(MODS)。多器官功能衰竭(MOF)是危重病患者主要死亡原因,目前CPR后多器官损伤的研究甚少,本实验采用SD大鼠心跳骤停-CPR模型,了解复苏后多器官组织细胞(心肌细胞、脑神经细胞、肾小管上皮细胞)超微结构的损伤,并用改善线粒体能量代谢的药物氧化樟脑进行干预,评价氧化樟脑防治复苏后多器官组织细胞急性损伤的效果,为临床防治MODS/MOF寻找新的有效药物。
1 材料和方法
1.1实验动物及分组 雄性健康(SD)大鼠24只,体重(274.96±29.59)g,日龄49~60 d,由中国科学院上海分院实验动物中心提供。将SD大鼠随机分为:对照组、常规复苏组、氧化樟脑治疗组。
1.2CPR模型的制备 术前禁食12 h,颈部正中切口,行气管插管,分别于左侧颈外静脉、右侧颈总动脉置管,监测动脉及血压,心电图及直肠温度。操作完成并稳定30 min后经颈静脉注射肌松剂(琥屋后 酰胆碱,0.15 mg/100 g)抑制呼吸合并0.5 mol/L冰氯化钾(4℃,0.12 ml/100 g)停跳液致致大鼠心跳骤停 ,持续5 min后行CPR,出现自主心律、脉搏波、收缩压≥60 mmHg,持续10 min以上判定为自主循环恢复(ROSC),2 h后逐步撤离呼吸机,拔除气管插管和动静脉导管并缝合伤口。氧化樟脑治疗组于心跳恢复时给予氧化樟脑(按2支/10 ml)生理盐水稀释后腹腔注入,复苏后12 h再给同等剂量,常规组腹腔注射生理盐水0.3 ml,对照组仅进行插管等手术操作,不进行心跳骤停和心肺复苏。所有实验参数设计和记录均参照实验研究的Utstein模式〔2〕。
1.3标本采集 术后24 h采血,并取左心室心肌、左侧颞叶皮质区脑皮质、左肾上极髓质组织,用锐利刀片切成1 mm3大小3块,放入2.5%戊二醛液中固定冷藏,用于透射电镜观察组织细胞超微结构的变化。
1.4电镜标本检测2.5%戊二醛预固定,0.1 mol/L PBS液漂洗,2%锇酸后固定2 h,酒精丙酮梯度脱水,Epon812环氧树脂埋,制备半薄切片定位后,超薄切片用醋双氧铀和柠檬酸染色,日立HE-800透射电镜下观察。
2 结 果
2.1心肌细胞透射电镜(TEM)结果 对照组(图1A)心肌细胞结构正常:核位于中央,染色质分布均匀,线粒体呈短粗状,嵴排列整齐,心肌纤维排列规则。而常规复苏组(图1B)可见明显心肌细胞损伤,细胞正常形态消失,核变形、溶解,线粒体肿胀、嵴断裂、甚至空泡化,心肌纤维断裂,排列紊乱,部分肌丝溶解。氧化樟脑治疗组(图1C)心肌细胞核形态基本正常,少数细胞线粒体肿胀、部分心肌纤维断裂,排列尚规则有序。
2.2脑细胞TEM结果 对照组(图2A)脑神经元结构正常:核位于中央,染质分布均匀,线粒体峭排列整齐,核糖体清晰可见。而常规复苏组(图2B)可见明显神经元损伤,正常形态消失,核变形、固缩,线粒全肿胀、嵴断裂、甚至空泡化,胞浆空泡化,内质网扩张,部分神经元脱髓鞘。氧化樟脑治疗组(图2C)神经元形态基本正常,仅见少数细胞线粒体胀。
2.3肾脏组织细胞TEM结果 对照组(图3A)肾小管上皮细胞排列整齐,细胞核椭圆形,染色质分布均匀,线粒体嵴排列整齐,无断裂,胞浆中可见粗面内质网及核糖体。而常规复苏组(图3B)可见肾小管细胞损伤明显,正常形态消失,可见凋亡小体,线粒体肿胀、嵴断裂、部分线粒体空泡化,内质网扩张,内池分离。氧化樟脑治疗组(图3C)肾小管细胞基本完整,少数细胞线粒体肿胀。
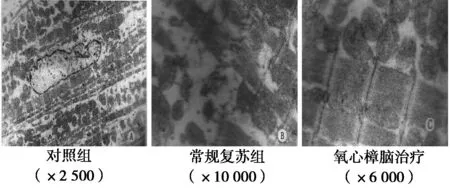
图1 心肌细胞TEM结果

图2 脑细胞TEM结果

图3 肾脏组织细胞TEM结果
3 讨 论
本次研究结果提示心肺复苏后SD大鼠心、脑、肾细胞出现急性损伤,而氧化樟脑可减轻心、脑、肾细胞急性损伤。缺血再灌注的概念首先由Jennings于1960年提出,但缺血再灌注损伤的发生机制至今尚未完全阐明,目前认为能量代谢障碍是其发病的基础,自由基的作用和细胞内钙超载是其重要发病环节。器官、组织缺血再灌注损伤可诱导细胞凋亡与坏死,此过程首先是通过线粒体水平-系列复杂的变化发生的,包括三羧酸循环障碍、氧自由基的产生、膜通透性的改变、钙向线粒体内转移、凋亡因子的释放等〔3〕。Milei等〔4〕研究发现,缺血再灌注后心肌超微结构有明显变化,在线粒体水平变化尤其显著,此变化主要与氧化应激有关。大脑缺血后最初的超微结构改变是线粒体肿胀,这在80年代就有报道。
目前有关于线粒体在决定脑细胞死亡和再灌注损伤中潜在作用的研究〔5~7〕,发现再灌注可产生快速的线粒体损伤,包括线粒体裂解、浓缩、基质密度改变等。Friberg〔8〕研究认为再灌注时神经细胞暴露于氧自由基、炎性介质中,氧化应激反应使得线粒体受到极度损伤。Benftez-bribiesca〔2〕发现早期缺血再灌注及组织供氧不足诱导了凋亡,最早的超微结构变化发生在线粒体,线粒体肿胀,嵴断裂,膜渗漏。本研究与以上研究结果相一致,不同的是,本实验同时观察了心、脑、肾多个器官超微结构的变化,而且发现在心肺复苏后24 h,这些器官线粒体几乎发生了同样的超微结构病理改变。氧化樟脑具有减轻心肺复苏后多器官组织细胞急性损伤、保护多器官组织细胞超微结构完整的作用。
4 参考文献
1Peitzman AB,Billiar TR.Hemorrhagic shock〔J〕. Curr Probl Surg,2000;32(11):925-1102.
2Benftez-bribiesca L,Comez-camarillo M,Castellanos-juarez E,etal. Morphologic, biochemical and molecular mitochondrial changes during reperfusion phase following brief renal ischemia〔J〕. Ann N Y Aca Sci,2000;926:165-79.
3Spielmeyer W. In:Histopathologie des Nervensystems〔J〕. Berlin:Springer,1922:74-9.
4Milei J,Fraga CG,Grana DR,etal. Ultrastructural evidence of increased tolerance of hibernating myocardium to cardioplegic ischemia-reperfusion injury〔J〕. J Am Coll Cardiol,2004 Jun;16;43(12):2329-36.
5Jassem W, Fuggle SV, Rela M,etal. The role of mitochondria in ischemia/reperfusion injury〔J〕. Transplantation,2002;73(4):493-9.
6Waterhouse NJ. The cellular energy crisis:mitochondria and cell death〔J〕. Med Sci Sports Exer,2003;35(1):105-10.
7Kim JS, He L, Lemasters JJ. Mitochondrial permeability transition: a common pathway to necrosis and apoptosis〔J〕. Biochem Biophys Res Comm,2003;304(3):463-70.
8Friberg H, Wieloch T, Castilho RF. Mitochondrial oxidative stress after global brain ischemia in rats〔J〕. Neurosci Lett,2002;334(2):111-4.
