重组家蚕素Ⅱ对HepG2细胞胰岛素样作用
2014-09-12王玲玲孙博谦
王玲玲 吴 雷 孙博谦
(北华大学附属医院神经内科,吉林 吉林 132001)
随着2型糖尿病(T2DM)发病率的逐年攀升,且因长期进行胰岛素皮下注射给患者带来的负担,口服胰岛素的研发成为目前一项新的研究热点。本课题组受中医治消渴组方启发,确定了蚕蛾的抗糖尿病(DM)作用。经前期研究结果推测蚕蛾可能是通过家蚕素Ⅱ(BbxⅡ)发挥其抗DM作用。为进一步明确BbxⅡ对哺乳细胞的胰岛素样作用,本研究应用稳定表达BbxⅡ基因的人肝细胞株(HepG2)细胞,在体外观察BbxⅡ对HepG2细胞的胰岛素样作用,为明确BbxⅡ对哺乳动物细胞的降糖作用提供依据。
1 材料与方法
1.1实验材料 稳定转染pcDNA3.1(+)-BbxⅡ/His质粒 HepG2细胞株,稳定转染 pcDNA3.1(+)空质粒 HepG2细胞株、未进行转染HepG2细胞株及人胰岛素均由中日联谊医院中心实验室提供。高糖DMEM、无酚红1640培养液、优质胎牛血清、胰酶均由美国GIBCO公司购入。抗His-tag小鼠单克隆抗体、辣根过氧化物酶标记山羊抗小鼠购自中国碧云天生物技术公司。葡萄糖测定试剂盒、糖原染液试剂盒购自北京天根生物技术公司。
1.2实验方法 (1)免疫细胞化学检测细胞中重组Bbx(MBbxⅡ)蛋白表达。(2)葡萄糖氧化酶-过氧化物酶(GOD-POD)法测定葡萄糖消耗:①制单细胞悬液,按1×104/孔分别种植于96孔板,每组细胞设5复孔。实验分组:A组: pcDNA3.1(+)-BbxⅡ/His HepG2,B组:空质粒pcDNA3.1(+)HepG2,C组:未转染HepG2细胞, D组:10 nmol/L人胰岛素作用HepG2细胞,E组:100 nmol/L人胰岛素作用HepG2细胞。孔板置于37℃、5% CO2培养箱培养,待细胞贴壁达80%融合后进行实验。实验前24 h开始,细胞培养液更换为不含酚红1640培养液,其他成分不变。实验开始时D组及E组加入相应的人胰岛素,作用24 h及48 h。②葡萄糖消耗实验步骤:每孔分别取细胞培养液2 μl,与工作液100 μl混合均匀,置于新96孔板中。设校准对照孔(阳性对照)及空白对照孔(阴性对照)。37℃,5% CO2,饱和湿度培养箱中培养10 min。取出96孔板,使用酶联免疫分析仪在505 nm波长处读取各孔吸光度值;计算葡萄糖浓度。(3)PAS染色方法测定细胞糖原合成:①实验分组:A组: pcDNA3.1(+)-BbxⅡ/His HepG2;B组:空质粒pcDNA3.1(+) HepG2;C组:未转染HepG2细胞;D组:10 nmol/L人胰岛素作用HepG2细胞;E组:100 nmol/L人胰岛素作用HepG2细胞。②24孔板中放置高压灭菌的盖玻片,按2×104个/孔均匀接种细胞,每孔加入1 ml细胞培养液并保持G418相应浓度,37℃、5% CO2、饱和湿度培养箱中培养,待细胞融合达90%以上时进行后续实验。实验开始当日D组、E组HepG2细胞分别加入相应浓度人胰岛素作用,37℃,5% CO2,饱和湿度培养箱中培养24 h。③细胞糖原染色实验步骤:0.1 mol/L磷酶盐缓冲液(PBS)冲洗2次,加入固定液10 min,水洗1 min,晾干;试剂一全部覆盖整个盖玻片,室温避光孵育10 min;取出盖玻片缓慢冲洗3 min;玻片未干之前,滴加试剂二于盖玻片样本上,覆盖样本,室温孵育15 min;取出盖玻片,缓慢冲洗60 s,自然晾干;滴加试剂三染色30 s,流水冲净、晾干;中性树胶封片,高倍镜镜检。

2 结 果
2.1免疫细胞化学检测MBbxⅡ基因在HepG2蛋白水平的表达结果 以细胞内已稳定转染BbxⅡ基因所含有的6个his-tag为抗原,对三组HepG2细胞分别进行免疫细胞化学检测,结果显示:稳定转染pcDNA3.1(+)-BbxⅡ/His组HepG2细胞胞浆中可以见到棕黄色的颗粒,稳定转染空质粒pcDNA3.1(+)组及未转染组HepG2细胞胞浆中未见到。结果说明pcDNA3.1(+)-BbxⅡ/His质粒在HepG2细胞中得到稳定转染并可实现表达。见图1。
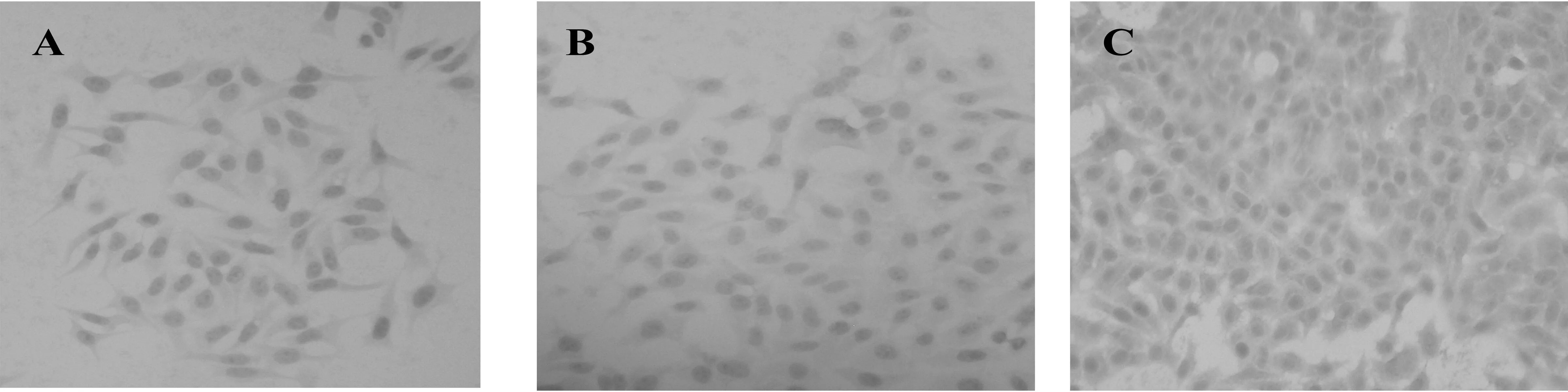
A:基因未转染组; B:pcDNA3.1(+)空质粒稳;C:pcDNA3.1(+)-BbxⅡ/His组定转染组
2.2MBbxⅡ基因对HepG2细胞葡萄糖消耗的影响 培养细胞换液24 h后检测葡萄糖消耗情况,与基因未转染组及空质粒转染组HepG2细胞比较pcDNA3.1(+)-BbxⅡ/His- HepG2组及100 nmol/L胰岛素作用HepG2细胞组,葡萄糖消耗增多,差异有显著性(P<0.01)。与基因未转染组及空质粒转染组HepG2细胞比较10nM胰岛素作用HepG2细胞组,差异显著(P<0.05)。pcDNA3.1(+)-BbxⅡ/His- HepG2组、10 nmol/L及100 nmol/L胰岛素作用HepG2细胞组进行两两比较,无显著性差异(P>0.05)。
培养细胞换液48 h后检测葡萄糖消耗情况,与基因未转染组及空质粒转染组HepG2细胞比较pcDNA3.1(+)-BbxⅡ/His- HepG2组及100 nmol/L胰岛素作用HepG2细胞组,差异显著(P<0.01)。与基因未转染组及空质粒转染组HepG2细胞比较10 nmol/L胰岛素作用HepG2细胞组,差异显著(P<0.05)。pcDNA3.1(+)-BbxⅡ/His- HepG2组与100 nmol/L胰岛素作用HepG2细胞组进行比较,无显著差异(P>0.05)。见表1。

表1 MBbxⅡ基因对HepG2细胞葡萄糖摄取影响
2.3MBbxⅡ基因对HepG2细胞糖原合成作用的影响 与正常组及转染空质粒pcDNA3.1(+)-HepG2组比较,pcDNA3.1(+)-BbxⅡ/His- HepG2组及100 nmol/L胰岛素作用组HepG2细胞的糖原合成均有增加(P<0.01)。与正常组及转染空质粒pcDNA3.1(+)-HepG2组比较,10 nmol/L胰岛素作用组HepG2细胞的糖原合成增加(P<0.05)。而pcDNA3.1(+)-BbxⅡ/His- HepG2组及100 nmol/L胰岛素作用组间比较无显著性差异(P>0.05)。见图2,表2。

表2 MBbxⅡ对HepG2细胞糖原合成的影响(n=30,n/n)
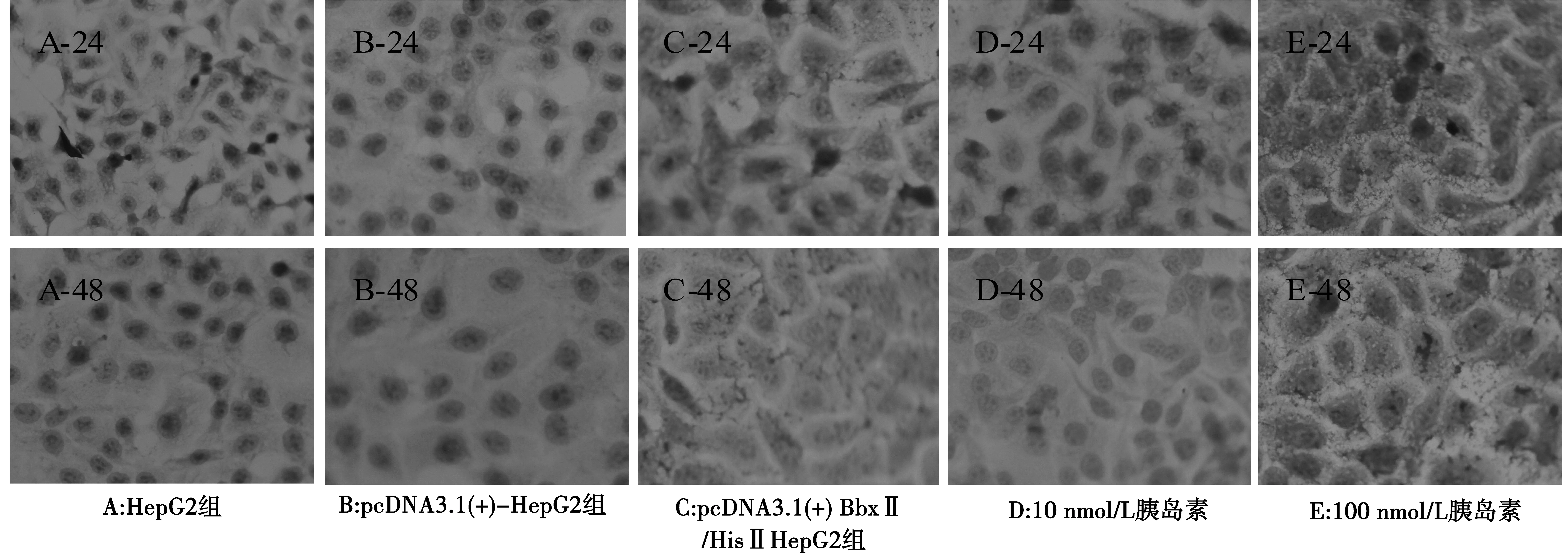
图2 MBbxⅡ对HepG2细胞糖原合成的影响(PAS染色,400×)
3 讨 论
在人类胰岛素调节血糖的过程中,肝脏是最重要的靶器官。肝脏通过控制糖原的合成与分解,控制着糖异生等途径,维持血糖的稳定。葡萄糖摄取及糖原合成是研究肝细胞糖代谢中最重要的两个指标〔1,2〕。HepG2细胞是一种肝癌细胞株,常作为体外研究肝细胞糖代谢的细胞模型〔3,4〕。检测葡萄糖消耗的方法有:3H标记 2- DOG摄取试验、放射性核素14C标记葡萄糖掺合试验及14C标记葡萄糖合成糖原试验等。这些方法虽都能反映糖代谢的动态变化过程,并且灵敏度较高,但均存在放射线侵害,易污染环境,价格昂贵,需要特定仪器及场地等缺点。本研究说明MBbxⅡ具有促进肝细胞葡萄糖摄取能力但其作用可能是快速反应并且在短期内灭活,这与近期关于家蚕素的一项研究结果相一致〔5〕。
肝脏细胞糖代谢的另外一个重要的功能是合成与存贮糖原。本研究在上述实验研究结果的基础上,应用糖原染色检测MBbxⅡ对HepG2细胞的糖原合成调节。实验结果从另一方面证实了MBbxⅡ具有调节肝细胞糖代谢的功能。
胰岛素是机体内唯一可降低血糖的激素,也是唯一同时可促进糖原、脂肪、蛋白质合成的激素。胰岛素除了对糖、脂肪和蛋白质的代谢起调节作用外,还可刺激DNA及蛋白质的合成,促进细胞生长。MBbxⅡ作为胰岛素家族成员,是否存在促进细胞增殖能力仍未明确。从昆虫遗传学角度研究发现其具有促进造血器官细胞增殖〔6,7〕以及卵巢发育〔8~10〕等生理功能。但关于MBbxⅡ对哺乳动物细胞是否具有同样的促进细胞增殖能力未见报道。
4 参考文献
1Tudhope SJ,Wang CC,Petrie JL,etal.A novel mechanism for regulating hepatic glycogen synthesis involving serotonin and cyclin-dependent kinase-5〔J〕.Diabetes,2012;61(1):49-60.
2Sumenkova DV,Knyazev RA,Guschya RS,etal.Effect of apolipoprotein a-I complex with tetrahydrocortisone on protein biosynthesis and glucose absorption by rat hepatocytes〔J〕.Bull Exp Biol Med,2009;148(2):207-9.
3Wang ZB,Zeng HC,Wei HS,etal.NO-1886 ameliorates glycogen metabolism in insulin-resistant HepG2 cells by GSK-3β signalling〔J〕.J Pharm Pharmacol,2012;64(2):293-301.
4Ong LC,Jin Y,Song IC,etal.2-〔18F〕-2-deoxy-D-glucose (FDG) uptake in human tumor cells is related to the expression of GLUT-1 and hexokinase Ⅱ〔J〕.Acta Radiol,2008;49(10):1145-53.
5Loeb MJ.Factors affecting proliferation and differentiation of Lepidopteran midgut stem cells〔J〕.Arch Insect Biochem Physiol,2010;74(1):1-16.
6Suzuki A,Nagasawa H,Kataoka H,etal.Isolation and characterization of prothoracicotropic hormone from silkworm,Bombyx mori〔J〕.Agric Biol Chem,1982;46(4):1107-9.
7李洪霞,杜珍武,张玉成,等.家蚕素Ⅱ基因真核表达载体的构建〔J〕.中国实验诊断学,2011;15(1):20-2.
8李洪霞,杜珍武,张玉成,等.家蚕素Ⅱ基因在293FT细胞中的表达〔J〕.中国老年学杂志,2011;31(4):634-6.
9李红霞.基因工程重组家蚕素Ⅱ的表达及其胰岛素样作用的研究〔D〕.吉林大学博士研究生论文,2011.
10孔祥宾,徐世清.家蚕类胰岛素肽的结构及信号传导与作用〔J〕.蚕业科学,2010;36(3):458-64.
