脂联素对高糖环境下胰岛细胞功能及腺苷酸活化激酶和胰岛素受体底物-1的影响
2014-09-12邓娟孙娟李伟
邓 娟 孙 娟 李 伟
(徐州医学院研究生学院,江苏 徐州 221002)
胰岛β细胞分泌缺陷和胰岛素抵抗(IR)是糖尿病的重要病理生理基础,目前β细胞功能缺陷的机制尚未完全阐明。脂联素是新近发现的脂肪组织特异分泌的一个具有重要功能的细胞因子,具有调节糖脂代谢、改善IR、抗炎及抗动脉粥样硬化等作用〔1,2〕,在延缓2型糖尿病及其慢性并发症的发生发展中起了重要作用。然而,脂联素对胰岛细胞保护作用的具体机制尚不明确。本研究检测脂联素对胰岛β细胞分泌功能的影响,探讨脂联素与IR的关系,并对其具体的分子信号机制进行初步研究。
1 材料和方法
1.1材料 INS-1细胞株购自上海拜力生物科技有限公司;胎牛血清,1640培养基 (美国Gibco公司);重组大鼠球形APN(北京爱迪博);大鼠胰岛素测定ELISA试剂盒(北京爱迪博);细胞裂解液、Western印迹用腺苷酸活化蛋白激酶(AMPK)蛋白兔抗大鼠单克隆抗体(购自美国Cell Signaling公司);ECL显色试剂盒(上海申能博采公司);IRS-1酪氨酸磷酸化抗体(美国Santa Cruz)。
1.2方法
1.2.1细胞培养 INS-1细胞株生长于含10%胎牛血清(FBS)的1640培养液中(含β- 巯基乙醇5 μl/L,青、链霉素各100 U/ml,加1 mmol/L丙酮酸钠,10 mmol/L HEPES 粉,),置于含5% CO2浓度的37 ℃恒温培养箱中培育,至70%~80%融合后分为两组:对照组:予5.5 mmol/L葡萄糖培养,加入100 μg/L脂联素(从10~1 000 μg /L的剂量曲线中选出);高糖组:予25.6 mmol/L葡萄糖培养,加入100 μg/L脂联素。每3~4天用0.25%胰酶消化传代,待细胞生长至亚融合状态时,接种于96孔细胞培养板用于实验。
1.2.2实验分组 实验分为对照组(5.5 mmol/L葡萄糖),对照组+脂联素组(5.5 mmol/L葡萄糖+100 μg/L脂联素),高糖组(25.6 mmol/L葡萄糖),高糖+脂联素组(25.6 mmol/L葡萄糖+100 μg/L脂联素),分别干预24 h,48 h,72 h。
1.2.3IR细胞模型的建立与分组 IR细胞模型建立参照文献〔3,4〕。单层贴壁INS-1细胞用FFA(0.40 mmol/L)培养24 h后,于4 ℃条件下用预冷0.01 mol/L磷酸盐缓冲液(PBS)洗涤细胞3次,即成为具有IR的细胞模型。鉴定模型成功后,加入脂联素。分成组三组:正常组、IR模型组、脂联素组。
1.2.4模型鉴定 取培养液采用葡萄糖氧化酶法测定葡萄糖含量,裂解细胞提取蛋白质,用Braford微量法测定蛋白浓度。培养液中葡萄糖含量=样品吸光度值/标准管吸光度值X标准品浓度(g/L)×1 L/g protein。细胞内糖原含量测定:蒽酮法测定细胞内糖原含量〔10-2×g/(g protein)〕,糖原含量=样品吸光度值/标准吸光度值×标准品糖原含量(10-2×g)/g protein。
1.2.5酶联免疫法(ELISA) 采用酶联免疫试剂盒,按说明书操作,将各时间点收集得到细胞上清液在常温下溶解,各取100 μl 分别加入已包被好胰岛素抗体的ELISA 96孔板中。ELISA 间接夹心法检测反应终止后,用酶联免疫检测仪测定450 nm处的A值,根据胰岛素标准品A值曲线,换算所测上清液中胰岛素的含量。
1.2.6Western印迹检测AMPK蛋白的表达 ①收集细胞提取按照蛋白提取试剂盒(上海申能博采公司)的说明书操作;②Western印迹过程:依次灌制10% SDS-PAGE分离胶、5%聚合胶;转膜;室温下用TBS封闭液封闭1 h;于4 ℃将膜与一抗(AMPK 1∶1 000 )孵育过夜;TBS洗膜3次,每次30 min。将膜置于HRP 标记的二抗(1∶2 000)稀释液中,室温振荡孵育1 h。洗膜液洗膜3次,每次30 min。暗室里按照ECL说明书加入发光液,室温轻摇1 min,注意避光。在暗室中剪下与膜同样大小的胶片,压在暗盒中,约1~5 min;将胶片依次放在显影液、定影液中洗;水冲洗,可在相应位置见到目的条带β-actin为内参。Western印迹检测IRS-1酪氨酸蛋白表达:①提取细胞蛋白质,BCA蛋白测定试剂盒检测蛋白浓度。取样品蛋白质2 mg加IRS-1抗体过夜后加入蛋白A琼脂孵育3 h。洗涤免疫沉淀复合物后加入Laemmli上样缓冲液煮沸5 min,6%SDS-PAGE分离蛋白,电转移法使蛋白质转移到硝酸纤维素膜上,用含3%BSA的TBST溶液+含(0.05%Tween20)37 ℃封膜1 h后,分别加入用封闭液稀释的IRS-1抗体磷酸酪氨酸抗体4过夜。洗膜后加入用辣根过氧化物酶标记的二抗,室温轻摇1 h,洗膜后用ECL显像曝光,应用光密度扫描仪测各条带密度。

2 结 果
2.1脂联素对胰岛分泌功能的影响 在5.5 mmol/L葡萄糖培养浓度下,脂联素处理组的胰岛素分泌水平在不同的孵育时间与对照组差异均无统计学意义(P>0.05);与5.5 mmol/L葡萄糖培养浓度相比较,在25.6 mmol/L浓度下,两组的胰岛素分泌水平均显著升高,其中脂联素处理组的胰岛素分泌在培养48~72 h后均高于高糖组(P<0.05)。见表1。
2.2培养液中葡萄糖含量及细胞内糖原含量变化 IR模型组培养液中葡萄糖含量明显高于组,细胞内糖原含量显著减少(P均<0.05),加入脂联素组中培养液中葡萄糖含量较IR模型组显著降低,细胞内糖原含量升高(P均<0.01)。见表2。
2.3细胞中AMPK蛋白表达水平比较 与正常组比较,IR模型组AMPK蛋白水平明显降低;而脂联素可对抗高糖高脂的影响,使AMPK蛋白水平增加,见图1。
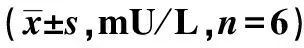
表1 在不同葡萄糖浓度下脂联素对胰岛细胞胰岛素分泌的影响
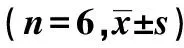
表2 各组培养液中葡萄糖含量及细胞内糖原含量
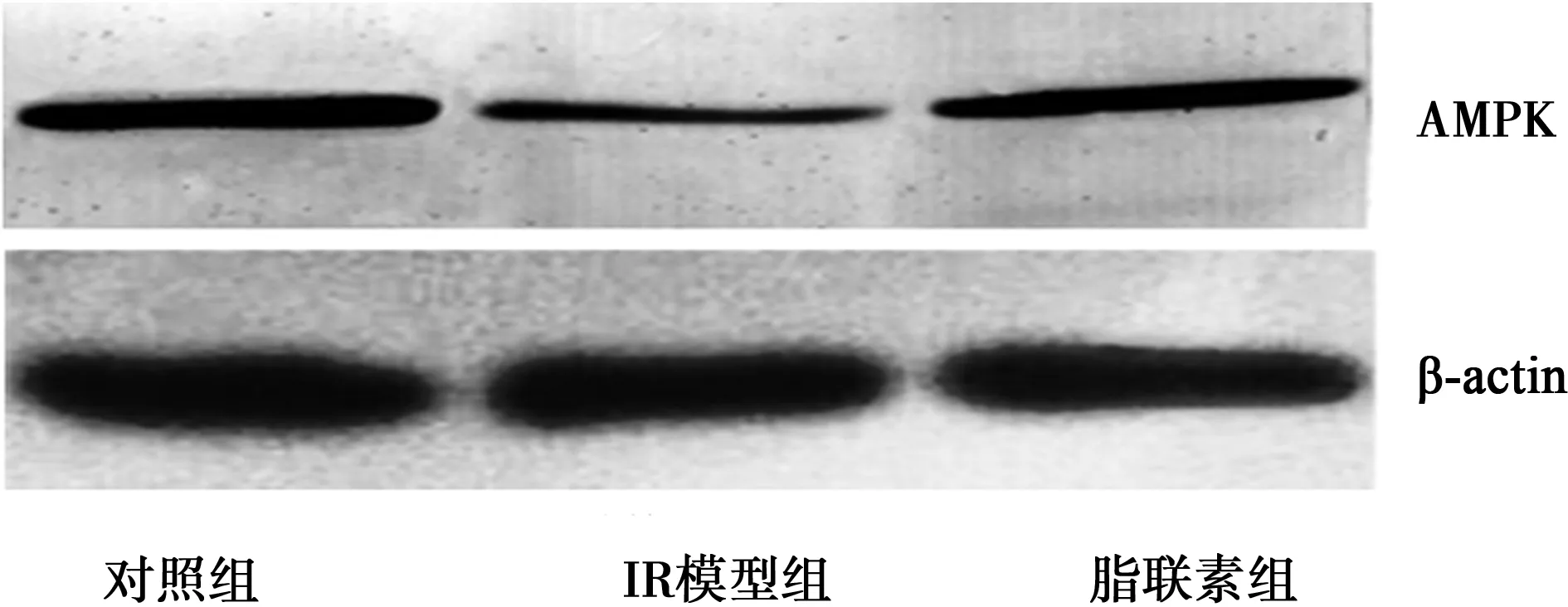
图1 细胞中AMPK蛋白表达水平比较
2.4细胞中IRS-1酪磷酸化表达水平比较 与对照组比较,IR模型组IRS-1酪磷酸化水平明显降低;而脂联素可对抗高糖高脂的影响,使IRS-1酪磷酸化水平增加,见图2。
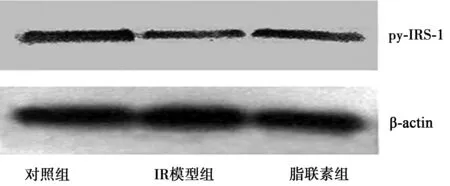
图2 细胞中IRS-酪磷酸化表达水平比较
3 讨 论
脂联素是脂肪细胞分泌的一种重要的脂肪因子。也被称为AdipoQ、GBP28或Acrp30。它由244个氨基酸组成,相对分子质量为30×103。这一脂源性细胞因子可以显著改善IR状态,但其是否可以调节胰岛β细胞的胰岛素分泌功能,进而影响糖尿病的发生,目前尚存争论。
脂联素可以改善IR并在一定条件下促进胰岛素的分泌。Gu等〔5〕发现,脂联素处理后的胰岛细胞在低糖(3.3 mmol/L)培养2 h内,其胰岛素分泌被抑制;而在高糖(16.7 mmol/L)培养6~24 h,其胰岛素分泌持续增加,提示指联素在一定程度上是一种依赖于葡萄糖浓度的胰岛素促泌剂。Okamoto等〔6〕发现C57BL/6小鼠注射APN后可促进胰岛素分泌。王适龙等〔7〕研究发现脂联素能促进高糖环境下的胰岛素分泌,其机制可能与通过下调PPARγ,降低UCP-2的表达有关。有研究表明,葡萄糖刺激的胰岛素分泌的本质是葡萄糖对AMPK的抑制〔8〕。脂联素在外周的作用主要是通过AMPK介导〔9〕。脂联素能够激活骨骼肌细胞和肝细胞中的AMPK,刺激肝和肌肉中糖的利用和脂肪酸的β氧化,导致细胞内三磷酸腺苷(ATP)含量的增加。但脂联素在胰岛细胞内的作用方式至今尚无定论。业已证实,鼠β细胞中有1 型和2 型脂联素受体的表达,并且在胰岛素分泌性MIN6 细胞中也可检测到这类受体的存在〔8〕。因此,da Silva Xavier等〔10〕提出假说,认为脂联素在胰岛细胞中也有与外周相似的作用途径。
IR是临床许多疾病如糖尿病、肥胖、高血压与动脉硬化等疾病的共同的危险因素与病理生理基础。IR的研究涉及许多方面,目前许多研究是关于胰岛素受体和受体后信号传导系统,尤其是胰岛素信号链传导障碍在IR中的作用日益引起人们的关注。
脂联素是胰岛素敏感性的一个重要的调控因子已有研究显示,在糖尿病发生与发展过程中,血清脂联素浓度的降低与体重增加、高胰岛素血症和IR呈平行关系〔11〕。有报道显示2型糖尿病伴肥胖患者血清脂联素浓度会下降,且血清脂联素水平下降的程度与IR及高胰岛素血症具有一定的相关性〔12〕。
AMPK作为一种重要的蛋白激酶参与多种代谢过程,同时介导了细胞对营养和环境变化的适应,被称为“能量感受器”。脂联素具有促进糖脂代谢、减轻IR、抗炎以及抗动脉粥样硬化等作用。Yamauchi等〔13〕在体内和体外实验均发现,脂联素刺激肌细胞中ACC 的磷酸化、脂肪酸的氧化、葡萄糖的摄取和乳酸盐的生成都与AMPK的活化有关;当AMPK活性被抑制时,脂联素产生的这些效应也均被抑制。这提示由脂联素刺激的葡萄糖利用和脂肪酸氧化可能是通过AMPK的介导完成的。Kamon等〔14〕证实,在肌肉中脂联素激活AMPK和过氧化物酶体增殖物活化受体γ,增加脂肪酸的β氧化,减少甘油三酯的含量,减轻肌肉中的IR;在肝脏,脂联素同样激活AMPK,下调葡萄糖-6-磷酸酶,减少肝脏葡萄糖的输出。给IR大鼠模型注射一定剂量的AICAR ,可激活AMPK,通过胰岛素信号通路提高机体的胰岛素敏感度〔15〕。本实验中可见脂联素可显著改善(FFA)诱导的IR细胞模型。另外,IR细胞模型组中AMPK表达减少,提示AMPK可能参与IR的形成。加入脂联素组AMPK表达增加,推测脂联素改善IR可能与提高AMPK蛋白的活性有关。
β细胞所表达的IRS家族主要包括IRS-1、IRS-2及IRS-3。IRS-1在整个胰岛上广泛分布。Yamauchi等〔13〕通过给严重IR的脂肪萎缩小鼠注射基因重组的脂联素后发现,骨骼肌胰岛素受体和Akt激酶磷酸化以及IRS-1酪氨酸磷酸化明显增加。IRS主要通过PI-3K激活途径发挥作用,是β细胞胰岛素分泌的重要信号。动物实验也证明,脂联素基因敲除小鼠肌肉中PI-3K活性明显降低,通过腺病毒载体转染的方法提高血浆脂联素水平后可显著提高肌肉中PI-3K的活性,其胰岛素敏感性明显增加。本研究结果提示IRS-1酪氨酸磷酸化异常参与了IR的形成。加入脂联素组IRS-1酪氨酸磷酸化表达明显升高,提示脂联素改善IR可能与提高IRS-1酪氨酸磷酸化表达有关,但具体的磷酸化位点有待进一步深入研究。
4 参考文献
1Ouchi N,Walsh K.Adiponectin as an anti-inflammatory factor〔J〕.Clin Chim Acta,2007;380(1/2):24-30.
2Lopez Bermejo A,Botas P,Funahashi T,etal.Adiponectin,hepatocellular dysfunction and insulin sensitivity 〔J〕.Clin Endocrinol,2004;60(2):256-63.
3赵 燕,郝卫东.8-羟基-2'-脱氧鸟苷的生物学意义及其尿中含量的测定方法〔J〕.癌变·畸变·突变,2007;19(5):418-20.
4Dedon PC,Tannenbaum SR.Reactive nitrogen species in the chemical biology of inflammation〔J〕.Arch Biochem Biophys,2004;423(1):12-22.
5Gu W,Li X,Liu C,etal.Globular adiponectin augments insulin secretion from pancreatic islet beta cells at high glucose concen-trations〔J〕.Endocrinology,2006;30(2):217-21.
6Okamoto M,Oharalmaizumi M,Kubota N,etal.Adiponectin induces insulin secretion in vitro and in vivo at a low glucose concentration〔J〕.Diabetologia,2008;51(5):827-35.
7王适龙,钟 惠,菊盛杰,等.球形脂联素对胰岛β细胞胰岛素分泌和凋亡的影响〔J〕.中国糖尿病杂志,2010;18(12):931-3.
8Kharroubi I,Rasschaert J,Eizirik DL,etal.Expression of adiponectin receptors in pancreatic cells〔J〕.Biochem Biophys Res Commun,2003;312(4):1118-22.
9Yamauchi T,Kamon J,Minokoshi Y,etal.Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase〔J〕 .Nat Med,2002;8(11):1288-95.
10da Silva Xavier GS,Leclerc I,Salt IP,etal.Role of AMP-activated proten kinase in the regulation by glucose of islet beta cell gene expression〔J〕 .Proc Natl Acad Sci USA,2000;97(8):4023-8.
11Minoru I,Eisuke M,Masao Y,etal.Correlation between the adiponectin-leptin ratio and parameters of insulin resistance in patients with type 2 diabetes〔J〕.Metab Clin Exp,2005;54(3):281-6.
12Lindsav RS,Funabashi T,Hanson RL,etal.Adiponectin and development of type 2 diabetes in the Pmia India population 〔J〕.Lancet,2002;360(9):57-8.
13Yamauchi T,Kamon J,Minokoshi Y,etal.Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase〔J〕.Nat Med,2002;8(11):1288-95.
14Kamon J,Yamauchi T,Terauchi Y,etal.The mechanisms by which PPAR gamma and adiponectin regulate glucose and lipid metabolism〔J〕.Nippon Yakutigaku Zasshi,2003;122:294-300.
15Wright DC,Geiger PC,Holloszy JO,etal.Contraction and hypoxia stimulated glucose transport is mediated by a Ca2+dependent mechanism in slow twitch rat soleus muscle 〔J〕 .Am J Physiol Endocrinol Metab,2005;288(6):1062-6.
