DcR3在预防博莱霉素大鼠模型发生肺纤维化中的作用
2014-09-12马忠森
杨 洋 任 锦 刘 晶 马忠森
(天津市胸科医院,天津 130051)
肺纤维化一般指在毒物、自发免疫反应、药物副反应、感染、严重的外伤等不同因素刺激下引起肺部炎症反应,肺泡持续性损伤、细胞外基质反复破坏、修复、重建并过度沉积,导致正常肺组织结构改变、功能丧失的一类疾病,发病率逐年升高。肺纤维化的发生通常经历肺泡炎和肺纤维化形成两个阶段,如果炎症阶段得到有效的抑制,势必延缓或阻止肺纤维化的形成。但现有的抗炎药物不能阻止肺纤维化的发展,有的甚至在抗炎的同时反而加重了肺纤维化的程度 。而近年来,DcR3在抗炎方面的研究备受关注,DcR3可能成为一个连接炎症、 固有免疫、 肿瘤的中间点〔1〕。本文将采用DcR3蛋白尾静脉注射干预肺纤维化早期动物模型,观察其对炎症反应的作用及其在预防纤维化方面的作用。
1 材料与方法
1.1实验动物 雌性健康Wistar大鼠72只,平均体重250~300 g,购自吉林大学基础医学院动物中心,随机分为三组,每组24只,分别为博莱霉素组、博莱霉素+ DcR3组、正常对照组。博莱霉素(日本化药株式会社生产);DcR3蛋白(Sigma 美国);大鼠肿瘤坏死因子(TNF)-α检测试剂盒购自晶美生物公司;OligodT、禽成髓细胞增生疾病毒(AMV)逆转录酶购自Promega公司;TRIZOL、焦碳酸二乙酯(DEPC)、氯仿、异丙醇、dNTP、Taq DNA聚合酶购自大连宝生物公司。
1.2方法
1.2.1动物模型的制作与分组 以3%戊巴比妥钠(0.4 ml/100 g体重)腹腔内注射麻醉,博莱霉素溶液(1.375 mg/ml)按5 mg/kg经气管呈45°角注入大鼠肺内,左右来回旋转并按摩双肺10余次,使药液尽可能在双肺内均匀分布,手术后置于动物实验室内喂养,分笼饲养,标记号分组。同样方法,正常对照组推注等容积的生理盐水。正常对照组大鼠活泼好动,体格随饲养时间延长更加肥硕,皮毛光泽发亮,呼吸平稳。博莱霉素组造模后3 d开始出现动作缓慢、呼吸急促、进食少;随着时间的延长出现精神萎靡、喜蜷缩、体重明显下降、皮毛色泽晦暗无光,死亡率较高。博莱霉素+DcR3组大鼠在造模后3~7 d也出现动作缓慢、呼吸急促,进食少但随着注射DcR3,情况改善,2 w后活动明显增多、进食恢复、呼吸恢复,体重逐渐增长,4 w后与正常对照组无明显区别。正常对照组:自模型制作当天开始每天给予尾静脉注射1 ml生理盐水;博莱霉素组:自模型制作当天开始每天给予尾静脉注射1 ml生理盐水;博莱霉素+ DcR3组:自造模当天开始按3.33 μg /kg 给予DcR3蛋白(1 μg/μl)1 ml,1次/d,尾静脉注射,给药时间2 w。
1.2.2标本制备 各组分别于2、4、6、8 w处死大鼠6只:大鼠称重后以3%戊巴比妥钠腹腔麻醉,结扎左支气管,分4次共注入磷酸盐缓冲液(PBS) 6 ml边按摩胸部边回收液体,离心1 500 r/min 10 min,收集上清冻存待检测TNF-α;重悬细胞计数并立即用于RT-PCR检测TNF-α mRNA的表达。取左肺组织冻存留作羟脯氨酸检测;取右肺组织浸入10%中性甲醛液中固定,石蜡包埋、切片以备用组织染色。
1.2.3肺泡灌洗液细胞计数 用吸管吸5滴细胞悬液到离心管中,将细胞悬液滴入计数板:统计4个大格的细胞数:将血球计数板放于显微镜的低倍镜下观察,并移动计数板,当看到镜中出现计数方格后,数出四角的4个大格(每个大格含有16个中格)中的细胞数目。
1.2.4肺泡灌洗液中TNF-α mRNA及上清中含量的检测 将重悬后BALF细胞转移EP管中离心,去上清加入1 ml Trizol,提取RNA,测定RNA浓度:加99 μl三蒸水混匀稀释,美国惠普可见/紫外光光度仪比色测OD值,A260/280在1.8~2.0之间。总RNA浓度(μg/ml)=OD 260×40×稀释倍数。选取比值在2.0左右的RNA样本做逆转录。逆转录反应体系:1 μl DEPC水、1 μl引物加入10 μl模板RNA→稍离心,100℃沸水1 min→加入2 μl dNTP Mix、4 μl 5×buffer、2 μl AMV逆转录酶→稍离心,42℃水浴90 min→沸水3 min 灭活AMV→-20℃保存或立即PCR。PCR反应体系:在0.3 ml PCR管,依次加入下列试剂:cDNA 5 μl、上游引物(10 pmol/L)1.5 μl、下游引物(10 pmol/L)1.5 μl、dNTP(2 mmol/L) 4 μl、10×PCR缓冲液5 μl Taq酶(2 U/μl)0.3 μl、ddH2O 32.7 μl,使总体积达50 μl→轻轻混匀、稍离心→设定PCR程序:94℃45 s,58℃45 s,72℃ 1 min,72℃延伸8 min,30个循环。引物:TNF-α(1 480 bp) 上游引物 5′-acagaaagcatgattccgaga-3′,下游引物 5′-tcagtagacagaagagcgtgg-3′;β-actin (570 bp) 上游引物 5′- acggcattgtcaccaactg -3′,下游引物5′- gcagctcatagctcttctc-3′。采用Tannon GIS凝胶电泳图像分析仪进行密度扫描、结果分析、计算目的基因相对表达水平。收集各组不同时期肺泡灌洗液上清,-20℃冻存,统一采用晶美的ELISA试剂盒,按照试剂盒操作说明检测TNF-α含量。
1.2.5组织标本染色 取石蜡切片,60℃烤2 h,二甲苯脱蜡,酒精梯度脱水后,常规苏木素-伊红(HE)染色、Masson三联染色。观察肺组织病理学改变。参照Szapiel〔2〕方法确定肺泡炎和肺纤维化程度。即将肺泡炎分为4级:①无肺泡炎(-) 0分;②轻度肺泡炎(+)1分:单核细胞浸润使肺泡隔增宽,仅限于局部和近胸膜部,面积小于全肺的20%,肺泡结构正常;③中度肺泡炎() 2分:受累面积占全肺的20%~50%近胸膜部较重;④重度肺泡炎() 3分:面积>50%,偶见肺泡腔内有单核细胞及出血造成的实变。肺纤维化同样进行评分:①无肺纤维化(-) 0分;②轻度肺纤维化(+) 1分:受累面积<20%;③中度肺纤维化() 2分:受累面积20%~50%;(4)重度肺纤维化() 3分:受累面积>50%,肺泡结构紊乱。
1.2.6羟脯氨酸含量测定 肺组织加0.8 ml冰冷的PBS进行研磨,然后用0.2 ml预冷的PBS冲洗玻璃研磨管,一并倒入玻璃试管中。然后用南京建成羟脯氨酸检测试剂盒(碱水解法)检测羟脯氨酸含量。羟脯氨酸含量(μg/ml)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管含量(5 μg/ml)×稀释倍数。

2 结 果
2.1肺组织大体形态及组织病理变化 (1)正常对照组:各时相点肺组织均呈粉红色,表面光滑均匀,无出血水肿等病理改变。肺泡炎的程度在各个时间点无明显变化。(2)博莱霉素组:肺泡炎的程度在2 w时表现最重,有明显的充血、水肿、出血点增多、部分融合成片;4 w时可见局部陈旧性出血点,肺表面不光滑,双肺体积可缩小、苍白,出现小结节,肺硬度增加;6 w时双肺体积缩小,表面布满结节,肺脏较硬,双肺周边可见致密的灰白或黄褐色纤维组织,近中央部分病变较轻,仅有轻度异常;2~6 w时炎症程度均高于对照组(均P<0.05),8 w时双肺较6 w无明显改变。(3)博莱霉素+DcR3组:2 w时可见充血水肿、出血点;4 w时双肺颜色粉红,个别双肺周边可见白色结节;6 w时双肺较软,颜色粉红,仅在双肺周边见少量散在结节;8 w时双肺改变基本同6 w。博莱霉素+DcR3组肺泡炎的程度表现为逐渐减轻的过程,2~6 w时炎症程度均低于博莱霉素组(均P<0.05),各时间点与对照组比较无显著性差异(P>0.05);8 w时三组炎症严重程度无显著性差异(P>0.05)。见表1。
对照组肺纤维化程度在各个时间点无明显变化;博莱霉素组肺纤维化程度逐渐加重,各时间点与对照组比较均具有显著性差异(P<0.05);博莱霉素+DcR3组肺纤维化程度无明显加重趋势,4~8 w时与对照组比较差异显著(P<0.05),2~4 w肺纤维程度与博莱霉素组无明显差异(P>0.05),6~8 w肺纤维程度与博莱霉素组比较有显著性差异(P<0.01)。见表2。
2.2不同实验组、不同时期BALF细胞计数的变化 对照组BALF细胞总数波动在6~7×106/ml;博莱霉素组高于对照组,尤其在2~4 w细胞总数差异显著(P<0.01),6~8 w与对照组比较无显著性差异(P>0.05);博莱霉素+DcR3组BALF细胞总数在2 w时最高,此后下降明显,到第8周时反而低于对照组(P<0.05),其他时间点与对照组比较差异无显著性(P>0.05),与博莱霉素组在2、4、8 w时比较均有显著性差异(均P<0.05)。见表2。
2.3肺泡灌洗液中TNF-α表达量的变化 分别收集三组2、4 w肺泡灌洗液中的细胞(4 w后灌洗液细胞相对较少,提取RNA成功率低,故取消),RT-PCR半定量分析TNF-α mRNA的表达量,结果显示对照组细胞有微量TNF-α mRNA表达;博莱霉素组表达量明显升高,与对照组比较有显著性差异(P<0.01);博莱霉素+DcR3组细胞有少量TNF-α mRNA表达,2 w时与对照组和博莱霉素组比较有显著性差异(P<0.01),4 w时与博莱霉素组比较仍有显著性差异(P<0.01),但与对照组比较无显著性差异(P>0.05)。见图1。肺泡灌洗液上清中TNF-α蛋白含量的检查结果显示:对照组各时间点TNF-α仅有微量表达;博莱霉素组该细胞因子的表达在各个时间点均高于对照组(P<0.01),TNF-α的表达水平逐渐下降,至第8周与对照组和博莱霉素+DcR3组已无统计学差异(P>0.05),博莱霉素+DcR3组二者的表达与对照组比较无显著性差异(P>0.05),与博莱霉素组比较有显著性差异(P<0.05)。见表3。
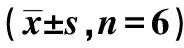
表1 病理切片肺泡炎程度评分结果
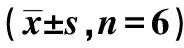
表2 病理切片纤维化程度评分及BALF细胞计数

图1 TNF-α RT-PCR电泳结果
2.4肺组织切片染色结果 正常对照组:光镜观察可见大鼠肺结构清晰,各观察点均未出现明显改变,Masson染色未见绿色胶原沉积。博莱霉素组:6 w时肺泡结构破坏明显,肺泡壁增厚,成纤维细胞大量增多,肺间质纤维化瘢痕形成,毛细血管腔闭塞,Masson染色可见肺泡间隔内有大量绿色胶原沉积;8 w时改变基本同6 w,Masson染色可见大量绿色胶原沉积。博莱霉素+DcR3组:6 w时无炎性细胞浸润,偶见绿色胶原沉积,较4 w无增多趋势;8 w时改变基本同6 w,可见大部分正常肺泡结构。
2.5肺组织羟脯氨酸含量测定 对照组有微量羟脯氨酸表达,各时间点含量无明显变化;博莱霉素组羟脯氨酸含量逐渐升高,6 w时达到高峰,各时间点与对照组比较有显著性差异(P<0.05);博莱霉素+DcR3组羟脯氨酸含量在4~8 w时与对照组比较无显著性差异(P>0.05),与博莱霉素组比较有显著性差异(P<0.05)。见表4。
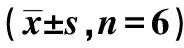
表3 BALF上清中TNF-α含量的检测

表4 肺组织中羟脯氨酸含量的测定
3 讨 论
DcR3又称TR6,为1998年Pitti等〔3〕发现的一种可溶性TNF受体(TNFR)超家族成员,可与Fas、HVEM、DR3竞争结合其相应配体FasL、LIGHT及TL1A,抑制细胞凋亡,在细胞的生长、分化、死亡以及免疫调节等方面发挥重要作用,与多种疾病等密切相关。DcR3基因定位于人类第20号染色体长臂,20q13.3。DcR3 mRNA序列全长1 114 bp,含1个开放读码框,编码300个氨基酸,N末端前29个氨基酸为信号肽序列,蛋白分子量约35 000 KD。DcR3肽链含4个串联的富集半胱氨酸的重复序列,此为TNFR超家族的共同标志,但DcR3缺乏明显的跨膜结构,属于分泌性蛋白,可用于静脉注射。目前关于DcR3的研究主要集中在肿瘤、自身免疫性疾病、胰岛移植等方面〔4,5〕,在肺纤维化的研究中较少,本研究提示其可能有一定的抗炎作用〔6〕。同时Wortinger等〔7〕建立FasL诱导的急性肺损伤小鼠模型时发现,预先用DcR3类似物处理的小鼠较未经处理的小鼠中性粒细胞浸润减少,支气管肺灌洗液中的GM-CSF、MIP及KC等炎性介质显著降低。文献〔8〕也报道,局部注射可以改善风湿性关节炎的关节活动度,DcR3可以直接中和实验性自身免疫性脑脊膜炎局部的炎症和下调Th1T细胞的数目,抑制干扰素(IFN)-γ和白细胞介素(IL)-17或TNF-α表达。
大量的动物实验和临床实验发现〔9〕,肺纤维形成早期局部肺组织存在大量炎性细胞浸润,各种促炎性物质在肺组织局部聚集。参与的细胞因子和其他的介质较多,且在不同阶段所参与的细胞因子有所不同,TNF-α、IL-1、的表达高峰在炎症期,此后逐渐减弱;转化生长因子(TGF-β)1、IL-10在早期表达,在炎症期形成高峰,此后仍维持高水平表达,本研究说明DcR3的应用的确抑制了博莱霉素致肺纤维化大鼠模型的炎症反应。
通常将肺纤维化的发生过程分为两个阶段,初始的肺泡炎阶段即致病因素导致上皮损伤,上皮下基底膜破坏、炎症细胞、免疫细胞活化,分泌各种炎症因子;肺纤维化阶段:在第一阶段炎症因子的作用下,成纤维细胞募集、分化、增生,胶原和细胞基质过度增生,肺纤维化形成。早期的炎症因子TGF-β、TNF-α、IL-4、 IL-13以及 IFN-γ、IL-1β等的大量产生可激活体内一系列细胞信号传导通路,如ERK-MAPK信号通路,其在启动分子信号调节成纤维细胞增殖方面非常重要〔10,11〕。此外,JNK-、p38-以及Smad等信号转导通路均具有促进肌成纤维细胞分化的作用,这些通路均在炎症因子的刺激下活化从而促进肺纤维的发生〔12〕。 可见阻止炎症反应的扩大化,抑制某些关键细胞因子的释放理论上可以预防肺纤维化的发生。
本研究通过延长观察时间发现,早期注射DcR3组的大鼠其肺纤维化程度明显减轻,甚至局限化,大鼠一般生活状态明显恢复,这提示DcR3早期的抗炎作用可能在一定程度上预防了肺纤维化的发生,但DcR3在肺纤维的形成是否存在直接作用,尚需要进一步研究。
4 参考文献
1Zhan C,Patskovsky Y,Yan Q,etal.Decoy strategies:the structure of TL1A:DcR3 complex〔J〕.Structure,2011;19(2):162-71.
2Szapiel SV,Elson NA,Fulmur JD,etal.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse〔J〕.Am Rev Respir Dis,1979;120(4):893-7.
3Pitti RM,Marsters SA,Lawrence DA,etal.Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer〔J〕.Nature,1998;396(6712):699-703.
4Takahashi M,Miura Y,Hayashi S,etal.DcR3-TL1A signalling inhibits cytokine-induced proliferation of rheumatoid synovial fibroblasts〔J〕.Int J Mol Med,2011;28(3):423-7.
5Bamias G,Evangelou K,Vergou T,etal.Upregulation and nuclear localization of TNF-like cytokine 1A (TL1A) and its receptors DR3 and DcR3 in psoriatic skin lesions〔J〕.Exp Dermatol,2011;20(9):725-31.
6郏 博,杨 洋,齐欣萌,等.诱骗受体3对肺纤维化动物模型早期的作用〔J〕.细胞与分子免疫学杂志,2010;26(6):602-3.
7Wortinger MA,Foley JW,Larocque P,etal.Fas ligand-induced murine pulmonary inflammation is reduced by a stable decoy receptor 3 analogue〔J〕.Immunology,2003;110(2):225-33.
8Fukuda K,Miura Y,Maeda T,etal.Decoy receptor 3 regulates the expression of various genes in rheumatoid arthritis synovial fibroblasts〔J〕.Int J Mol Med,2013;32(4):910-6.
9Eickmeier O,Boom LV,Schreiner F,etal.Transforming growth factor β1 genotypes in relation to TGF β1,interleukin-8,and tumor necrosis factor alpha in Induced sputum and blood in Cystic fibrosis〔J〕.Mediators Inflamm,2013;20(13):913135.
10Hayashi S,Nishiyama T,Miura Y,etal.DcR3 induces cell proliferation through MAPK signaling in chondrocytes of osteoarthritis〔J〕.Osteoarthritis Cartilage,2011;19(7):903-10.
11Cheng CP,Sytwu HK,Chang DM.Decoy receptor 3 attenuates collagen-induced arthritis by modulating T cell activation and B cell expansion〔J〕.J Rheumatol.2011;38(12):2522-35.
12Bei Y,Hua-Huy T,Duong-Quy S,etal.Long-term treatment with fasudil improves bleomycin-induced pulmonary fibrosis and pulmonary hypertension via inhibition of Smad2/3 phosphorylation〔J〕.Pulm Pharmacol Ther,2013;26(6):635-43.
