头孢曲松钠对糖尿病急性脑缺血再灌注大鼠细胞凋亡及缺氧诱导因子表达的影响
2014-09-12熊建忠颜志婷林小小黄乐松
熊建忠 颜志婷 林小小 黄乐松
(萍乡市人民医院神经内科,江西 萍乡 337055)
脑缺血是临床上常见的心脑血管疾病,与糖尿病(DM)、动脉粥样硬化、高血压、脑卒中等因素有密切的关系〔1〕。尽快改善心脑组织血液供应是治疗脑缺血的重点,然而患者血流灌注得到恢复后可能会出现缺血再灌注,会给患者的脑组织再次造成损伤。缺血再灌注出现的原因复杂,临床研究发现其与细胞凋亡、炎症等因素有关,不仅会影响患者的预后,同时对患者的生命安全造成极大的威胁。因此,选择有效的方法改善缓解再灌注损伤、保护神经是临床研究的重点。本研究观察头孢曲松钠对DM急性脑缺血再灌注大鼠细胞凋亡及缺氧诱导因子(HIF)表达的影响。
1 资料与方法
1.1一般资料 选择100只健康的雄性SD大鼠,体重225~276 g,平均(242±11)g。随机分成对照组和观察组各50只。其中头孢曲松钠由山东罗欣药业股份有限公司提供,链脲佐菌素来自于上海信然生物科技有限公司,DNA末端转移酶缺口末端标注法(TUNEL)细胞凋亡检测试剂盒购于北京启维益成科技有限公司,二氨基联苯胺(DAB)荧光显色与试剂盒均由上海研域生物科技有限公司生产提供,上海精密仪器公司提供的型号为XSP-3C的单目生物显微镜,鼠抗兔HIF-1A多克隆抗、二抗由北京艾然生物科技有限公司生产提供。
1.2方法
1.2.1研究模型的建立 主要通过腹腔内注射链尿佐菌素、动脉线栓与再灌注的方法建立DM急性脑缺血再灌注大鼠的研究模型〔2〕。注射链尿佐菌素前,100只健康的雄性SD大鼠先禁食6 h,然后腹腔内注射1%链尿佐菌素溶液,当大鼠的血糖水平超过11.1 mmol/L时表明DM大鼠的研究模型建立成功。对DM大鼠腹腔镜注射水合氯醛起麻醉效果,切口选择于颈正中部位,游离并结扎颈动脉,然后在颈总动脉分叉处作1个小切口,把尼龙线(已预热成圆头)置放于颈内动脉,待出现阻力后固定尼龙线并关闭切口,至大鼠缺血2 h后拉动尼龙线实现再灌注。
1.2.2干预方法 观察组大鼠于腹腔内注射头孢曲松钠,药物剂量控制为200 mg/kg,对照组大鼠腹腔内注射生理盐水,剂量与观察组相同,第1次给药选择在术后6 h,1次/d,连续5 d。
1.3观察指标 ①皮质区细胞凋亡。通过TUNEL法对皮质区细胞凋亡情况进行观察,严格按照试剂盒的操作步骤展开检测。②脑组织的含水量。取下干预治疗后的大鼠大脑皮质组织与皮质下组织,称取毛重,烘干后称取净重,含水量=(毛重-净重)/毛重×100%。③HIF〔3〕。通过免疫组化法进行测定,测定免疫组化染色的平均光密度值(MOD)来观察缺氧诱导因子表达的高度。
1.4统计学分析 采用SPSS13.0软件进行t检验和χ2检验。
2 结 果
2.1皮质区细胞凋亡 大鼠脑皮质区细胞凋亡数量随着脑缺血再灌注时间的增加而不断增加,至12~24 h达到最高值,然后逐渐下降。观察组大鼠在各个时段脑皮质区细胞凋亡数量均少于对照组(P<0.01)。见表1。
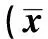
表1 两组大鼠经干预治疗后各时段皮质区细胞凋亡的比较±s,个/高倍视野,n=50)
2.2脑组织的含水量 干预前,两组大鼠脑组织的含水量比较差异不显著(P>0.05)。经干预治疗后,观察组大鼠在各个时段脑组织的含水量均少于对照组(均P<0.01)。见表2。
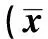
表2 两组大鼠经干预各时段脑组织含水量的比较±s,%,n=50)
2.3HIF表达 大鼠脑皮质区HIF的表达随着脑缺血再灌注时间的增加而增强,至12~24 h达到最高值,随后逐渐减弱。观察组大鼠在干预后各个时段的脑皮质区HIF MOD值低于对照组HIF(P<0.01)。见表3。
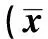
表3 两组大鼠干预各时段的脑皮质区HIF平均光密度值的比较±s,个/高倍视野,n=50)
3 讨 论
动物模型的实验〔4〕发现在血糖高的同时并发脑梗死,会很大程度增加梗死范围,这可能与脑细胞酸中毒有密切的联系,血糖升高严重影响梗死的预后。血糖升高会促进脂质过氧化物的产生〔5〕,进一步增强了氧自由基对脑细胞的损伤作用,并且血糖升高可能会加剧炎症反应而加重对脑细胞的损伤〔6〕。林冬融等〔7〕观察了高血糖加重脑缺血再灌注损伤的作用,认为相同再灌注时间点高血糖组神经功能缺损比正常血糖组严重,而且相同再灌注时间点高血糖组凋亡细胞数目及细胞色素C表达也明显高于正常血糖组。研究还显示低灌注期间脑组织的损伤可能与自由基代谢异常有关〔8〕,过量的自由基会引起氧化应激反应,会直接导致细胞的凋亡,并且能以转录因子、介导线粒体等形式引起细胞的凋亡。机体处于缺血的状态,尤其是再灌注期间,机体无法有效清除自由基,导致脂质、核酸以及蛋白质过氧化,加剧氧化应激反应〔9〕。HIF属于核蛋白〔10〕,通常在组织处于缺血缺氧的状态下形成,HIF可以和靶基因结合,从而造成机体对缺血缺氧形成耐受性。HIF十分不稳定,检测难度较大,然而在缺血缺氧时其降解被抑制,HIF表达增强。
头孢曲松钠属于抗生素药物〔11〕,然而诸多研究发现其在缓解脑缺血损伤以及再灌注损伤、保护神经等方面发挥出积极显著的作用〔12,13〕。头孢曲松钠能有效清除自由基,从而减轻氧化应激反应对脑细胞组织产生的损伤,同时头孢曲松钠可以促进谷氨酸转运体(GLT)-1 mRNA表达,加强GLT-1 表达与提高其转运功能,进而发挥保护神经的效果〔14〕。同时头孢曲松钠能显著改善脑水肿,缓解脑组织细胞缺氧,有效抑制HIF表达〔15〕。本次研究结果显示头孢曲松钠在糖尿病急性脑缺血再灌注治疗中的价值。
综上,头孢曲松钠在DM急性脑缺血再灌注的治疗中具有较高的应用价值,能显著降低细胞凋亡数量、改善脑水肿症状以及抑制HIF表达,从而起到保护神经的效果。
4 参考文献
1张鲜红.脑出血继续出血危险因素探讨〔J〕.中国医师杂志,2012;2(z2):60-1.
2范瑞娟,罗亚非,孙玉凤.新式线栓法建立大鼠局灶性脑缺血再灌注模型的建立〔J〕.中国民族民间医药,2014;23(2):26-7.
3唐宝苍,马建国,毕向锋.依达拉奉对糖尿病脑缺血再灌注大鼠细胞凋亡及缺氧诱导因子表达的影响〔J〕.中风与神经疾病杂志,2010;27(6):521-3.
4张亚敏,徐 虹,孙 华,等.线栓法制作大鼠局灶性脑缺血再灌注模型的研究及体会〔J〕.医学研究杂志,2014;43(1):27-30.
5景 丽,张建忠,马 轶,等.高血糖加重全脑缺血再灌注后缺血不敏感区神经元损伤〔J〕.解剖学杂志,2011;34(4):496-9.
6邢变枝,陈 晖,王 磊,等.缺血后处理对大鼠脑缺血再灌注损伤后环氧合酶-2的影响〔J〕.职业与健康,2013;29(18):2291-3.
7林冬融,韩江全,胡泳涛.高血糖对大鼠脑缺血再灌注后神经细胞凋亡及细胞色素C表达的影响〔J〕.中国老年学杂志,2013;33(16):3878-80.
8Batra A,Latour LL,Ruetzler CA,etal. Increased plasma and tissue MMP levels are associated with BCSFB and BBB disruption evident on post-contrast FLAIR after experimental stroke〔J〕. J Cereb Blood Flow Metab,2010;30(6):1188-99.
9黄 惠,王 岭,李 艳,等.黄芪注射液对大鼠脑缺血再灌注损伤的保护作用研究〔J〕.卒中与神经疾病,2014;21(1):19-22.
10Singh N, Sharma G, Mishra V.Hypoxia inducible factor-1: its potential role in cerebral ischemia〔J〕.Cell Mol Neurobiol,2012;32(4):491-507.
11Alta M, Meydan S, Aras M,etal.Effects of ceftriaxone on ischemia/reperfusion injury in rat brain〔J〕.J Clin Neurosci,2013;20(3):457-61.
12刘春华,王维治.头孢曲松钠对脑缺血再灌注大鼠脑损伤和谷氨酸转运体-1表达的影响〔J〕.中风与神经疾病杂志,2011;28(7):583-5.
13Thöne-Reineke C, Neumann C, Namsolleck P,etal.The beta-lactam antibiotic, ceftriaxone, dramatically improves survival, increases glutamate uptake and induces neurotrophins in stroke〔J〕.J Hypertens,2008;26(12):2426-35.
14Li F, Huang L, Su XL,etal.Inhibition of nuclear factor-κB activity enhanced chemosensitivity to cisplatin in human lung adeno-carcinoma A549 cells under chemical hypoxia conditions〔J〕.Chin Med J (Engl),2013;126(17):3276-82.
15Osumi T,Awazu T,Fujimura E,etal.Leukemia kidney infiltration can cause secondary polycythemia by activating hypoxia-inducible factor (HIF) pathway〔J〕.Eur J Pediatr,2013;172(6):829-32.
