敲低hnRNP H基因对子宫内膜癌Ishikawa细胞增殖和细胞周期的影响及意义
2014-09-12赵向寨卢庆玲
赵向寨 卢庆玲 郭 影 王 璟
(河北医科大学第三医院,河北 石家庄 050010)
子宫内膜癌是发生于子宫内膜的一组上皮性恶性肿瘤,是女性生殖道三大恶性肿瘤之一〔1〕。核不均一核糖体蛋白H(hnRNP H)是hnRNPs家族成员。hnRNPs家族参与mRNA转运、代谢、剪切、表达等体内多种调节过程〔2〕。肺癌、胰腺癌、妊娠滋养细胞肿瘤〔3~6〕等多种肿瘤研究相关报道提示,hnRNP A2/B1、hnRNP H和hnRNP K与肿瘤转移正相关。本研究采用RNA干扰技术构建靶向hnRNP H-1,干扰RNA(siRNA),转染子宫内膜癌Ishikawa细胞,敲低hnRNP H基因表达,探讨其对子宫内膜癌细胞增殖、细胞周期的影响,旨在为子宫内膜癌基因治疗寻找靶点。
1 材料与方法
1.1材料 人子宫内膜癌细胞株(Ishikawa)购于中国科学院上海细胞库,DMEM培养基、胎牛血清、胰蛋白酶购自GIBCO公司;hnRNP H siRNA、Control siRNA-A、siRNA转染试剂购自Santa Cruz公司;hnRNP H、增殖细胞核抗原(PCNA)、细胞周期蛋白依赖蛋白激酶(CDK4)及细胞周期蛋白(CyclinD1)抗体均购自Santa Cruz公司。
1.2细胞培养 人子宫内膜癌Ishikawa细胞株由中国科学院上海细胞库提供,细胞经10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素DMEM培养基培养,37℃、5%CO2饱和度和湿度恒温培养箱中孵育。0.25%胰蛋白酶消化细胞传代,取对数生长期细胞。胰酶消化细胞计数,稀释细胞,使得细胞密度为4×105个/ml,铺于无菌6孔培养板中,培养12 h至Ishikawa细胞融合率达50%,弃去原细胞培养液,换无血清DMEM培养液,按转染试剂盒说明书要求用Transfection regent稀释hnRNP H siRNA、Control siRNA及转染试剂Transfection medium/regent。实验分组:正常培养Ishikawa细胞组(control)、转染hnRNP H siRNA细胞组、转染Control siRNA细胞株(Mock组)。转染试剂作用6 h,无血清培养基冲洗细胞,换含10%血清、抗生素培养基继续培养。于转染24 h后,分别搜集细胞提取总RNA及总蛋白待测。
1.3实时定量PCR检测各蛋白 mRNA水平表达 转染后24 h,提取总RNA,测定A260/A280值介于1.8~2.0间。以肌动蛋白(β-actin)作为内参,总RNA 浓度为1 mg/ml进行逆转录,将cDNA为模版进行PCR反应,PCR反应条件:预变性95℃ 10 s,95℃ 5 s,60℃ 30 s,目的基因30个循环,内参循环数设定为25循环。扩增完毕,溶解曲线进行分析,以β-actin为内参,利用CT值计算各组hnRNP H mRNA相对值。用2-△△CT表示。各目的基因引物序列-hnRNP H:5′-TGCCAAATATGAATAACGACCCA-3′,5′-GAGAAAAGTGCTCGTCACTGT-3′;PCNA: 5′-AAACTAGCTAGACTTTCCTC-3′ ,5′-TCACGGCCATGGCCAGGTTG-3′,CDK4:5′-CTGTGGACATGTGGAGTGTTG-3′和5′-GGCAGAGATTCGCTTGTGTG-3′,CyclinD1:5′-CTGTCCTACTACCGCCTCAC-3′和5′-CACCTCCTCCTCCTCCTCTT-3′内参引物序列5′-GGTCCTACGTTCACCAACACA -3′,5′- CTCTGGGTCACATGGCTCT -3′。
1.4Western印迹法检测各目的基因蛋白水平表达 转染24 h后,提取各组细胞,预冷磷酸盐缓冲液(PBS)洗涤,于冰上进行操作,细胞裂解液裂解细胞,提取蛋白,二喹啉甲酸(BCA)法蛋白定量,各组取等量细胞总蛋白于12%+二烷基硫酸钠-聚丙稀酰胺凝胶(SDS-PAGE)电泳分离蛋白,半干法转至硝酸纤维素(NC)膜,含5%脱脂奶粉Tris盐酸盐缓冲液(TBS)室温封闭1 h, hnRNP H(鼠抗1∶200,SANTA CRUZ)PCNA(鼠抗1∶500,SANTA CRUZ)、CDK4(兔抗1∶500,SANTA CRUZ)、CyclinD1(兔抗1∶500,SANTA CRUZ)和GAPDH(兔抗1∶2 000,Abcam),4℃过夜;二抗(羊抗鼠或羊抗兔1∶5 000)37℃ 1.5 h;增强化学发光法(ECL)显色 ,凝胶成像系统扫描分析。
1.5四甲基偶氮唑蓝比色法(MTT)检测细胞存活率 将呈对数期生长的子宫内膜癌Ishikawa细胞计数,以5×103/ml,每孔100 μl接种于96孔板,于37℃、5%CO2恒温无菌培养箱中继续培养,12 h细胞融合达70%,各组细胞按上述分组干预,各设3个复孔,继续培养24 h,每孔加入浓度为5 mg/ml MTT 10 μl,继续培养4 h,弃去培养液后每孔加入二甲基亚砜150 μl,微量振荡器震荡30 min,酶标仪测定各孔的吸光度A值(A570),及细胞存活率。
1.8统计学处理 采用SPSS17.0统计软件进行χ2检验。两组均数比较采用成组设计t检验,多样本均数比较采用单因素方差分析,分析时间浓度效应采用析因涉及的方差分析。
2 结 果
2.1hnRNP H siRNA转染后目的基因在蛋白及mRNA水平的表达 Control组设为1,转染hnRNP H siRNA 24 h后hnRNP H 蛋白(0.170±0.053)表达明显降低约为Mock组(0.985±0.026)的(17±5.3)% ,转染hnRNP H siRNA 24 h后hnRNP H 表达在mRNA水平(0.210±0.032)明显降低约为Mock组(0.993±0.024)的(21±3.2)%。见图1。
2.2hnRNP H siRNA转染后细胞增殖及周期相关蛋白在蛋白及mRNA水平的表达 结果所示转染hnRNP H siRNA 24 h后增殖及周期相关蛋白PCNA,CDK4及CyclinD1 表达明显降低分别约为对照组的(70±2.1)%,(61±1.9)%,(30±5.4)%,见图2。转染hnRNP H siRNA 24 h后增殖及周期相关蛋白PCNA,CDK4及CyclinD1 表达在mRNA水平明显降低结果以2-△△CT表示分别为 0.79±0.121,0.57±0.004,0.23±0.106(图3)。
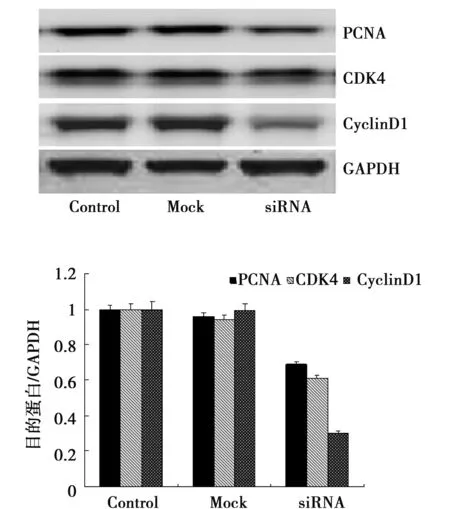
图2 hnRNP H siRNA转染后PCNA、CDK4、Cyclin D1在蛋白水平的表达
2.3hnRNP H siRNA转染后24 h对细胞存活率的影响 Control组设为1,转染hnRNP H siRNA 24 h后细胞存活率(0.560±0.054)显著降低,约为Mock组(0.987±0.017)的 (56±5.4)%。

图3 hnRNP H siRNA转染后PCNA、CDK4、Cyclin D1在mRNA水平的表达
3 讨 论
子宫内膜癌的发病原因不明,hnRNPs是一族高度保守的核蛋白家族,同RNA多聚酶Ⅱ转录产生的hnRNP颗粒密切相关,参与DNA、RNA、miRNA等多种生物行为。尤其影响哺乳动物的主要基因表达,家族成员与选择性转录剪切、翻译后修饰相关,其中研究较多的是hnRNP A/B亚家族,多种癌症相关研究中均有其不同作用。目前相关报道,hnRNP F/H亚家族与hnRNP A/B亚家族功能相似〔7〕。hnRNP H在肝癌、胰腺癌、喉癌中均被证实过表达〔8,9〕,但国内外报道中较少文献涉及子宫内膜癌。本系列研究已证实子宫内膜癌组织及Ishikawa细胞检测hnRNP H过表达,现通过干扰RNA技术转染至子宫内膜癌Ishikawa细胞,敲低hnRNP H基因表达,转染hnRNP H siRNA 24 h后hnRNP H 蛋白表达明显降低MTT检测对照组、阴性对照组、siRNA组细胞存活率,Western印迹检测转染hnRNP H siRNA 24 h后增殖及周期相关蛋白PCNA、CDK4及CyclinD1 表达明显降低,且在mRNA水平也明显降低。增殖细胞核抗原具有DNA多聚酶辅助因子的功能,是细胞周期调控蛋白,反映细胞增殖程度,表明PCNA过度表达与子宫内膜癌细胞增殖呈正相关,参与子宫内膜癌细胞侵袭作用,沉默hnRNP H基因检测PCNA蛋白表达下降,提示敲低hnRNP H基因能有效抑制子宫内膜癌细胞侵袭能力。CDKs调节细胞增殖分化,与其调控结合蛋白(Cyclin)发生异常时,导致肿瘤发生,表现为细胞增殖异常、分化调控异常〔10〕。本研究结果表明CDK4、CyclinD1过度表达与子宫内膜癌恶性转化及侵袭行为呈正相关〔11〕,沉默hnRNP H基因检测CDK4、Cyclin D1蛋白明显低于未转染组,说明敲低hnRNP H基因可阻滞细胞周期转化,抑制子宫内膜癌细胞细胞周期调节失控。
综上所述,沉默hnRNP H基因能有效抑制子宫内膜癌细胞侵袭能力,阻滞肿瘤细胞向S期转化,hnRNP H基因可能成为子宫内膜癌基因治疗的潜在靶点。
4 参考文献
1谢 幸,苟文丽.妇产科学〔M〕.第8版.北京:人民卫生出版社,2013:978-81.
2Han SP, Tang YH,Smith R. Functional diversity of the hnRNPs: past,present and perspectives〔J〕. Biochem J, 2010;430(3):379-92.
3Boukakis G, Patrinou-Georgoula M, Lekarakou M,etal. Deregulated expression of hnRNP A/B proteins in human non-small cell lung cancer: parallel assessment of protein and mRNA levels in paired tumour/non-tumour tissues〔J〕. BMC Cancer, 2010;17(10):434.
4Zhou R, Shanas R, Nelson MA,etal. Increased expression of the heterogeneous nuclear ribonucleoprotein K in pancreatic cancer and its association with the mutant P53〔J〕. Int J Cancer,2010;126(2):395-404.
5戴春芳,石中华,王 芸.hnRNP E1对妊娠滋养细胞疾病恶变的早期预测价值评估.〔J〕.现代妇产科进展,2013;22(7):572-4.
6Zhang T, Huang XH, Dong L,etal. PCBP-1 regulates alternative splicing of the CD44 gene and in hibits invasion in human hepatoma cell line HepG2 cells〔J〕. Mol Cancer,2010;9(1):72.
7Rauch J, O′eill E,Mack B,etal. Heterogeneous nuclear ribonucleoprotein H blocks MST2-mediated apoptosis in cancer cells by regulatin a-raf transcription〔J〕.Cancer Res,2010;70(4):1679-88.
8Honore B, Baandrup U,Vorum H.Heterogeneous nuclear ribonucleoprotins F and H/H’ show differential expression in normal and selected cancer tissues〔J〕.Exp Cell Res,2004;294(1):199-209.
9Rauch J,Ahlemann M, Schaffrik M,etal. Allogenic antibody-mediated identification of head and neck cancer antigens〔J〕.Biochem Biophys Res Commun,2004;323(1):156-62.
10Malumbres M, Harlow E, Hunt T,etal.Wolgrmuth DJ:Cyclin-dependent kinases: a family portrait〔J〕. Nat Cell Biol,2009;11(11):1275-6.
11冯玉华,林宇静.Cyclin D1,Cdk4在子宫内膜癌中的表达与意义〔J〕.中国实用医药,2013;8(12):36-7.
