硝铵磷水溶液热稳定性研究
2014-09-11朱晋宇谷明朝
朱晋宇, 曹 雄, 谷明朝
(中北大学化工与环境学院,山西 太原 030051)
引 言
目前,一些化肥企业使用硝铵磷替代硝酸铵生产复合肥。硝铵磷是90%的硝酸铵和10%磷酸一铵的混合物,其主要成分是硝酸铵,水溶液在配制、存储和使用过程中,可能会因硝酸铵的分解放热而导致爆炸事故的发生,从而对企业的安全生产构成严重的威胁[1]。
纯硝酸铵在常温下是稳定的,受打击、碰撞或摩擦均不敏感。但随着温度的升高,就会严重影响或改变其物理和化学性质,甚至导致体系的不稳定或爆炸。自实现工业化生产以来,世界各国在其生产、运输及储存过程中都发生过爆炸及着火事故。因此,研究硝铵磷水溶液的热分解规律,对于探讨事故原因和避免类似事故的发生具有十分重要的意义[2]。
本文的目的在于研究不同浓度硝铵磷水溶液的热稳定性,利用自制临界爆炸测试装置对不同浓度硝铵磷水溶液的热稳定性进行测试分析,以便更好地避免火灾、爆炸事故的发生,提高硝铵磷水溶液在生产、储存及使用过程中的安全性。研究硝铵磷水溶液的安全性对复合肥生产工艺具有实际的指导意义。
1 实验部分
1.1 实验药品及仪器
1.1.1 实验药品
固体硝铵磷、蒸馏水。
1.1.2 实验仪器
溶液热爆炸装置(爆炸罐)、绝热加热炉、安全防护箱、临界爆炸温度测试系统。
1.1.3 实验装置及原理
实验装置主要由加热装置、防爆箱、爆炸罐、热电偶、临界爆炸温度测试系统组成。
本实验的主要原理是采用加热装置对爆炸容器进行加热,通过温度调节装置对升温速率进行控制和调节,使硝铵磷水溶液按设定的升温速率加热,并通过温度测试装置测量硝铵磷水溶液在加热过程中的温度。实验原理如图1。
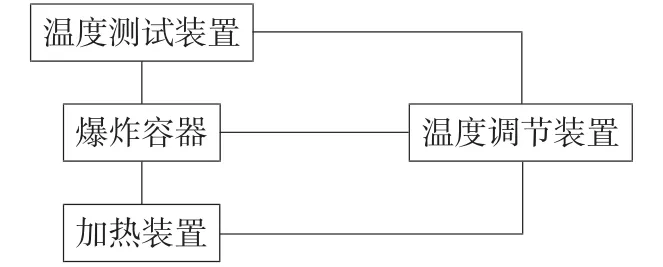
图1 实验装置原理图
1.2 实验方法
1.2.1 烘药
为了不影响实验结果,在实验前先对固体硝铵磷进行烘干处理。
1.2.2 密闭性检查
实验前先测试实验装置的密闭性。在爆炸容器中加入10mL水,先加热至100℃,再使其自然冷却至室温。将剩余水量与实际值进行对比,若误差在3.0%以内,可认为测试装置的密闭性、精确性较好。
1.2.3 称药
为了准确,本实验选用电子天平称取药品。分别称取7.0、8.0、9.0、9.5g固体硝铵磷,再用量筒称取蒸馏水的质量为3.0、2.0、1.0、0.5g,配方见表1。

表1 不同浓度硝铵磷水溶液的配制
2 结果与分析
调节控温系统,加热初始温度调为20℃,升温速率为3℃/min,使加热炉按照设定的速率加热。表2为临界爆炸温度测试实验得到的10g不同质量分数硝铵磷的临界爆炸温度。

表2 不同质量分数硝铵磷的临界爆炸温度
根据表2实验结果绘制出硝铵磷水溶液临界爆炸温度,如图2所示。
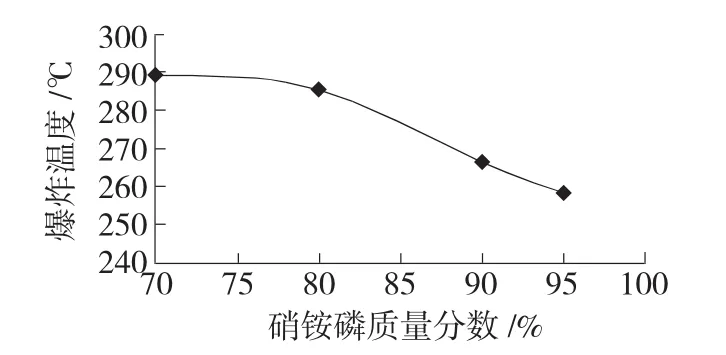
图2 不同质量分数硝铵磷水溶液的临界爆炸温度
由图2可以看出,随着硝铵磷水溶液浓度的增大,其临界爆炸温度降低。硝铵磷分解时,由于硝酸铵分子中存在大量的氧化基和还原基,因而分子间氧化还原可能产生N2O、N2、NO2、NO等。理论上分析,硝酸铵可能发生的分解反应如反应式(1)~(9)。
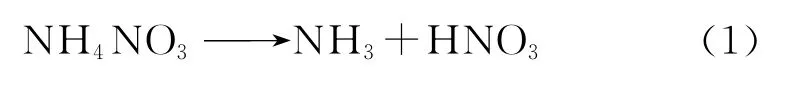
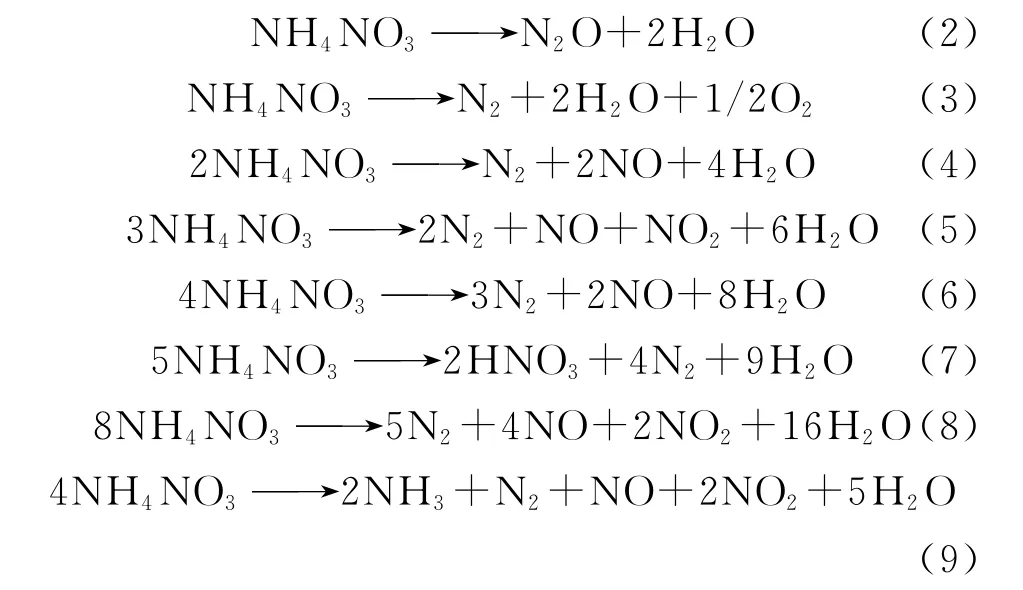
除反应(1)外,其余均为氧化还原的分解反应,且反应(1)~(9)的产物还可能继续相互作用,如硝酸和氨在气相中反应生成氮气、氨同氮氧化物发生进一步反应等。由于热分解过程是在较高温度下进行的,而实验中一般往往只能全面分析冷却后的系统状况,这与冷却前的状况有很大的区别,因此,确切证实热分解过程是十分困难的。已被实验证明实际存在的反应只有(1)、(2)和(3)。反应(1)在110℃开始,在150℃~200℃显著;当温度在200℃~270℃时,分解反应(2)是基本反应;而当温度进一步升高时,硝酸铵按式(3)进行分解,且速度急剧加快,已具有爆炸式分解的特点。反应式(4)~(9)实质上并不是实际存在的热分解反应,只是根据分解物的分析结果来解释反应过程的说明公式。系统中最终生成的产物及其比例,取决于温度、加热速度、系统压力和硝酸铵的质量等热分解条件[3-4]。
3 结论
1)不同浓度硝铵磷溶液的临界爆炸温度不相同。在一定范围内,随着浓度的增加,溶液的临界爆炸温度降低。浓度太低或者太高都不容易爆炸。
2)温度低于150℃时,甚至仅稍高于常温的情况下硝铵磷也会发生分解。
[1]朱劭涌,曹雄.浓度对硝酸铵水溶液热稳定性的影响研[J].爆破,2012,29(1):102-105.
[2]王春丽.硝酸铵水溶液热安全性研究[D].太原:中北大学,2010.
[3]Oxley J C,Smith J L,Evan Rogers.Ammonium nitrate:thermal stability and explosivity modifiers[J].Thermochimica Acta,2002,384(1/2):23-45.
[4]中国农业科学院土壤肥料研究所.中国肥料[M].上海:科学技术出版社,1994:219.
