RhoA/ROCK信号通路在糖尿病结肠肌层中的表达
2014-09-11孙晓萌王庆娥柏建安
孙晓萌 朱 滢 王庆娥 柏建安 林 琳
南京医科大学第一附属医院消化科(210029)
胃肠动力障碍是糖尿病(diabetes mellitus, DM)极为常见的并发症,严重影响患者的生活质量和降糖药物的作用,其发病机制涉及氧化应激[1]、肠神经元减少[2]、糖基化终末产物(advanced glycation end-products, AGEs)形成[3]、Cajal间质细胞减少[4]等多个方面。但这些机制尚不能完全解释DM胃肠动力障碍的病因,随着研究的深入,胃肠平滑肌肌源性因素在该病中的作用引起关注,其中平滑肌细胞(smooth muscle cell, SMC)自身病变起关键作用。RhoA/ROCK信号通路在体内普遍存在,参与调节包括SMC在内的多种细胞的功能。近年,RhoA/ROCK信号通路在DM并发症中的作用引起了研究者的重视。本实验通过观察比较血糖正常者以及DM患者结肠肌层中RhoA/ROCK信号通路主要信号分子的表达变化,旨在探讨该信号通路在DM结肠动力障碍发病中的可能作用。
对象与方法
一、研究对象
结肠组织标本取自2012年9月-2013年12月南京医科大学第一附属医院普外科行结肠癌根治术患者,收集距肿瘤边缘5 cm以上的远端正常结肠组织。所有标本均经组织病理学检查确诊。根据糖化血红蛋白水平,将所有研究对象分为对照组和DM组。对照组30例,为结肠癌无合并DM患者,其中男18例,女12例,平均年龄(59.1±10.0)岁;DM组22例,为结肠癌合并DM患者,DM均为Ⅱ型,其中男14例,女8例,平均年龄(67.2±10.0)岁。DM诊断依据1999年世界卫生组织(WHO)标准。所有患者术前均未行放化疗,均除外甲状腺功能亢进和糖皮质激素类药物使用史,排除既往有腹部手术史者。本研究方案经南京医科大学第一附属医院医学伦理委员会批准,入选者均签署知情同意书。
二、研究方法
1. 免疫组化法:结肠组织常规包埋、切片、脱蜡、水化、抗原修复。加入兔抗RhoA一抗(工作浓度1∶100,Abcam公司),4 ℃孵育过夜。滴加辣根过氧化物酶标记的二抗(福州迈新生物技术开发有限公司),室温孵育45 min。加入二氨基联苯胺显色,自然水终止反应,苏木素复染。梯度乙醇脱水,二甲苯透明,树胶封片。
结果判断:胞质出现棕黄色物质为阳性反应。每张切片选择5~10个高倍镜视野,应用Image-Pro Plus 6.0图像分析系统进行分析并计算RhoA阳性细胞面积。
2. 蛋白质印迹法:提取结肠平滑肌组织蛋白,采用BCA法定量蛋白浓度,80 μg蛋白/泳道行SDS-PAGE凝胶电泳分离总蛋白,随后100 V恒压将蛋白转至硝酸纤维素膜,室温下5%脱脂牛奶封闭2 h,分别加入抗RhoA一抗(工作浓度1∶1 000,Abcam公司)、抗ROCK1一抗(工作浓度1∶1 000,SAB公司)、抗肌球蛋白磷酸酯酶靶点亚单位1(MYPT1)一抗(工作浓度1∶1 000,Cell Signaling Technology, Inc)、抗磷酸化肌球蛋白磷酸酯酶靶点亚单位1(p-MYPT1)一抗(工作浓度1∶1 000,Cell Signaling Technology, Inc)和内参β-actin(工作浓度1∶1 000,Biogot Biotechnology CO., Ltd),4 ℃孵育过夜,加入二抗,ECL化学发光法显影。
三、统计学分析
结 果
一、免疫组化结果
免疫组化结果显示,RhoA蛋白在对照组和DM患者结肠纵肌层和横肌中均有分布,主要表达于细胞质;DM组RhoA蛋白阳性染色面积较对照组明显减少,差异有统计学意义(P<0.05)(图1)。
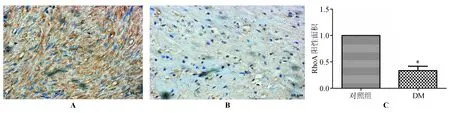
*P<0.05
二、蛋白质印迹结果
蛋白质印迹法显示,RhoA、ROCK1、MYPT1和p-MYPT1在正常结肠肌层中的表达灰度值分别为1.15±0.69、0.75±0.05、1.21±0.80和1.04±0.47,其中RhoA、ROCK1和p-MYPT1蛋白的灰度值较DM组(0.62±0.42、0.54±0.09和0.70±0.28)明显增高,差异均有统计学意义(P<0.05),而MYPT1蛋白的灰度值无明显差异(1.21±0.80对0.94±0.50,P>0.05)(图2)。
讨 论
胃肠动力障碍是DM极为常见的并发症,约75%的DM患者伴有胃肠道症状[1,5],其中便秘为最常见的症状[6],其病理生理学特点为结肠张力和收缩力减弱、蠕动减慢、排空延迟等。目前DM胃肠动力障碍的发病机制尚未完全明确,多认为与自主神经病变、胃肠激素、微血管病变等有关;近年研究认为胃肠平滑肌肌源性因素对该病的发生亦有重要作用。
G蛋白(即鸟嘌呤核苷酸结合蛋白)是细胞信号转导通路中最为经典的信号分子之一,分为两类:一类是与膜受体耦合的异三聚体G蛋白,介导细胞因子、生长因子等的跨膜信号转导;另一类称为小分子G蛋白,因其分子质量在20~30 kDa 之间而得名。RhoA是小分子G蛋白Rho亚家族中研究最多、最为清楚的成员之一,分布于大多数具有收缩功能的细胞,如心肌细胞、SMC等[7]。RhoA蛋白常以非活化的RhoA-GDP形式存在于细胞质中,当受到细胞外刺激信号如磷脂酶C等的作用时,GDP转变为GTP,RhoA-GDP因此活化成RhoA-GTP,并且转移至细胞膜中[8]。ROCK是RhoA蛋白下游最主要的效应分子[9],是一种分子质量约为160 kDa的丝氨酸/苏氨酸蛋白激酶。ROCK包含ROCK1和ROCK2两种亚型,其中ROCK1广泛分布于各种人体组织中,而ROCK2主要分布于骨骼肌和脑组织中[10-11]。
目前已发现多种细胞外刺激因素可诱导RhoA/ROCK通路活化,活化后的RhoA/ROCK通路可与多条细胞内信号转导途径相互作用,参与调节细胞的多种功能,包括细胞收缩、细胞分化、基因表达、细胞凋亡等。RhoA/ROCK信号通路激活对于不同组织的细胞可产生不同的效应,其中对平滑肌组织的生物学效应主要是调节SMC收缩。
SMC收缩是一个复杂事件,其中肌球蛋白轻链(myosin light chain, MLC)的磷酸化水平是决定收缩程度的关键因素之一。MLC的磷酸化水平受钙离子/钙调蛋白依赖的肌球蛋白轻链激酶(myosin light chain kinase, MLCK)和钙离子非依赖的肌球蛋白轻链磷酸酶(myosin light chain phosphatase, MLCP)的双重调节。MLCK磷酸化MLC,导致平滑肌收缩;MLCP通过其亚单位与已磷酸化的MLC结合,使其去磷酸化,引起平滑肌舒张。MLCP的抑制可使磷酸化MLC表达和平滑肌收缩进一步增强,这种现象称之为“钙敏化”。近年,钙敏化的具体机制成为研究热点,已证实RhoA及其底物ROCK是介导钙敏化的主要因素。活化后的ROCK可通过直接磷酸化MLC和抑制MLCP活性双重途径来调节平滑肌收缩。其中ROCK主要通过两条途径抑制MLCP活性,其一是通过磷酸化MLCP的调节亚单位MYPT1,使其失去催化MLC脱磷酸化的能力,细胞质内磷酸化MLC水平提升,平滑肌收缩;因此,p-MYPT1的表达水平常被认为是ROCK活性的重要标志。另一条途径是ROCK通过磷酸化一种平滑肌特异性磷蛋白CPI-17,使其发生一系列构象改变而抑制MLCP活性。

1 Da=0.992 1 u
研究证实,高血糖可引起一系列的代谢紊乱,包括蛋白质的非酶糖化、氧化应激以及一些信号通路的异常。近年RhoA/ROCK信号转导途径在DM并发症发生、发展中的作用引起人们的重视,但目前该信号通路与DM并发症关系的研究主要集中在神经、心血管以及肾脏等系统病变,在胃肠病变中的研究较少。平滑肌是维持胃肠运动的基础,胃肠动力性疾病的发生与平滑肌收缩性的改变密切相关。Bhetwal等[12]探讨平滑肌病变与DM胃轻瘫的关系时发现,DM胃轻瘫小鼠胃平滑肌组织中ROCK的表达减少,推测DM胃轻瘫的发生可能部分与RhoA/ROCK信号通路被抑制有关;研究[13]还表明,在结肠炎等疾病状态下存在肠运动紊乱时,一些钙敏感蛋白如MYPT1和CPI-17的表达异常。但迄今尚缺乏RhoA/ROCK信号通路活性改变对DM结肠动力影响的报道。
文献报道,约60%的DM患者存在结肠动力障碍[14]。本研究的前期研究[15-16]发现,DM大鼠结肠平滑肌收缩性减弱,结肠转运时间延迟;同时DM大鼠结肠平滑肌组织中MLC的磷酸化表达减少。本研究进一步发现,DM结肠肌层中RhoA蛋白和ROCK1蛋白表达较对照组明显减少,提示RhoA/ROCK信号转导途径表达下调;p-MYPT1蛋白表达减少,进一步表明RhoA/ROCK信号通路活性被抑制,由此推测DM结肠组织内RhoA/ROCK信号通路活性被抑制以及由此导致的MLC磷酸化表达减少可能与DM结肠动力障碍有一定相关性。但由于本研究所纳入对象均未行结肠动力测定,缺乏临床动力学参数,尚无法判断该信号通路的活性变化与DM结肠动力障碍的确切关系,还有待于DM动物模型以及细胞水平的进一步研究探讨。
AGEs是蛋白质和脂类非酶糖基化后生成的多种不同物质的统称,广泛存在于血液和各种组织中。正常人体内AGEs水平随年龄增长缓慢增加,但在DM状态下,AGEs能加速形成。通过对DM患者或DM动物模型的研究[17-18]发现,DM血清或结肠组织中AGEs水平均显著升高。AGEs与DM的多种并发症密切相关,其可通过氧化应激、糖基化修饰某些蛋白等受体依赖性和非依赖性途径促进DM并发症的发生、发展[19]。RAGE是第一个被报道的AGEs受体,属免疫球蛋白超家族成员。AGEs及其受体RAGE已被作为DM并发症的重要病理机制[20],包括心脏病[21]、肾病[22]、视网膜病变[23]等。根据对组织器官的影响,AGEs及其受体RAGE可能参与介导了DM胃肠道并发症的发生,但具体机制目前尚不明确。研究发现,SMC、内皮细胞等均表达RAGE。本研究的前期研究[16]提示,AGEs能抑制结肠SMC内MLC的磷酸化,结合本研究结果,推测AGEs可能部分通过抑制结肠肌层组织中RhoA/ROCK信号通路活性引起MLC的磷酸化减少,最终导致平滑肌收缩减弱、结肠动力障碍。但AGEs是否可抑制RhoA/ROCK信号通路以及AGEs是否通过RAGE受体等受体依赖途径抑制该信号通路等均有待于细胞实验的进一步探讨。
综上所述,RhoA/ROCK信号通路活性下降可能与DM结肠动力障碍有关,但DM时该通路活性改变的具体机制尚未完全阐明,有待继续研究。随着基础研究的进一步深入以及临床经验的不断积累,DM合并便秘的治疗方法必将进一步完善,从而提高疗效。
1 Chandrasekharan B, Anitha M, Blatt R, et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress[J]. Neurogastroenterol Motil, 2011, 23 (2): 131-138, e26.
2 Furlan MM, Molinari SL, Miranda Neto MH. Morpho-quantitative effects of acute diabetes on the myenteric neurons of the proximal colon of adult rats[J]. Arq Neuropsiquiatr, 2002, 60 (3-A): 576-581.
3 Jeyabal PV, Kumar R, Gangula PR, et al. Inhibitors of advanced glycation end-products prevent loss of enteric neuronal nitric oxide synthase in diabetic rats[J]. Neurogastroenterol Motil, 2008, 20 (3): 253-261.
4 Yamamoto T, Watabe K, Nakahara M, et al. Disturbed gastrointestinal motility and decreased interstitial cells of Cajal in diabetic db/db mice[J]. J Gastroenterol Hepatol, 2008, 23 (4): 660-667.
5 Maleki D, Camilleri M, Burton DD, et al. Pilot study of pathophysiology of constipation among community diabetics[J]. Dig Dis Sci, 1998, 43 (11): 2373-2378.
6 Bytzer P, Talley NJ, Hammer J, et al. GI symptoms in diabetes mellitus are associated with both poor glycemic control and diabetic complications[J]. Am J Gastroenterol, 2002, 97 (3): 604-611.
7 解翼虎, 覃文新, 万大方, 等. Rho蛋白[J]. 生命的化学, 2002, 22 (1): 21-24.
8 Narumiya S, Yasuda S. Rho GTPases in animal cell mitosis[J]. Curr Opin Cell Biol, 2006, 18 (2): 199-205.
9 Bustelo XR, Sauzeau V, Berenjeno IM. GTP-binding proteins of the Rho/Rac family: regulation, effectors and functionsinvivo[J]. Bioessays, 2007, 29 (4): 356-370.
10 Nakagawa O, Fujisawa K, Ishizaki T, et al. ROCK-Ⅰ and ROCK-Ⅱ, two isoforms of Rho-associated coiled-coil forming protein serine/threonine kinase in mice[J]. FEBS Lett, 1996, 392 (2): 189-193.
11 Leung T, Chen XQ, Manser E, et al. The p160 RhoA-binding kinase ROK alpha is a member of a kinase family and is involved in the reorganization of the cytoskeleton[J]. Mol Cell Biol, 1996, 16 (10): 5313-5327.
12 Bhetwal BP, An C, Baker SA, et al. Impaired contractile responses and altered expression and phosphorylation of Ca(2+) sensitization proteins in gastric antrum smooth muscles from ob/ob mice[J]. J Muscle Res Cell Motil, 2013, 34 (2): 137-149.
13 Ohama T, Hori M, Sato K, et al. Chronic treatment with interleukin-1beta attenuates contractions by decreasing the activities of CPI-17 and MYPT-1 in intestinal smooth muscle[J]. J Biol Chem, 2003, 278 (49): 48794-48804.
14 Phillips LK, Rayner CK, Jones KL, et al. An update on autonomic neuropathy affecting the gastrointestinal tract[J]. Curr Diab Rep, 2006, 6 (6): 417-423.
15 Wang Y, Xu XY, Tang YR, et al. Effect of endogenous insulin-like growth factor and stem cell factor on diabetic colonic dysmotility[J]. World J Gastroenterol, 2013, 19 (21): 3324-3331.
16 朱滢, 孙晓萌, 王云, 等. 糖基化终末产物和磷酸化肌球蛋白轻链在糖尿病结肠动力障碍中的作用[J]. 胃肠病学, 2014, 19 (6): 328-331.
17 Chen P, Zhao J, Gregersen H. Up-regulated expression of advanced glycation end-products and their receptor in the small intestine and colon of diabetic rats[J]. Dig Dis Sci, 2012, 57 (1): 48-57.
18 Galler A, Müller G, Schinzel R, et al. Impact of metabolic control and serum lipids on the concentration of advanced glycation end products in the serum of children and adolescents with type 1 diabetes, as determined by fluorescence spectroscopy and nepsilon-(carboxymethyl)lysine ELISA[J]. Diabetes Care, 2003, 26 (9): 2609-2615.
19 Wei Q, Ren X, Jiang Y, et al. Advanced glycation end products accelerate rat vascular calcification through RAGE/oxidative stress[J]. BMC Cardiovasc Disord, 2013, 13: 13.
20 Wendt T, Bucciarelli L, Qu W, et al. Receptor for advanced glycation endproducts (RAGE) and vascular inflammation: insights into the pathogenesis of macrovascular complications in diabetes[J]. Curr Atheroscler Rep, 2002, 4 (3): 228-237.
21 Kato T, Yamashita T, Sekiguchi A, et al. AGEs-RAGE system mediates atrial structural remodeling in the diabetic rat[J]. J Cardiovasc Electrophysiol, 2008, 19 (4): 415-420.
22 Fukami K, Yamagishi S, Ueda S, et al. Role of AGEs in diabetic nephropathy[J]. Curr Pharm Des, 2008, 14 (10): 946-952.
23 Chen BH, Jiang DY, Tang LS. Advanced glycation end-products induce apoptosis involving the signaling pathways of oxidative stress in bovine retinal pericytes[J]. Life Sci, 2006, 79 (11): 1040-1048.
