烯二炔类抗肿瘤抗生素及其靶向药物研究近况
2014-09-08杨臻峥邢爱敏郑晓南顾觉奋
杨臻峥,邢爱敏,郑晓南*,顾觉奋
(1. 中国药科大学《药学进展》编辑部,江苏 南京 210009;2. 中国药科大学生命科学与技术学院,江苏 南京 210009)
烯二炔类抗肿瘤抗生素及其靶向药物研究近况
杨臻峥1,邢爱敏1,郑晓南1*,顾觉奋2**
(1. 中国药科大学《药学进展》编辑部,江苏 南京 210009;2. 中国药科大学生命科学与技术学院,江苏 南京 210009)
烯二炔类抗生素是一种结构新颖、作用机制独特的新型抗肿瘤抗生素,烯二炔结构是其活性中心。该类抗生素具有极强的抗肿瘤活性,却因毒性较大难以直接用于临床。近年来,研究人员展开了烯二炔类抗生素靶向药物的研发工作,以提高其肿瘤靶向性并减少药物毒副作用。归纳总结了已报道的天然来源的烯二炔类抗肿瘤抗生素及其活性代谢物,并重点介绍烯二炔类抗生素相关靶向药物的研究进展,旨在为其深度开发提供参考。
烯二炔类抗生素;分子靶标;靶向给药;单抗;抗肿瘤
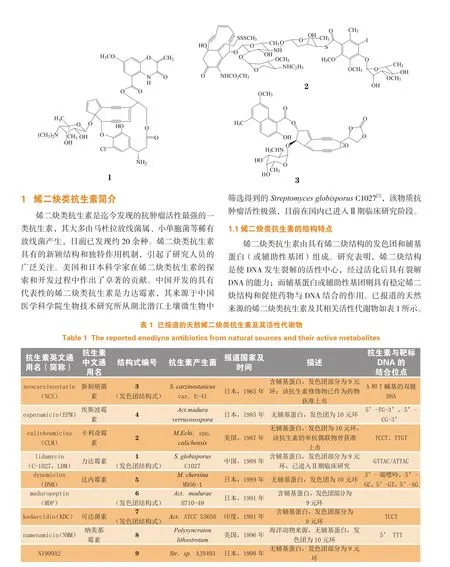
烯二炔类抗生素被认为是迄今为止抗肿瘤活性最强的一类抗生素,其分子结构特殊,作用机制新颖,具有广阔的开发前景。已发现的烯二炔类抗生素有力达霉素(lidamycin,LDM,发色团结构式为1)、卡利奇霉素(calicheamicins,CLM,2)以及新制癌菌素(neocarzinostatin,NCS,发色团结构式为3)等,它们对多种肿瘤,尤其是血液肿瘤均有良好的抑制活性。体外研究显示,力达霉素对白血病L-1210细胞、P388细胞、HP黑色素瘤细胞的IC50为1.5×10-17~3.1×10-16mol·L-1;动物体内研究显示,卡利奇霉素对P388白血病和B16黑色素瘤的ID50分别为5.0和1.25 μg·kg-1,新制癌菌素对L-1210白血病的ID50为380 mg·kg-1[1]。近年来有关烯二炔类抗生素作用机制、靶向药物设计及临床应用的研究逐渐增多并取得了一定成果,例如,新制癌菌素已用于临床肿瘤(如白血病、胃癌、胰腺癌等)的治疗;卡利奇霉素的单抗偶联物吉妥单抗于2000年在美国上市,用于复发性急性髓细胞性白血病,虽因安全性问题及疗效不明显于2010年撤市,但近两年又被发现可改善急性髓性白血病(AML)年轻患者的生存情况,故而受到业界学者的重新审视;力达霉素是我国发现的抗肿瘤活性强烈的大分子抗肿瘤抗生素,现已进入Ⅱ期临床研究。需强调的是,烯二炔类抗生素虽有优越的抗肿瘤活性,但因毒性较大,有效剂量范围窄,很难单独用于临床——该类抗生素自20世纪60年代被发现至今,极少被开发为药物并获准上市。研究人员尝试通过物理手段或化学修饰提高烯二炔类抗生素的肿瘤靶向性,以期提高药物活性,并尽可能把药物毒副作用降低到最小,此类研究亦逐渐成为烯二炔类抗生素研究中的热点方向。本文归纳总结了已报道的天然来源的烯二炔类抗肿瘤抗生素及其活性代谢物,并重点介绍烯二炔类抗生素相关靶向药物的研究进展,旨在为其深度开发提供参考。


达水平极低。随着对白血病研究的不断深入,白血病的分型依据也从临床症状转变为分子标记物,这也解释了一些临床症状相似的病人对药物应答效果不同的原因;此外,这些分子标记物的特异性表达亦构成了白血病靶向给药的理论基础。
肿瘤干细胞的存在最早是从AML中得到证实的。尽管学术界对于肿瘤干细胞的来源持有不同意见,但在其与肿瘤之间的关系方面已达成共识,即肿瘤干细胞是肿瘤耐药、复发的根源[8]。CD123是白血病干细胞(leukemia stem cells,LSC)特征性抗原之一,也是特异性识别并结合IL-3的关键部位。CD123在AML干细胞表面高表达,而在正常造血干细胞表面几乎不表达[9]。这一显著差异提示,可开发以CD123为靶点的药物,从而能选择性清除LSC或诱导LSC凋亡,使根治白血病成为可能。
CD22(Siglec-2)与CD33(Siglec-3)(见图1)现已被确定为B细胞型白血病细胞和骨髓型白血病细胞的特异性分子标记物[10-11]。其中,CD22在90%以上的恶性B细胞淋巴瘤中表达,而CD33在80%以上的AML细胞表面表达,这些分子标记物已成为白血病靶向给药系统研究中的热点。

图1 CD22与CD33的结构示意图Figure 1 Structural diagram of CD22 and CD33
针对CD22与CD33这2种分子标记物,研究人员进行了许多有意义的尝试。卡利奇霉素是一种具有良好抗白血病活性的十环烯二炔类抗生素,无蛋白质部分,稳定性相对较高。研究人员设想,将其与抗CD22或抗CD33的单抗连接,或可进一步提高卡利奇霉素的靶向性:当卡利奇霉素的单抗导向药物进入机体后,单抗部分会寻找分子靶标CD33(或CD22)并与之结合,形成的细胞表面复合物可被白血病细胞迅速内吞,偶联卡利奇霉素和单抗部分的“连接链”随即在胞内酸性条件下断裂,水解释放卡利奇霉素,后者具有高亲脂性,可进入细胞核内产生细胞毒效应,从而阻滞细胞周期,阻止DNA修复,最终导致白血病细胞凋亡。白血病治疗药吉妥单抗(gemtuzumab ozogamicin,GO)就是基于这一设想,将卡利奇霉素与抗CD33单抗通过“二硫键”和“4-(4’-乙酰苯氧基)丁酸”连接得到的具有靶向性的单抗导向药物。该药在2000年5月经过美国FDA的快速审批程序被批准上市用于治疗AML,商品名为Mylotarg。然而,因西南肿瘤组(SWOG)的一项名为S0106的临床研究发现GO在安全性方面存在问题,且无法证明本品对受试患者有临床益处,辉瑞公司于2010年6月将GO从美国市场撤市。
2014年8月,一项由堪萨斯市儿童慈善医院和诊所(Children’s Mercy Hospitals and Clinics in Kansas City)的Gamis医生及其同事公布的临床研究结果为GO带来了新的希望。研究组发现,在儿童和年轻成人AML患者中,在标准化疗基础上加用GO可使3年复发风险降低17%并显著改善无事件生存率(event-free survival)。该研究中,1 022名年龄为1岁以下至29岁的AML患者被随机分成2组,组1在标准化疗基础上加用GO(剂量为3 mg·m-2,诱导疗程1期间给予1次,强化疗程2期间给予1次),组2受试者仅接受标准化疗。结果显示,组1和组2的3年无事件生存率分别为53.1%和46.9%[风险比(HR)为0.83;95% 置信区间(CI)为0.70~0.99;P=0.04]。在事后分析中,组1和组2的3年复发风险分别为32.8%和41.3%(HR为0.73;95% CI为0.58~0.91;P=0.006)。然而,组1和组2的3年总生存率无明显差异,分别为69.4%和65.4%(HR为0.91;95% CI为0.74~1.13;P=0.39)。两组的3~5级不良反应发生情况相似。研究人员表示,所有风险亚组在无事件生存率方面均无统计学显著改善。该试验结果虽与此前的S0106研究结果相悖,但与已发表的有关低危和中危AML成人的试验结果一致。未来还需开展更多研究,以充分评价GO及其他CD33靶向药物的最佳治疗方案[12]。
同样,研究人员还将卡利奇霉素与抗CD22单抗通过“二硫键”和“4-(4’-乙酰苯氧基)丁酸” 连接,得到了靶向性白血病治疗药物inotuzumab ozogamicin(CMC-544)[13]。在荷有B细胞淋巴瘤的小鼠中进行的研究表明,连续15 d给予CMC-544可显著延长模型小鼠的生存时间,单次给予CMC-544可有效延迟B细胞淋巴瘤引起的小鼠后肢瘫痪,且接受CMC-544的小鼠未见B细胞淋巴瘤的组织渗透[14]。目前,辉瑞和UCB制药公司正在进行有关CMC-544的多项临床研究,其中包括2项针对非霍奇金淋巴瘤(NHL)的Ⅱ期临床研究。GO和CMC-544的结构如图2所示。

图2 GO和CMC-544的结构示意图Figure 2 Structural diagram of GO and CMC-544
此外,我国也开展了烯二炔类抗生素-抗体偶联物的研发工作,其中研究最多的是力达霉素。力达霉素是中国医学科学院医药生物技术研究所利用本单位建立的抗肿瘤药物筛选方法——精原细胞法经过筛选大量发酵液样品而发现的抗生素,其抗肿瘤活性极强,且具有多重机制,包括直接断裂肿瘤细胞DNA、诱导肿瘤细胞凋亡和裂亡(也称有丝分裂细胞死亡,系指细胞经过一次有丝分裂后才死亡的现象)、诱导肿瘤细胞产生衰老样表型、抑制血管生成,以及改变肿瘤侵袭调节基因的表达等[15]。然而,缺乏肿瘤特异性这一缺点限制了力达霉素的临床应用。中国医学科学院医药生物技术研究所甄永苏院士及其领导的科研团队在力达霉素-抗体偶联物的研发方面获得了重要的成果,他们先后研制了融合蛋白VL-LDP-AE(先制备抗Ⅳ型胶原酶单抗3G11的轻链可变区单域抗体VL与力达霉素辅基蛋白的基因重组融合蛋白VL-rLDP,然后与力达霉素发色团AE进行组装制得)[16]以及dFv-LDP-AE(先制备由抗明胶酶单链抗体Fv与力达霉素辅基蛋白组成的融合蛋白Fv-LDP,再将其与发色团AE进行组装制得)[17],研究证实上述融合蛋白具有较好的肿瘤靶向作用,其在肿瘤部位释放的力达霉素浓度显著升高,从而显示出更强的抗肿瘤活性。
2.3 设计烯二炔类抗生素的前药
近年来,有学者尝试将烯二炔类抗生素设计成前药,并通过物理方法使其选择性地在肿瘤部位发挥作用。例如,Polukhtine等[18]设计了2种具有烯二炔结构的前体化合物,其在黑暗条件下性质稳定,在紫外线或近红外光的照射下可转化为具有活性的烯二炔。课题组设想,可先将该类前体药物给予机体,然后以光照射肿瘤组织,促使肿瘤部位的药物发生Bergman 环化,生成自由基并损伤靶标DNA,从而使肿瘤的特异性治疗成为可能。研究人员发现,烯二炔类抗生素的产生菌可通过一系列机制逆转Bergman 环化反应,从而避免烯二炔损伤自身DNA[19],这一机制或可为烯二炔前药的设计提供参考;此外,烯二炔类抗生素的生物合成前体物质也具有开发为前药的潜力[3]。
3 结语
烯二炔类抗生素是迄今为止抗肿瘤活性最强的抗生素,但因毒性较大,难以应用于临床,上市新药屈指可数。一度备受关注和期待的Mylotarg也遭遇了撤市的结局,可见烯二炔类抗生素的新药研发之路坎坷而曲折。然而,其他药物难以与之匹敌的强效抗肿瘤活性使得烯二炔类抗生素自发现至今一直充满着吸引力,业界学者仍在继续探索这一领域。通过连接单抗分子或改造辅基蛋白提高烯二炔类抗生素的肿瘤靶向性,仍是该类抗生素今后的主流研究方向,甄永苏院士及其科研团队对力达霉素靶向药物展开了大量研究工作,为这一方向提供了极具参考价值的思路;烯二炔的光活性或酶活性前体药物也有一定开发前景,值得尝试。此外,目前也有一些科学家致力于烯二炔类抗生素的化学合成和组合生物合成研究。烯二炔类抗生素分子较大,其生物合成过程复杂、步骤繁多,对抗生素产生菌中生物合成基因簇及酶的认识,以及对生物合成途径的阐明有利于提高抗生素的产量,并使烯二炔类抗生素的结构改造变得简便易行[20]。
需强调的是,一些肿瘤细胞已对烯二炔类抗生素表现出抗药性,即通过一定的途径将药物转运至细胞外或阻止药物发挥作用,其中外排泵是最常见的一种抗药形式。图3以CMC-544为例,描述了烯二炔类抗生素在肿瘤细胞内的相关作用机制以及肿瘤细胞对其耐药的机制[21]。此外还有学者认为,肿瘤对烯二炔类抗生素的耐药性可能是一部分细胞通过牺牲自身蛋白的方式来抵消药物的生物活性,从而使剩余肿瘤细胞得以逃避药物的杀伤作用[22]。因此,进一步阐明烯二炔与肿瘤细胞的相互作用机制,有助于应对可能出现的耐药问题。
Research Status of Enediyne Antitumor Antibiotics and Their Targeted Drugs
YANG Zhenzheng1, XING Aimin1, ZHENG Xiaonan1, GU Juefen2
( 1. Editorial Offce of Progress in Pharmaceutical Sciences, China Pharmaceutical University, Nanjing 210009, China; 2. School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China)
Enediyne antibiotics are a class of novel antitumor antibiotics which have novel structures and special action mechanisms. Enediyne ring is the active center of these antibiotics. Despite the enediyne antibiotics show strong activity against many kinds of tumors, their high toxicity restricts the clinical applications. Recently, scientists have launched research and development of the targeted drugs of enediyne antibiotics, in order to improve their targeting effects and reduce the side effects. In this paper, the reported enediyne antibiotics and their active metabolites from natural sources have been summarized, and the research progress of their targeted drugs has been reviewed, so as to provide references for the further development of enediyne antibiotics.
enediyne antibiotics; molecular target; targeting drug delivery; monoclonal antibody; antitumor

R979.1
A
1001-5094(2014)10-0747-07
接受日期:2014-09-02
*通讯作者:郑晓南,编审;
研究方向:医药信息资源管理,文献计量学研究;
Tel:025-83271568; E-mail:xiaonanzheng@163.com
**通讯作者:顾觉奋,教授;
研究方向:微生物制药;
Tel:025-86200377; E-mail:yqyan1@126.com
