2013 年全球新药研发报告
——第一部分:新药及生物制品(Ⅰ)
2014-09-07GraulCrucesStringer
Graul A I,Cruces E,Stringer M
·全球药讯· GLOBAL PHARMACEUTICAL INFORMATION
2013 年全球新药研发报告
——第一部分:新药及生物制品(Ⅰ)
Graul A I,Cruces E,Stringer M

编者按:本刊于2013年分4期译载了汤森路透公司独家授权的“2012年全球新药研发报告”,该报告一经刊出,就因内容全面、资料权威、视角新颖、观点独到、数据翔实、时效性强广受好评。读者纷纷来函索要单行本,众多药企高层对该报告也高度关注。
鉴于此,本期“全球药讯”栏目开始推出“2013年全球新药研发报告”,分期连载。相信会为广大读者提供翔实、及时的行业资讯,为启迪研发思路,锁定研发管线助一臂之力!
该年度报告涉及2013年最新上市的56种新药及生物制品,包括20种新孤儿药和10种全新药物,以及获得美国FDA“新突破药物”称号的前3名药物。此外,该年度报告还讨论了30种重要的延伸性新药(新适应证、新剂型和现有药物的新复方),以及19种年内首次获批但在该报告结束时尚未上市的新药。
上市新药;新生物制品;获批新药;延伸性新药;孤儿药
2013年共有56种新药及生物制品上市,是近10年来上市数量最多的一年(见表1)。其中有10种全新药物(全新或独有作用机制的药物)。本年度还上市了30种重要的延伸性新药(新适应证、新剂型以及现有药物和生物制品的新复方)。
2013年度的新药及生物制品中最活跃类别当属抗癌药物,共有12个品种上市;其次是免疫制剂及代谢药物,分别有11个和7个(见表1)。
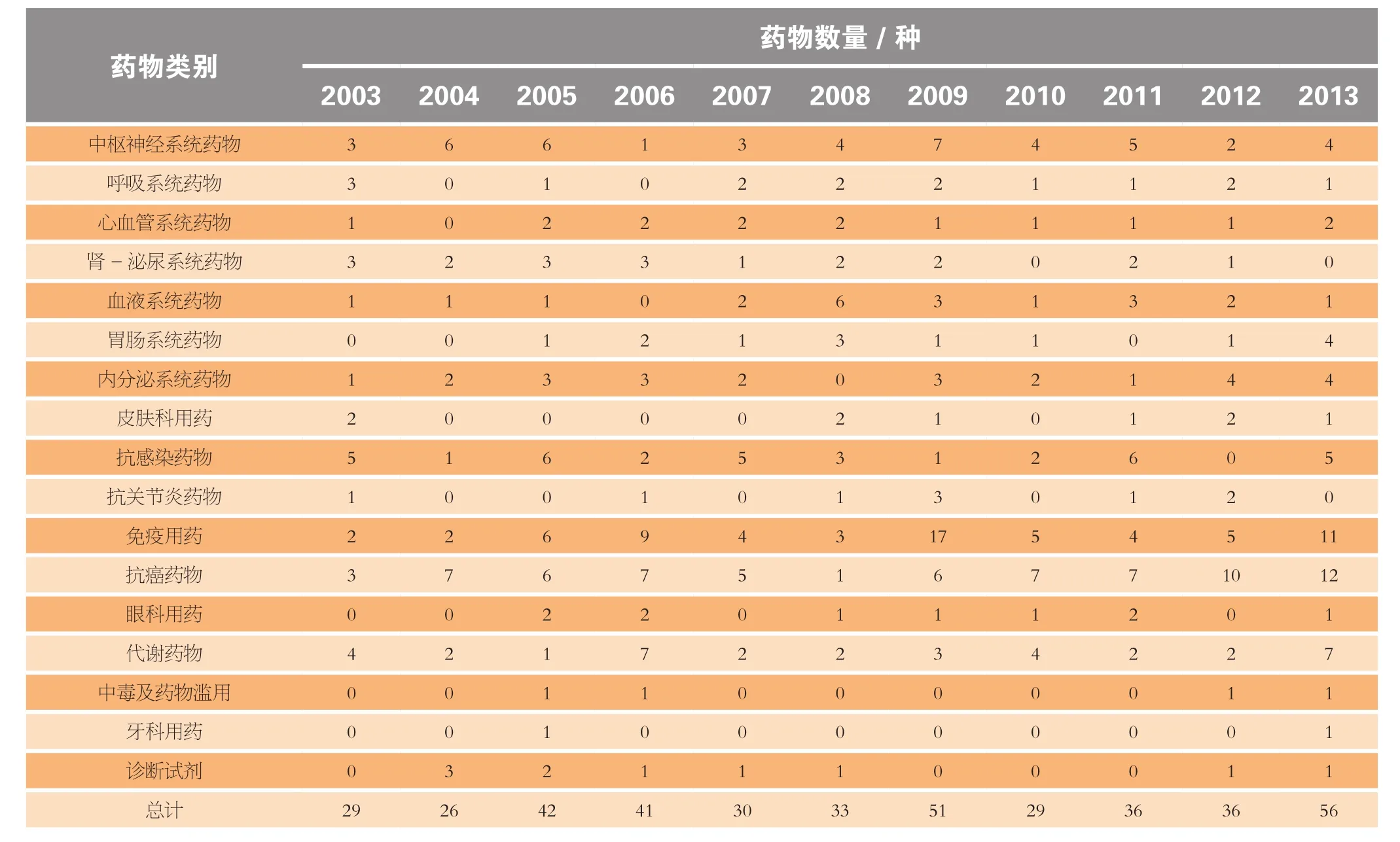
表1 2003-2013年上市新药及生物制品Table1 Drugs & biologics introductions by therapeutic category, 2003-2013
2013年度的新药及延伸性药物中有20种具备孤儿药身份,数量较前一年有大幅度增长,反映了近期药企在该领域的研发投资热情高涨。另一个激动人心的进展是获FDA“突破新药”称号的前3名药物都已获批。
如图1所示,美国仍然是最重要的新药市场:2013年全球上市的42个新药均在美国上市;日本上市5个,印度上市4个。
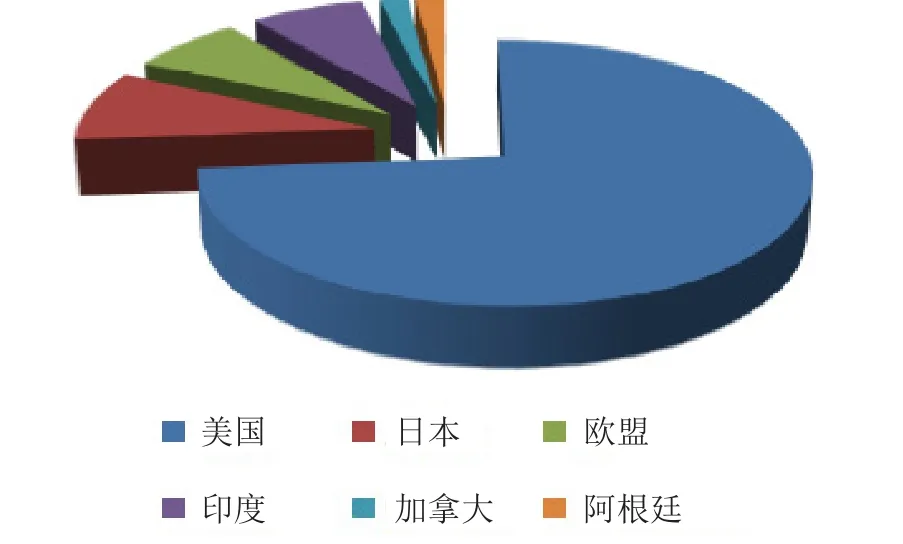
图1 2013年上市新药区域分布图Figure 1 Distribution of new launches in 2013 by country
除了大量已上市的新药,还有19个首次获批但在本报告结束时还未上市的新药,包括新药、新生物制剂及延伸性新药。
本文中及附表信息来源于与制药公司的信息交流、Thomson Reuters Drug News(汤森路透药物新闻)、Thomson Reuters IntegritySM及Thomson Reuters cortellis™数据库。
1 镇痛剂及麻醉剂
长效阿片类镇痛剂重酒石酸氢可酮(Zohydro™缓释制剂;Zogenix公司)于2013年首次在美国获批,用于需每日不间断地使用长效阿片类药物以及其他药物镇痛效果不理想的镇痛治疗。Zohydro是首个不含对乙酰氨基酚的氢可酮缓释制剂。过量使用对乙酰氨基酚是美国急性肝衰竭发病的首要原因,而63%的非故意过量使用对乙酰氨基酚都是由于氢可酮-对乙酰氨基酚复方制剂的使用,例如Vicodin®。Zohydro采用的是Alkermes公司的专利球形口服药物吸收系统(SODAS®)药物传递技术。该药将被美国禁毒署(DEA)定为Ⅱ类管制药物。Zogenix公司计划于2014年第1季度上市该药。
2013年3月,英国药品及保健品管理署(MHRA)批准了Horizon 制药公司的Duexis®(布洛芬/法莫替丁),用于对症治疗骨关节炎、类风湿性关节炎及强直性脊柱炎。该类疾病患者由于需每日3次、高剂量布洛芬的常规治疗,通常会患有非甾体抗炎药(NSAID)引起的胃及十二指肠溃疡。Horizon 制药公司正在英国及欧洲其他地区寻求Duexis的商业合作伙伴。Duexis是由非甾体抗炎药布洛芬及组胺H2受体拮抗剂法莫替丁组成的复方片剂,在美国用于缓解骨关节炎及类风湿性关节炎引发的症状,降低使用布洛芬治疗此类疾病患者上胃肠道溃疡的风险。该药在英国获批是全球首次将强直性脊柱炎包括在该药的适应证内。
NuPathe公司的 Zecuity™为离子渗透经皮给药系统,用于5-HT1B/1D 受体激动剂舒马普坦的给药。该药于2013年在美国获批用于治疗成人有先兆或无先兆偏头痛。Zecurity为一次性、电池驱动贴剂,在偏头痛发作时敷于上臂或大腿处。按下按钮后,Zecurity开始经皮给药,无需经过胃肠道。在整个4小时的给药过程中,内置微处理器会持续监控皮肤耐受状况,相应地调整给药,以确保6.5 mg舒马普坦给药过程的患者间差异最小。该药可以缓解偏头痛及偏头痛引起的恶心。NuPathe公司目前正寻求合作伙伴将Zecurity商业潜力最大化。Zecurity也将推迟上市直至确定其商业合作伙伴。
2 精神病用药
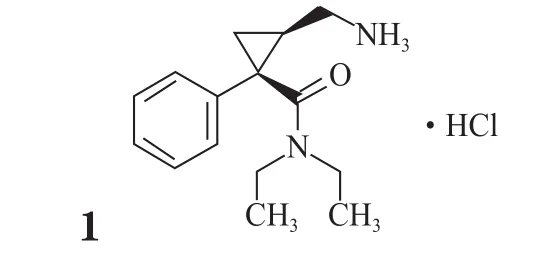
2013年6月,一种用于治疗重性抑郁症(MDD)的药物在美国获批:Pierre Fabre 及Forest公司的左旋米那普仑(1,Fetzima™)。该药为每日1次给药的5-羟色胺及去甲肾上腺素再摄取抑制剂(SNRI),是已上市抗抑郁药物米那普仑的活性异构体。该药的新药申请由3项双盲Ⅲ期临床研究支撑,包括两项固定剂量研究及一项可变剂量研究,将左旋米那普仑及安慰剂对成年重性抑郁症患者的作用进行比较。总计有超过1 600名成年患者参加研究,每日1次给药左旋米那普仑(40,80或120 mg)或安慰剂。在每项研究中,主要终点为Montgomery-Åsberg 抑郁症评分量表总分变化值(与基线值相比);次要终点为Sheehan 伤残量表总分变化值(与基线值相比)。在3项研究中,与安慰剂组相比,左旋米那普仑组在主要终点和次要终点都显示出统计学意义的显著改善。该药于2013年在美国首次上市。
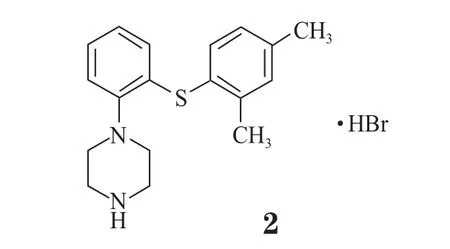
5-羟色胺能药物vortioxetine(2,Brintellix™;灵北/武田)于2013年9月在美国获得FDA批准,用于治疗MDD。Vortioxetine可抑制5-羟色胺再摄取,是5-HT1A受体激动剂,5-HT1B受体部分激动剂,以及5-HT3、5-HT1D及5-HT7受体拮抗剂。该药作用的多样性使其在几个系统中的神经传递产生调节作用,主要调节5-羟色胺,也调节去甲肾上腺素、多巴胺、组胺、乙酰胆碱、GABA及谷氨酸系统。每一个单独的作用机制尚未确定。Vortioxetine是首个具备此类多种药效活性的抗抑郁药物。同年10月,欧洲药品管理局(EMA)人用药物委员会采纳了一积极意见,建议欧洲批准vortioxetine上市治疗MDD。该药于2013年12月开始使用,尽管正式上市要到2014年1月。
2013年6月,Sunovion制药公司的盐酸鲁拉西酮的2个新适应证获得了FDA批准:用作单药治疗及与锂或丙戊酸钠联用治疗伴发双相Ⅰ型障碍的MDD成年患者。新适应证的获批是基于2项为期6周的双盲、随机、安慰剂对照的临床试验:PREVAIL2及PREVAIL1(分别为单药治疗和辅助治疗;临床试验编号分别为NCT00869699 和NCT00868452)。鲁拉西酮是一种非典型抗精神失常药,于2011年上市用于治疗精神分裂症。该药于2013年7月末上市用于新适应证。
Adasuve®是典型抗精神病药丁二酸洛沙平的新剂型产品,应用了Staccato®公司的吸入给药系统。在2013年2月份获得欧盟委员会的批准后,于7月在德国首次上市。该药在欧洲用于迅速控制精神分裂或双相障碍成人患者的轻度至中度激越症。上市许可要求患者的急性激越症状一旦得到控制需立即接受常规治疗,且该药给药必须在医院中进行并有医务人员监护。Adasuve曾于2012年在美国获批(如本报告2012年版所述),但未在该国上市。Alexza公司负责该药的生产及市场化运作,而Ferrer公司负责分销。丁二酸洛沙平是典型抗抑郁药,于1975年由屈臣氏制药公司以胶囊剂上市,治疗精神失常。
3 神经系统药物
2013年第1季度,百健艾迪公司的富马酸二甲酯(3,Tecfidera™)获得了FDA的批准,作为治疗复发型多发性硬化症(MS)。富马酸二甲酯为口服免疫调节剂和神经保护剂,通过激活Nrf2通路这种新途径治疗MS,尽管其确切作用机制尚未明确。Nrf2通路可以使机体细胞对抗MS引发的炎症及氧化反应(见图2)。临床证实富马酸二甲酯能显著降低重要病情活动度评价指标,包括脑损伤复发及病情发展,减缓伤残情况的发生,并显示出良好的安全性及耐受性。该药在获得批准后即上市。
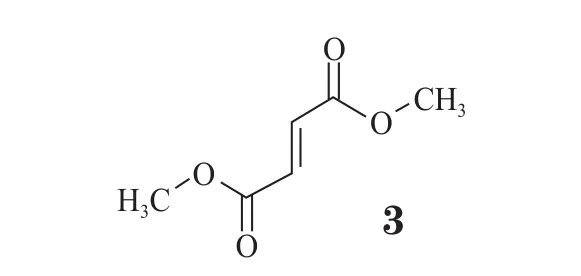
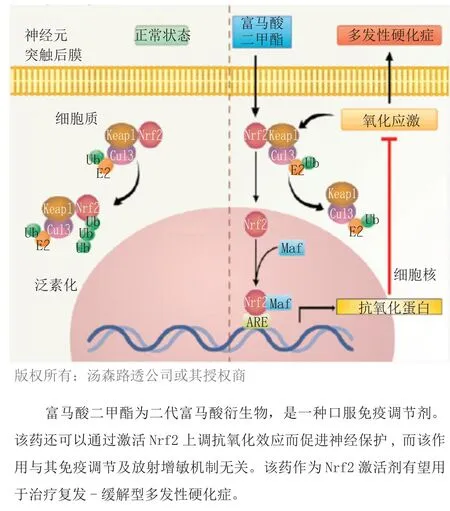
图2 Nrf2激活通路Figure 2 Nrf2 Activation
2013年9月,欧盟委员会批准了人源化抗CD-52单抗——阿伦单抗(lemtrada™;健赞公司),用于治疗经临床及影像确诊的活动期复发-缓解型MS。该药获批来自于CARE-MS I及CARE-MSII这两项临床研究的支撑。在这两项研究中,与β-1a干扰素相比,阿伦单抗能更有效地显著降低年复发率。这是阿伦单抗的新适应证,该药于2004年由拜耳医药上市,用于治疗慢性淋巴细胞白血病。健赞公司持有阿伦单抗全球研发权及经营权,对其治疗MS的研发及商业化运作负有首要责任。
伊曲茶碱(4,Nouiast®)是由日本协和发酵麒麟制药公司研发的全新抗帕金森病药物,2013年3月在日本首次获批。伊曲茶碱为选择性腺苷A2A受体拮抗剂,其作用机制明显不同于其他作用于多巴胺受体的抗帕金森病(PD)药物(见图3)。腺苷A2A受体位于基底神经节,该大脑区域负责动作控制,而PD患者的该区域功能衰退或出现异常。在日本进行的临床试验表明,伊曲茶碱可以改善剂末现象(即左旋多巴的疗效持续时间缩短),且经左旋多巴治疗的PD患者对该药耐受良好。该药被批准用于与其他含左旋多巴的药物联用改善剂末现象,于2013年5月在日本上市。
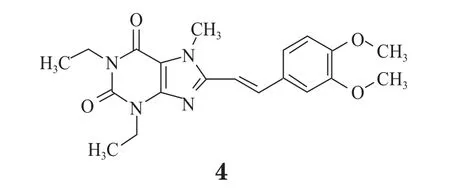
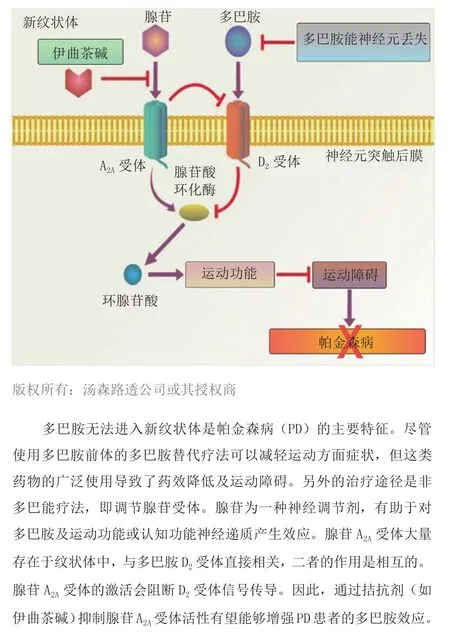
图3 腺苷A2A受体拮抗剂作用机制Figure 3 Adenosine A2Areceptor antagonism
三环类抗抑郁药盐酸氯米帕明(Anafranil®)自20世纪60年代就已上市,用于治疗焦虑症及抑郁症。该药在2013年首次在日本获批用于新适应证:治疗发作性睡病患者的猝倒症。这是首次管理机构官方批准氯米帕明该项用途,尽管长期以来氯米帕明一直被作为猝倒症患者的标签外使用药物。事实上,阿弗瑞萨公司提出该适应证的申请是也基于公共领域的证据:日本的发作性睡病的发病率全球最高,据发作性睡病网络数据是1:600。
4 呼吸系统药物
Breo™Ellipta™(葛兰素史克/Theravance公司)为固定剂量复方制剂,含有吸入性类皮质激素丙酸氟替卡松和维兰特罗2种成分,是长效β2-肾上腺素受体激动剂(LABA),于2013年首次在美国获批用于治疗慢性阻塞性肺病(COPD)。该药在美国用于COPD患者气流阻塞的长期维持治疗(每日1次),包括慢性支气管炎和(或)肺气肿。对于有急性加重病史的COPD患者,该药也用于减少急性加重的发作。该药获批基于下列研究发现:1项非临床研究项目、由1 406名患者参加的52项临床药理学研究及11项由7 851名COPD患者参加的临床研究。Breo™Ellipta™于2013年10月在美国首次上市,这是该药的首个COPD市场。同样的复方制剂也于2013年在日本获批,商品名为Relvar™Ellipta™,用于不同的呼吸系统适应证:需同时使用吸入性类皮质激素和长效β2-肾上腺素受体激动剂治疗的成人以及12岁及以上青少年支气管哮喘患者。该产品的研发采用了吸入产品的干燥粉末制剂技术,该技术由葛兰素史克公司从SkyePharma获得授权。2013年11月,Relvar™Ellipta™在欧盟获批用于2个适应证:哮喘和COPD。
另一种治疗COPD的新复方制剂Ultibro®(格隆溴铵/茚达特罗)也于2013年9月在欧盟和日本获批。Ultibro是一种全新的复方制剂,含有LABA茚达特罗及长效毒蕈碱拮抗剂(LAMA)格隆溴铵,剂型为吸入用胶囊,通过Breezhaler®装置使用。Ultibro的合作开发商诺华公司和Sosei公司宣称,该产品具备双重气管扩张机制,有望为COPD的治疗建立新标准。COPD是一种渐进性疾病,在整个欧洲成人发病率达10%,预计到2020年会成为第三大死亡原因。此外,日本目前也有530万COPD患者。该产品首次在德国和荷兰上市,之后不久即在日本上市。
盐酸奥达特罗(striverdi®Respimat®)是由勃林格殷格翰研制的一种新型LABA。2013年在多国获批,包括俄罗斯、加拿大、丹麦、冰岛和英国。该药起效迅速、作用持久,用于COPD患者气流阻塞的维持治疗,也用于慢性支气管炎及肺气肿的治疗,每日1次给药。
Lucinactant (surfaxin;Discovery laboratories)为人源化表面活性剂,于2013年11月在美国首次上市,用于预防早产儿呼吸窘迫综合征(RDS)。该药是FDA批准的首个含肽合成表面活性物质,是美国唯一可替代动物源表面活性物质的药物。
5 心血管药物
2013年,百时美施贵宝与辉瑞公司共同合作在全球市场推出凝血因子Xa抑制剂阿哌沙班(Eliquis®)的新适应证:预防脑卒中及非瓣膜性心房颤动患者全身性栓塞。该药用于新适应证于2013年1月在美国首次上市,之后不久即在英国和日本上市。阿哌沙班于2011年首次上市用于预防髋膝置换术后深静脉血栓栓塞症(VTE)。
2013年,日本患有轻度到中度的原发性高血压患者有了新选择:β1肾上腺受体拮抗剂比索洛尔的每日1次经皮给药的贴剂Bisono®Tape。该制剂是全球上市的首个β受体阻滞剂的贴剂剂型,由Toa Eiyao 和Nitto Denko合作研发,安斯泰来公司负责上市推广及分销。
日本盐野义制药公司的 Irtra®是固定剂量复方降压药,也在2013年获批并首次在日本上市。该制剂中含有血管紧张素AT1受体拮抗剂依贝沙坦和利尿剂三氯噻嗪2种成分。日本高血压治疗指南推荐联合使用肾素-血管紧张素阻滞剂与低剂量利尿剂,因为二者会产生协同降压作用且副作用也较小。
另一种含依贝沙坦固定剂量复方制剂是韩国韩美药品株式会社和赛诺菲公司共同研制的Robelito,2013年在韩国首次上市。该制剂含有依贝沙坦和阿洛伐他汀钙2种成分。Robelito适用于降低高血压及高血脂患者心脏病发病的风险,而这些患者正在使用这2种药物治疗。该复方制剂的使用简化了治疗方案。
内皮素ETA/ETB拮抗剂马西替坦(5,Opsumit®;Actelion)于2013年获批并在美国首次上市,用于治疗成人肺动脉高血压(PAH),延缓病情发展。该产品说明书附有提醒患者及医务工作者的黑框警告:孕妇禁用,原因是其对发育中的胎儿有害。马西替坦的药效通过关键的SERAPHIN研究(临床试验编号:NCT00660179)得以确认。该研究是一项由742名PAH患者参加的随机、对照研究,这些患者都表现出明显的WHO功能分级Ⅱ-Ⅲ级症状且平均治疗时间达到2年。2013年10月,EMA人用药委员会发出积极建议,推荐PAH患者使用马西替坦。
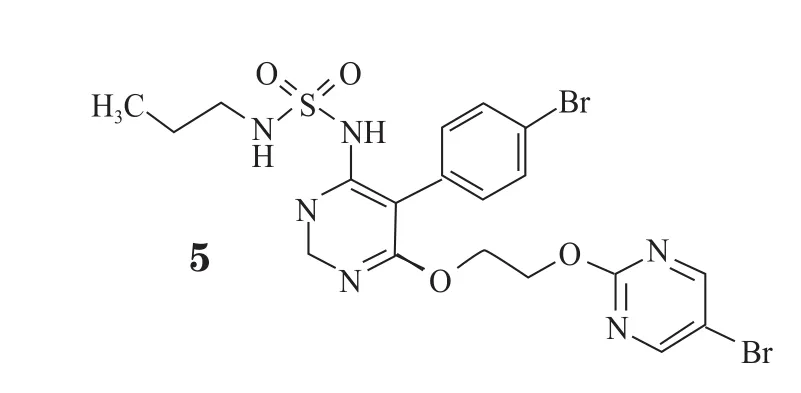
慢性栓塞性肺动脉高压(CTEPH)是一种渐进性、危及生命的肺动脉高压,肺血管的栓塞性阻塞会逐渐导致肺动脉血压升高,从而使右心室超负荷。2013年,全新可溶性鸟苷酸环化酶兴奋剂riociguat(6,Adempas®,拜耳制药)在加拿大获批上市,成为用于治疗该罕见病的首个获批药物(见图4)。在加拿大,CTEPH患者达数千人,而在riociguat上市前,尚无疗效确切的药物可用于不宜手术或持续性CTEPH的患者。
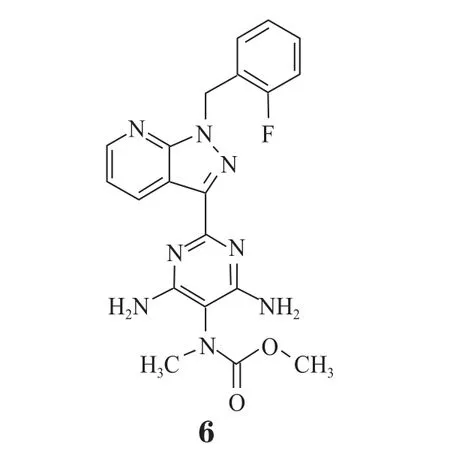
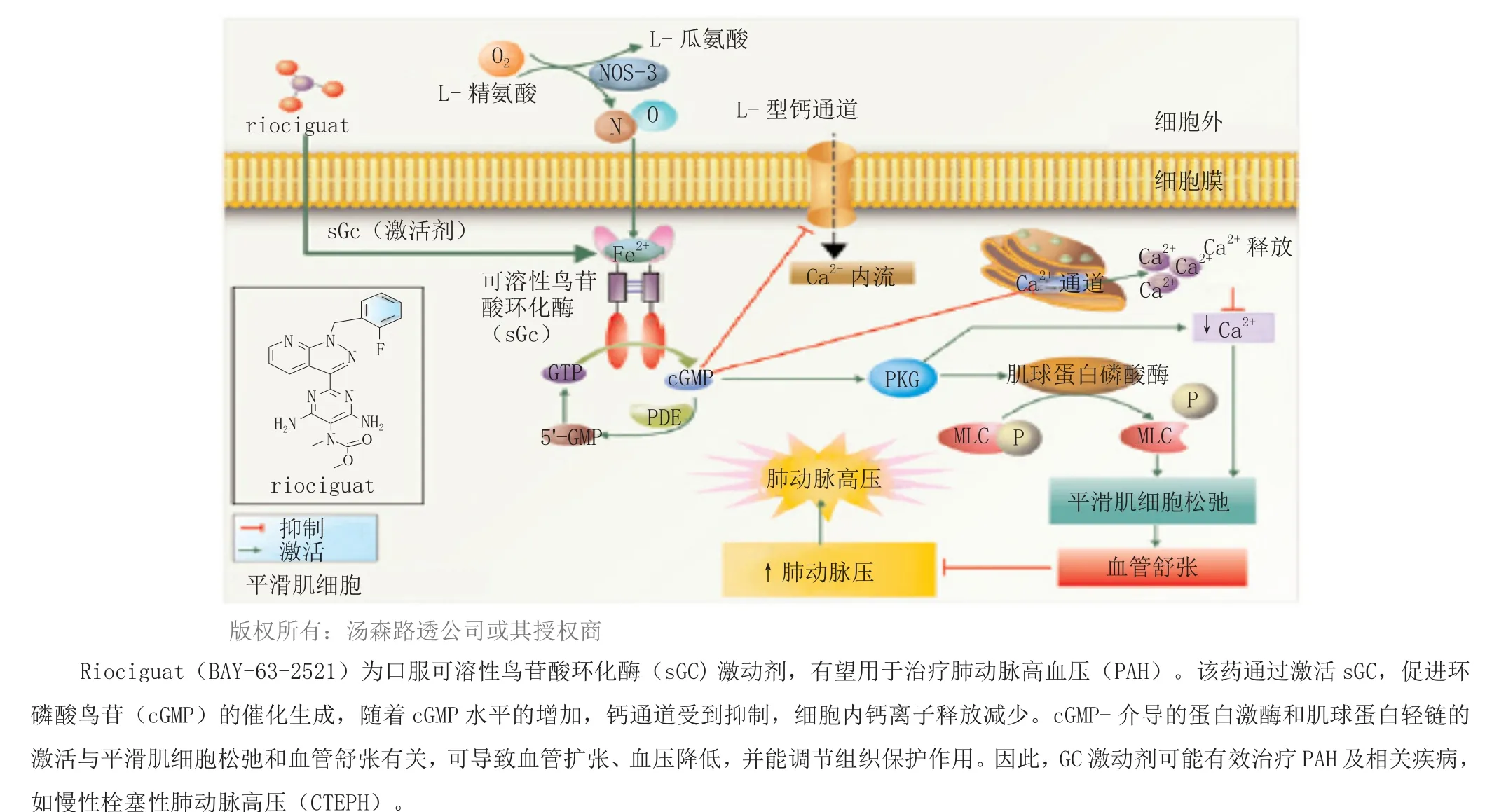
图4 可溶性鸟苷酸环化酶活化作用Figure 4 Soluble guanylate cyclase activation
6 肾-泌尿系统药物
Vesomni™是安斯泰来公司研发的固定剂量复方制剂,含有α1-肾上腺受体拮抗剂盐酸坦索罗辛和抗毒蕈碱药物琥珀酸索非那新2种成分。2013年5月在荷兰首次获批,9月在该国上市。Vesomni用于缓解中度至重度储尿障碍症状(尿急、尿频)以及单药治疗效果不佳的男性良性前列腺增生患者的排尿症状。荷兰是该产品继续在欧洲其他国家注册的参考会员国。
2013年11月,Plethora Solutions Holdings收到了欧盟委员会关于丙胺卡因/利多卡因Plethora(PSD-502)的上市许可。该产品为含有2种局部麻醉剂的喷剂,用于局部给药,治疗原发性早泄,能显著延长阴道内射精潜伏时间,提高性生活满意度。该疗效通过2项关键双盲、安慰剂对照的Ⅲ期临床研究得到证实,超过2.3万例受试者使用感觉良好。预计将于2014年向FDA提交申请,不久即会在欧洲上市。
2013年12月,美国FDA批准了首个治疗佩罗尼病的药物:溶组织梭菌胶原蛋白酶(Xiaflex®; Auxilium),用于成年佩罗尼病患者。这些患者在治疗开始即有明显斑块和至少30度的阴茎弯曲变形。该药的有效性和安全性的评估通过在佩罗尼病患者中进行的随机、双盲、安慰剂对照的Ⅲ期IMPRESSI、II研究完成:男性患者随机接受Xiaflex或安慰剂病损内注射、长达4个周期(中间有6周间隔)的治疗,结果显示,Xiaflex治疗组的男性患者阴茎弯曲改善平均达34%,而安慰剂组为18.2%;与安慰剂组相比,Xiaflex治疗组患者的症状评分也显著提高(分别为-2.8±3.8和-1.8±3.5)。Xiaflex在2010年就已上市,用于治疗掌腱膜挛缩症。Auxilium公司已立即开展该药新适应证的商业化运作。
对肾功能衰退患者而言,磷无法完全通过肾脏从尿液中排出,因此会蓄积在体内导致高磷血症。长期的高磷血症会引起继发性甲状旁腺功能亢进,甚至是肾源性骨病,表现为骨痛及易骨折。此外,磷和钙结合会形成磷酸钙,造成血管壁、心脏、肺和其他内脏器官及关节周围的钙沉着,而钙沉着意味着心血管疾病的风险增加。因此,肾病患者的血磷水平控制至关重要。随着2013年2种专门用途药物获批,该目标可以轻松实现。
三菱田边制药公司的考来替兰colestilan是一种非吸收的阴离子交换树脂及磷酸盐结合剂,2013年2月获得欧盟委员会批准,4月在德国和奥地利首次上市,用于治疗接受血液透析或腹膜透析的5级慢性肾病(CKD)成年患者的高磷血症。这是考来替兰的新适应证。该药曾于1999年在日本上市用于治疗高胆固醇血症。
另一个含铁的磷酸盐结合剂是sucroferric oxyhydroxide (Velphoro®;Vifor Pharma),于2013年11月获得FDA批准,用于控制CKD透析患者的血磷水平。该批准基于一项关键的Ⅲ期临床研究,该研究达到主要及次要终点。该临床研究还证实,与目前的标准治疗药物碳酸司维拉姆相比,较少剂量的Velphoro即可控制高磷血症(平均3.3粒/天)。Velphoro将由费森尤斯公司于2014年在美国上市。该药在欧洲、瑞士及新加坡正在进行评审,有望在2014年上半年公布评审结果。
(待续)
原文来源:Drugs of Tody,2014,50(1):51-100
翻 译:中国药科大学 张宇辉
A Report of New Drugs Research and Development in 2013——Part I:New Drugs & Biologics (I)
Graul A I,Cruces E,Stringer M
This article provides a comprehensive overview of the 56 new drugs and biologics introduced for the frst time in 2013, the largest number in at least a decade. This includes 20 new orphan drugs and 10 frst-in-class agents, as well as the frst three products bearing the FDA’s new Breakthrough Therapy Designation. The review also covers 30 important new line extensions, encompassing new indications, new formulations and new combinations of previously marketed agents. In addition to this bumper crop of new launches, another 19 products were approved for the frst time during the year but not yet launched by the close of this article; these new products are also discussed.
new drug launches;new biologics;new approvals; line extensions;orphan drugs

R97
A
1001-5094(2014)03-0224-07
