国际抗糖尿病药物研发新进展
2014-09-07杜海洲
杜海洲
(解放军医学图书馆,北京 100039)
国际抗糖尿病药物研发新进展
杜海洲*
(解放军医学图书馆,北京 100039)
根据美国药物研究与生产商协会( PhRMA)发布的相关报告和新药数据库中的数据,对2013年至今进入Ⅲ期临床试验或递交新药申请(NDA)/生物制剂许可申请(BLA)的用于治疗糖尿病及其相关疾病的65种候选新药的临床研发情况进行综述。将这些候选新药分为非胰岛素类、胰岛素类和复方制剂类抗糖尿病药,并重点对递交NDA/BLA或已获得批准的抗糖尿病新药开发进行了分析和讨论。
抗糖尿病药;胰岛素;非胰岛素类抗糖尿病药;复方制剂;新药
糖尿病(diabetes mellitus,DM)是一种由于胰岛素分泌缺陷和(或)胰岛素作用障碍所致以高血糖为特征的代谢性疾病。据国际糖尿病联盟(IDF)估计,2013年全世界有3.82亿人患糖尿病,并有3.16亿葡萄糖耐量受损(IGT)的人处于患糖尿病的高风险[1]。由于全球肥胖人群扩大,糖尿病的发病率呈上升趋势,如不进行干预,到2035年其患者人数可能会增加到4.71亿。自1921年加拿大Banting等人发现胰岛素并成功用于临床以来,糖尿病得到了很好的治疗和控制,并且已有40多种抗糖尿病药获得批准用于治疗糖尿病,但目前1、2型糖尿病尚不能完全治愈[2],糖尿病患者对安全有效的糖尿病治疗药物的需求仍得不到充分满足,这极大地促进了抗糖尿病新药的研发,开发作用于新靶点、可避免传统抗糖尿病药物副作用的2型糖尿病治疗新药已成为国内外研究开发的热点。据对美国药物研究与生产商协会(PhRMA)发布的报告[3-4]及相关新药数据库的数据统计,2013年至今进入Ⅲ期临床试验或已递交新药申请(NDA)/生物制剂许可申请(BLA)的用于治疗糖尿病及其相关疾病的药物有65种。本文将这些候选新药分为非胰岛素类、胰岛素类和复方制剂类3种类型进行分析和综述。
1 非胰岛素类抗糖尿病药物
非胰岛素类抗糖尿病药(也称口服抗糖尿病药)主要作为经调节饮食和锻炼难以控制血糖的患者的一线用药,可分为标准用药和添加(add-on)用药两类[5]。标准用药主要包括双胍类 (如二甲双胍)、磺脲类(如格列吡嗪、格列本脲等)和α葡萄糖苷酶抑制剂 (如阿卡波糖、伏格列波糖等)。在美国和世界多数国家和地区,二甲双胍是治疗糖尿病的一线金标准用药。添加用药包括较新的药物类型,主要用于单用一线标准用药不能有效控制血糖的情况下与标准用药合用,也可用于对标准用药禁忌或不能耐受的患者作为一线用药或单独用药,其主要类型有美格列脲类(meglitinides)、格列酮类(glitazones)以及胰高血糖素样肽-1(GLP-1)受体激动剂、二肽酶-4(DPP-4)抑制剂和最新的钠-葡萄糖协同转运蛋白-2(SGLT-2) 抑制剂等肠促胰素类药。2013年至今进入Ⅲ期临床试验或递交NDA/ BLA的非胰岛素类抗糖尿病新药主要为 DPP-4抑制剂(7种)、GLP-1受体激动剂(9种)、SGLT-2抑制剂(7种)和单抗、疫苗等其他类型(5类7种)以及治疗糖尿病相关疾病的内皮素受体拮抗剂、细胞疗法等(10类11种)(见表1)。限于篇幅,本文不对糖尿病相关疾病治疗药物进行分析和讨论,仅在表1中列出供参考。
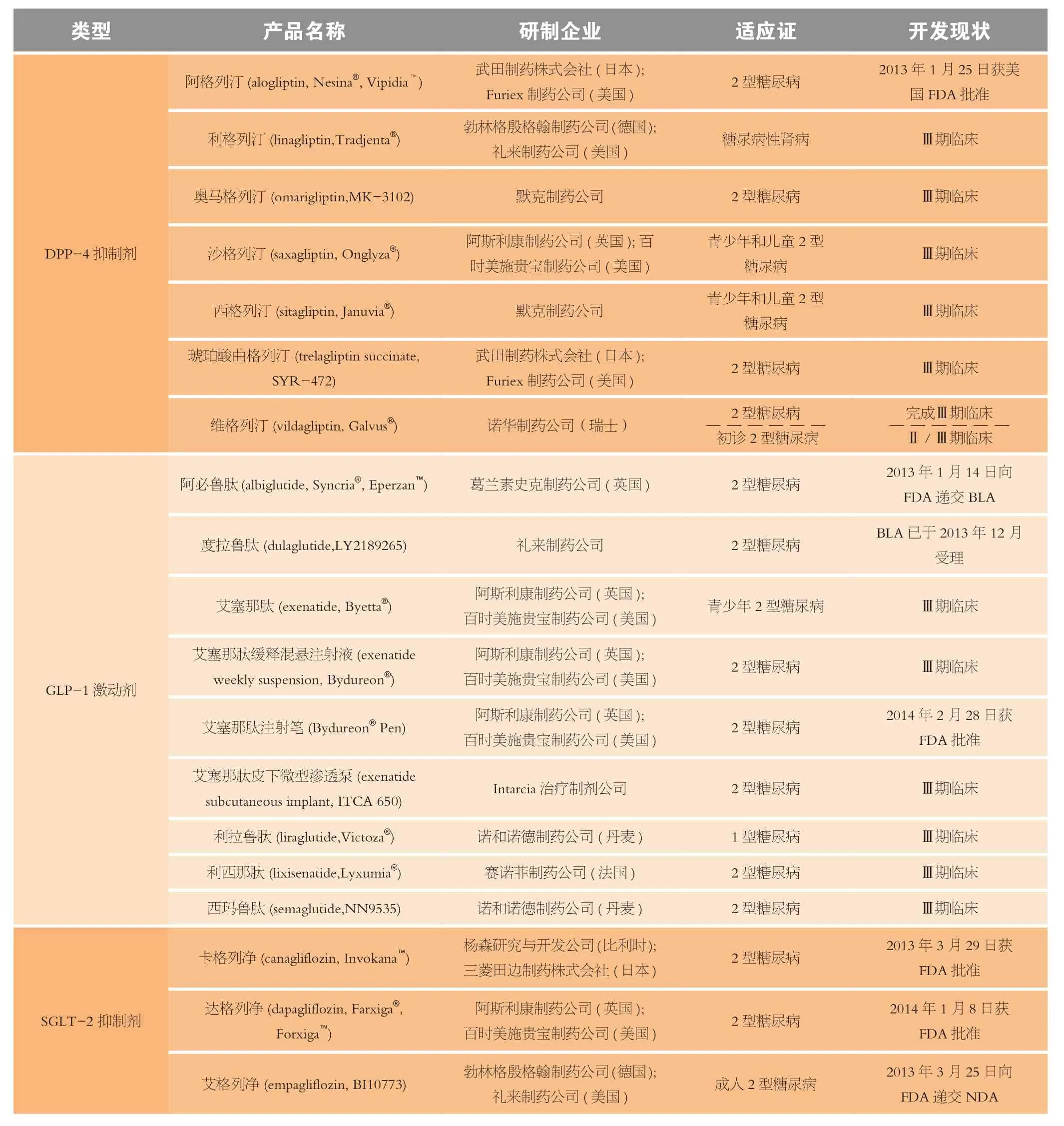
表1 进入Ⅲ期临床试验和递交NDA(BLA或sNDA)的抗糖尿病及其相关疾病的非胰岛素类药物Table 1 The non-insulin medicines for diabetes and their related diseases in Ⅲ phase clinical trials or their New Drug Application (NDA) or Biological License Application (BLA) submitted from 2013 to the present
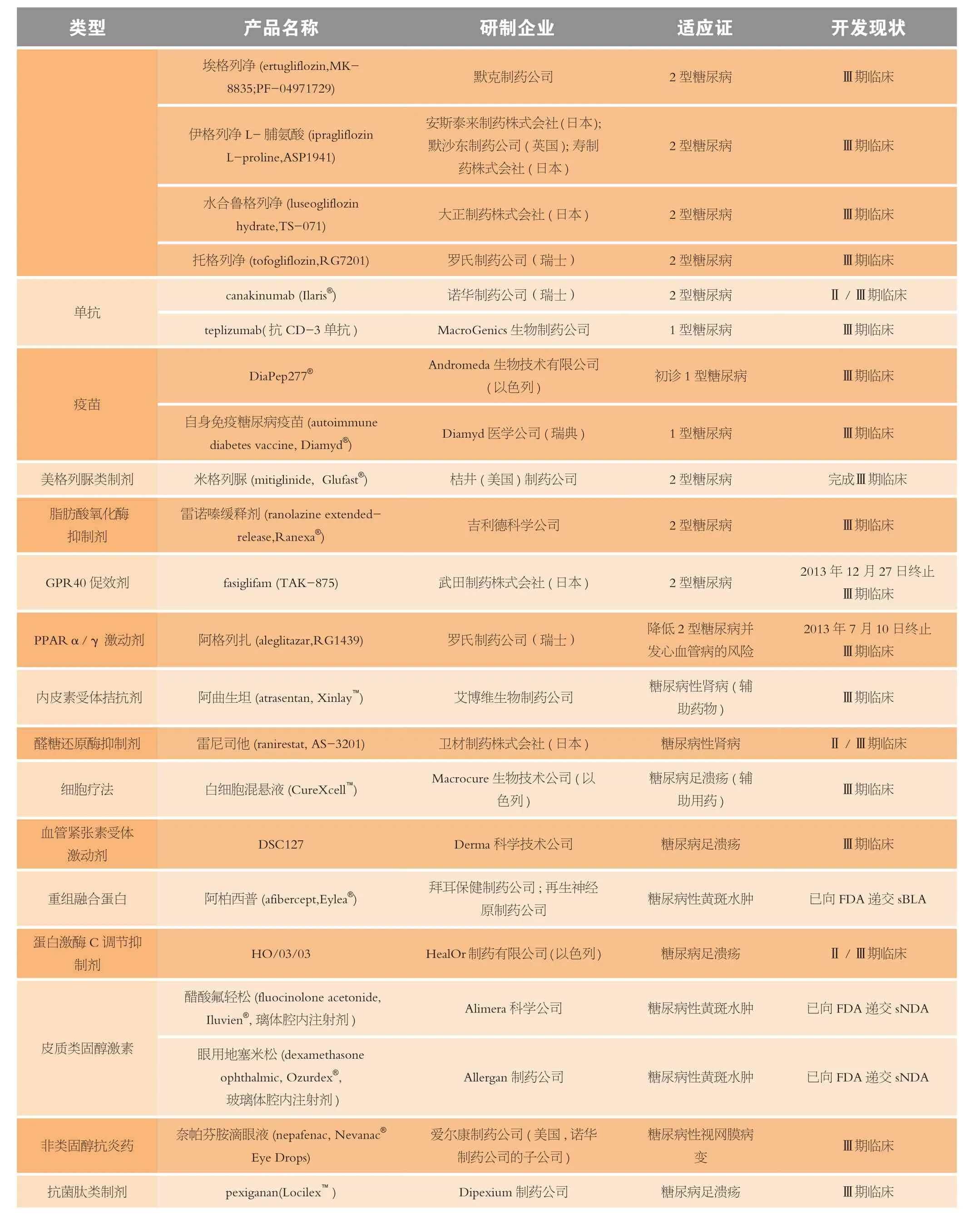
续表1
1.1 二肽基肽酶-4抑制剂
DPP-4又称腺苷脱氨酶复合蛋白2或簇分化抗原26(CD26),是一种以二聚体形式存在的高特异性丝氨酸蛋白酶,在人体中由DPP-4基因编码[6],能降解肠促胰素、GLP-1和葡萄糖依赖性促胰岛素分泌多肽(GIP)[7]。DPP-4抑制剂通过阻滞破坏肠促胰素的DPP-4酶而发挥作用,可稳定控制血糖,改善β细胞功能,且不会增加体质量,并可避免低血糖风险,在用药安全性方面有显著优势。在2013年进入Ⅲ期临床试验或已递交NDA/BLA的用于治疗糖尿病的6种DPP-4抑制剂(见表1)中,除了日本武田制药株式会社(Takeda Pharmaceutical Company Limited )开发的阿格列汀(Nesina®)于2013年1月25日获得美国FDA批准外,瑞士诺华制药公司(Novartis AG)开发的维格列汀(Galvus®)有望在近1~2年获得批准上市。
1.1.1 阿格列汀 阿格列汀(alogliptin, Nesina®,Vipidia™)分别于2013年1月25日和9月19日获得美国FDA和欧洲药品审评局(EMA)的批准,用于治疗用其他降血糖药难以控制血糖的2型糖尿病患者(每日1次)。中国食品药品监督管理局(CFDA)于2013年7月16日颁发了该制剂的进口药品注册证(IDL)。
阿格列汀作为一种DPP-4抑制剂,通过选择性抑制DPP-4而减少GLP-1在体内的失活,增加体内GLP-1水平,从而降低血糖[8]。武田制药株式会社于2007年12月和2008年9月分别向日本厚生劳动省(MHLW)和美国FDA递交了阿格列汀用于治疗2型糖尿病的新药申请。2009年6月,武田制药株式会社根据FDA要求对阿格列汀进行有关心血管风险评价的通知,撤回该药的NDA,但MHLW于2010年4月批准阿格列汀上市。然而,FDA于2012年4月25日再次要求武田制药株式会社补充阿格列汀的相关试验数据的完整回复函(CRL)。该公司于同年7月27日再次向FDA递交了包括有关阿格列汀进行3项Ⅲ期临床试验新数据的NDA和阿格列汀加盐酸二甲双胍复方制剂与阿格列汀加盐酸吡格列酮复方制剂用于治疗2型糖尿病的NDA。在用阿格列汀对5 380名伴发急性冠脉综合征(ACS)的2型糖尿病患者进行的Ⅲ期临床试验中,阿格列汀组患者的重要心血管事件发生率与安慰剂组相似(11.3% vs 11.8%)。临床研究证明,阿格列汀是首个也是唯一一个不会增加伴发ACS的2型糖尿病患者心血管风险的DPP-4抑制剂[9]。
1.1.2 维格列汀 维格列汀(vildagliptin, Galvus®)是口服特异性DPP-4抑制剂,主要用于治疗2型糖尿病(每日1次)。维格列汀通过抑制DPP-4对GLP-1和GIP的灭活,促进GLP-1和GIP增强β细胞分泌胰岛素的作用,并抑制朗格汉斯(Langerhans)岛α细胞释放胰高血糖素。欧洲EMA于2007年9月26日批准该药口服制剂的上市授权申请(MAA),而CFDA于2011年8月15日颁发了该制剂的IDL,商品名为“佳维乐”。截至2013年10月,维格列汀已在全球110多个国家和地区获得批准[10],但迄今美国FDA未批准该制剂。诺华制药公司早在2006年1月就向FDA递交了维格列汀用于治疗2型糖尿病的NDA,2007年2月,FDA要求该公司对维格列汀用于肾损伤的2型糖尿病患者进行安全性和有效性评价;同年12月,诺华制药公司根据FDA的要求提交了相关数据,但这些数据显示服用大剂量维格列汀的患者频繁出现肝酶水平升高,因此推迟了该项NDA的评审。目前诺华制药公司在美国对维格列汀用于2型糖尿病患者进行安全性和有效性评价的Ⅲ期临床试验已完成,并仍在与FDA 商讨维格列汀的未来,但是如果审批要求过于严格,该公司有可能放弃在美国审批的努力。
1.2 胰高血糖素样肽-1受体激动剂
GLP-1是在食物摄入后肠L细胞分泌的由30个氨基酸组成的多肽,并通过GLP-1受体产生数种作用,如刺激葡萄糖依赖性胰岛素的分泌、抑制餐后胰高血糖素的分泌、减缓胃排空并抑制食物摄入量等[11]。因此,GLP-1具有独特的降糖作用,能够根据体内葡萄糖水平高低,按需促进胰岛β细胞分泌胰岛素,抑制胰岛素拮抗激素胰高血糖素的分泌,从而发挥降糖作用[7]。然而,人体产生的GLP-1的半衰期仅有几分钟,且很不稳定,很快会被体内的丝氨酸DPP-4降解,故若使用天然GLP-1降低血糖,则需持续静注或皮下注射。因此需要对天然GLP-1进行结构改造,以获得长效GLP-1受体激动剂。在2013年进入Ⅲ期临床试验或递交了BLA(NDA)的GLP-1受体激动剂中,以下3种有望在近1~2年获准上市。
1.2.1 阿必鲁肽 阿必鲁肽(albiglutide,Syncria®,Eperzan™)是由英国葛兰素史克制药公司(GlaxoSmithKline Inc.,GSK)收购的美国人类基因组科学公司(Human Genome Sciences, Inc.)开发的用于治疗2型糖尿病的GLP-1受体激动剂(GLP1-RA)。该药制剂为预装注射笔的粉剂和溶液,规格分30 mg 和50 mg 2种,每周注射1次。该药与利拉鲁肽(丹麦诺和诺德制药公司产品)和艾塞那肽注射液[(Byetta®,1日2次;Bydureon®,1周1次),百时美施贵宝制药公司与阿斯利康制药公司合作上市产品]一样,是融合人白蛋白的耐DPP-4的 GLP-1二聚体,其半衰期为4~7 d,比艾塞那肽和利拉鲁肽的半衰期明显延长。葛兰素史克制药公司于2013年1月14日向FDA递交了BLA,并于3月7日向EMA递交了MAA,但葛兰素史克制药公司于8月2日宣布,根据FDA的要求,需要更长的时间对该公司提交有关阿必鲁肽NDA的材料进行审评,因此,FDA批准阿必鲁肽NDA的最后期限延长到2014年4月15日,而EMA于2014年3月26日批准阿必鲁肽为成人2型糖尿病治疗用药(每周1次)。
1.2.2 度拉鲁肽 度拉鲁肽(dulaglutide,LY2189265)是由美国礼来制药公司(Eli Lilly and Company)开发的用于治疗2型糖尿病的新型注射用长效GLP1-RA(每周1次),其含有与人IgG4的Fc片段共价连接的具有氨基酸替代物的GLP-1(7-37),帮助刺激胰岛素的产生,从而保护GLP-1 部分免遭DPP-4引起的水解[12]。礼来制药公司用剂量为1.5 mg的度拉鲁肽对糖尿病患者进行的3项Ⅲ期临床试验结果表明,与常用的艾塞那肽、西格列汀和二甲双胍相比,该药在控制血糖水平和减轻体质量等方面都具有优势,且不会引发严重的低血糖症状[13]。欧洲EMA和美国FDA分别于2013年7月和12月受理了礼来制药公司递交的度拉鲁肽的MAA和NDA,这些申请有望于2014年底或2015年初获得批准。一旦获得批准,度拉鲁肽将是包括利拉鲁肽等所有GLP-1受体激动剂的强有力竞争对手。据预测,其上市后每年的销售额可达5~9亿美元,到2020年的销售额可达17亿美元[14]。
1.2.3 利西那肽 利西那肽(lixisenatide, Lyxumia®)是由丹麦西兰制药公司(Zealand Pharma A/S)与法国赛诺菲制药公司(Sanofi S.A)合作开发的新型注射用GLP1-RA(每日1次),是基于具降糖活性的GLP-1类似物Exendin-4(1-39)C末端6个赖氨酸残基的修饰而合成的新型GLP-1 类似物,能耐受DPP-4的降解作用[15]。利西那肽的MAA于2013年2月9日获得EMA许可,并先后在墨西哥、奥地利和日本等国获准上市,用于治疗成人2型糖尿病患者。但该公司于2013年9月12日宣布撤回向FDA递交的包括利西那肽用于并发ACS的2型糖尿病患者的Ⅲ期临床试验中期试验结果的NDA,并计划在完成该项Ⅲ期试验之后于2015年再次向FDA递交包括该项Ⅲ期临床试验完整数据的NDA。
1.2.4 艾塞那肽 艾塞那肽是由原美国Amylin制药公司(Amylin Pharmaceuticals,LLC.,2012年8月被百时美施贵宝制药公司收购)开发的于2005年获得FDA批准的用于治疗2型糖尿病的GLP-1类似物,其商品名为 Byetta®的制剂为注射剂,每日2次,可在早餐和晚餐前1 h内于腹部、大腿或上臂处皮下注射,而商品名为Bydureon®的制剂为每周注射1次的缓释剂,于2012年1月27日获得FDA的批准。百时美施贵宝制药公司利用其聚合物微球注射缓释技术与英国阿斯利康制药公司合作开发的艾塞那肽注射笔(Bydureon®Pen)为预灌封的一次性注射笔,于2014年2月28日获FDA批准,其剂型和剂量与原注射剂相同,注射时患者无需将注射液装入注射器,这为2型糖尿病患者带来更大的便利。
1.3 钠-葡萄糖协同转运蛋白-2抑制剂
SGLT-2位于近端肾小管 S1 段,负责肾的大部分葡萄糖重吸收(约占90%),而其余10%由近端肾小管远端S3 段的SGLT-1负责[16]。与治疗糖尿病的传统药物补充和诱导胰岛素分泌、改善胰岛素抵抗、促进葡萄糖利用等机制不同,SGLT-2抑制剂通过抑制近端肾小管的葡萄糖重吸收,使体内多余的葡萄糖从尿中排出,从而降低血糖,改善β细胞功能,同时能进一步改善肝脏胰岛素抵抗,促使较高的肝糖输出恢复正常。在2013年至今进入Ⅲ期临床试验、递交NDA或获得批准的用于治疗糖尿病的7种SGLT-2抑制剂(见表1)中,除卡格列净和达格列净分别于2013年3月29日和2014年1月8日获得FDA的批准外,艾格列净也有望在近1~2年内获得批准上市。
1.3.1 卡格列净 卡格列净(canagliflozin,Invokana™)最早是由日本三菱田边制药株式会社(Mitsubishi Tanabe Pharma Corp.)开发的一种口服选择性SGLT-2 抑制剂,之后该公司将卡格列净在除日本外的其他国家和地区的开发与上市权授予美国杨森制药公司(强生制药公司的子公司),其分别于2013 年3 月29日和11月22日获美国FDA和EMA的批准,用于治疗成人2 型糖尿病。该药的作用机制是通过抑制SGLT-2减少肾过滤葡萄糖的再吸收和降低尿液中肾糖阈值(RTG)来增加尿葡萄糖的排泄[17]。多项Ⅲ期临床试验结果显示,卡格列净可有效降低2型糖尿病患者的血糖、高密度脂蛋白胆固醇 (HDL-C)和三酰甘油酯水平,并降低体质量,且耐受性好,安全性较高[18]。
1.3.2 达格列净 达格列净(dapagliflozin,Farxiga®,Forxiga™)是英国阿利斯康制药公司与美国百时美施贵宝制药公司合作开发的一种用于治疗2型糖尿病的口服选择性可逆性SGLT-2抑制剂,其作用机制与胰岛素完全不同,可在肾脏选择性地抑制SGLT-2并清除尿液中多余的糖和热量,辅助降低血糖水平。该药于2012年11月14日获EMA批准,并在澳大利亚、巴西、墨西哥和新西兰等国上市,但这2家制药公司向美国FDA递交的NDA却于同年1月被驳回,原因是达格列净的Ⅲ期临床试验结果表明该药有增加患者罹患乳腺癌和膀胱癌的风险,因此FDA希望2家制药公司提供更多有关该药的临床试验数据[19]。这2家公司于2013年7月再次向FDA递交了达格列净的NDA,并提供了数项新临床试验数据和以前提交的研究中长达4年的数据,其中包括患者使用达格列净的时间可延长50%以上。达格列净于2014年1月8日获FDA批准,用于治疗成人2型糖尿病患者,成为继卡格列净之后第2个获FDA批准的SGLT-2抑制剂。该药制剂为片剂,规格分5 mg/片 和10 mg/片 ,每日1次,晨服。FDA在批准达格列净的同时还要求这2家公司在达格列净上市后必须进行6项临床评价,包括对有基础心血管病风险的患者进行心血管病的评价,进行膀胱癌风险的评价,对动物进行药物诱导尿流量和引起膀胱癌的评价,以及2项对儿童患者的评价等。
1.3.3 艾格列净 艾格列净(empagliflozin,BI10773)是美国礼来制药公司与德国勃林格殷格翰制药公司(Boehringer Ingelheim GmbH )合作开发的用于治疗2型糖尿病的SGLT-2抑制剂,其通过阻止肾过滤葡萄糖的再吸收而增加尿葡萄糖的排泄。多项试验结果表明,艾格列净在控制血糖、降低糖化血红蛋白(HbA1c)和空腹血糖(FPG)水平方面表现出很好的疗效,在降低血压和体质量方面也有一定的疗效,是一种很有潜力的降糖药物,并且安全性好,低血糖风险小[20]。这2家制药公司于2013年3月25日和3月26日先后向FDA和EMA递交了该药用于治疗成人2型糖尿病的NDA和MAA。但是,FDA于2014年3月5日就艾格列净的NDA向这2家公司发出了CRL,该CRL参考此前观察到勃林格殷格翰制药公司生产艾格列净的设备存在的缺陷[21],要求该公司在艾格列净的NDA批准之前解决这些问题,但重要的是并未要求其开展任何新的临床试验以支持该NDA的批准。礼来制药公司和勃林格殷格翰制药公司称将尽快对该CRL提交书面答复,并与FDA密切合作,使艾格列净尽早获批上市,造福2型糖尿病患者。
1.4 其他
2013年至今进入Ⅲ期临床试验或递交NDA和获得批准的非胰岛素抗糖尿病药物中,除上述3类制剂有较多的药物外,还有2种单抗、2种疫苗,而美格列脲类制剂、脂肪酸氧化酶抑制剂和GPR40促效剂各1种,共5类7种;以及PPAR α/γ激动剂、内皮素受体拮抗剂、醛糖还原酶抑制剂等10类11种为治疗糖尿病相关疾病的候选新药(见表1)。因这些非胰岛素抗糖尿病药种类较多,为便于分析,本文暂且将这5类7种候选药物列入“其他”类进行讨论。在这些药物中,除了瑞士罗氏制药公司开发的阿格列扎和日本武田制药株式会社开发的fasiglifam(TAK-875)因安全性问题在2013年先后终止临床试验外,开发前景较好的药物主要为DiaPep277®。
DiaPep277®是由以色列Andromeda生物技术有限公司(Andromeda Biotech Ltd.)开发的用于治疗1型糖尿病的合成肽疫苗,它是从人热休克蛋白60(Hsp 60)序列中分离出的含有24个氨基酸的合成肽。DiaPep277®通过减少或阻止胰岛β细胞的免疫破坏,调节导致自身免疫糖尿病的免疫反应,防止分泌胰岛素的胰腺细胞受到破坏,并保持其自然功能[22]。该公司对DiaPep277®用于457名16~45岁初诊1型糖尿病患者的为期2年的Ⅲ期临床试验已完成,并达到了试验的主要目标。经用C-肽水平测定,治疗组患者β细胞功能保持良好,疗效为23.4% (P=0.037),并且与安慰剂对照组相比,治疗组患者较好控制血糖代谢的比例明显提高,且较少出现低血糖事件[23]。目前,Andromeda生物技术有限公司还正在对DiaPep277®用于450名年龄在20~45岁之间、具有部分β细胞功能的初诊1型糖尿病患者进行一项名为DIA-AID2的Ⅲ期临床试验,旨在评价DiaPep277®的安全性和有效性,有望于2014年底完成,并计划于2015年上市本品。
2 胰岛素类抗糖尿病药物
胰岛素可用于治疗所有类型的糖尿病患者。人体对胰岛素的需要取决于胰岛素分泌和胰岛素抵抗之间的平衡。所有1型糖尿病患者除接受胰岛或整个胰腺器官移植外都需要长期使用胰岛素治疗,许多β细胞功能下降的2 型糖尿病患者也需要用胰岛素治疗。胰岛素类抗糖尿病药物根据其药动学性能划分为4种[24],即速效或餐时胰岛素、常规或短效胰岛素、预混或中效胰岛素和长效或基础胰岛素,每种都有其明确的适应证。2013年至今共有8种胰岛素类药物进行了9项Ⅲ期临床试验或递交了BLA(见表2)。其中除丹麦诺和诺德制药公司开发的德谷胰岛素(Tresiba®)于2013年2月1日递交的BLA被驳回外,美国MannKind生物制药公司开发的人胰岛素吸入剂(Afrezza®)和美国礼来制药公司与德国勃林格殷格翰制药公司合作开发的仿制甘精胰岛素(LY2963016)先后于2013年10月和12月向FDA递交了BLA,有望于2014年获得批准。另外,法国赛诺菲制药公司开发的新型甘精胰岛素U300已完成Ⅲ期临床试验,其开发前景看好。
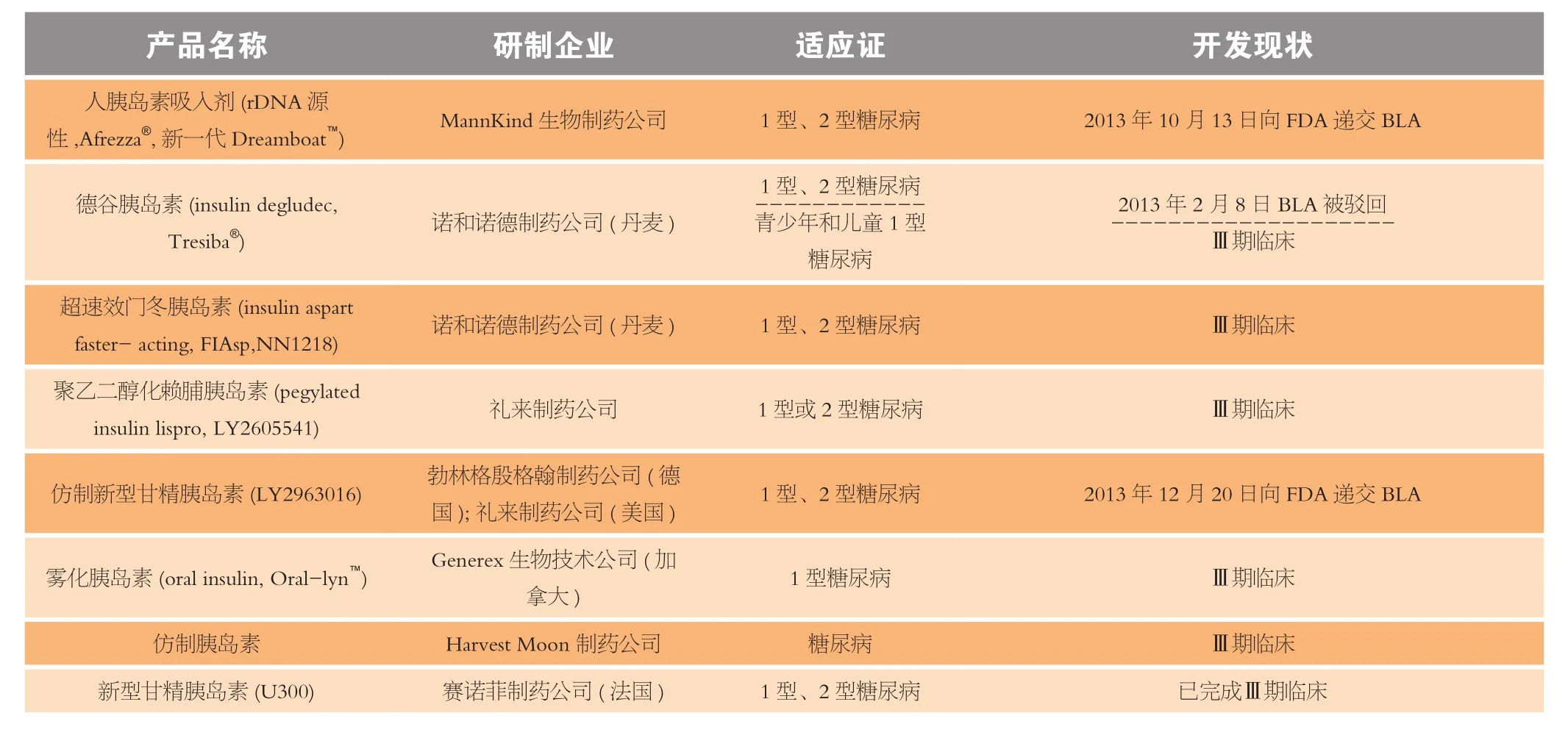
表2 进入Ⅲ期临床试验和已递交NDA(BLA或sNDA)的胰岛素类抗糖尿病药物Table 2 The insulin medicines for diabetes inⅢ phase clinical trials or their New Drug Application (NDA) or Biological License Application (BLA) submitted from 2013 to the present
2.1 重组人胰岛素吸入剂
重组人胰岛素吸入剂Afrezza®是由美国原Emisphere技术公司(Emisphere Technologies,Inc.)开发的一种新型rDNA源性超速效重组人胰岛素吸入剂,用于治疗成人1型和2型糖尿病,2008年2月,MannKind制药公司(MannKind Corporation)购买到Afrezza®的部分专利。Afrezza是一种采用TechnoSphere®技术平台开发的药械组合产品,即由可吸入重组胰岛素粉单剂量管和吸入装置组成,饭前用药。该制剂经患者吸入后到达肺部表面可立即溶解,释放胰岛素单体并迅速进入血液;其进入患者体内12~15 min后胰岛素水平即达到峰值,与健康人用餐后胰岛素的释放情况极为相似,而注射速效胰岛素类似物和常规人胰岛素后分别需45~90 min和90~150 min才能达到相同效果。Afrezza的Ⅱ期临床试验结果表明,与皮下注射胰岛素相比,该制剂可较好预防低血糖和餐后血糖升高,且无肺部不良反应[25]。MannKind 制药公司曾于2009年3 月向FDA 提交了本品的BLA,此后该公司先后于2010 年3 月和2011 年1月两次收到FDA 的CRL,要求其提供有关Afrezza的更详细数据。MannKind 制药公司于2011年6月公布的临床试验数据显示,接受该药吸入治疗的糖尿病患者并未增加心脏病发病风险。该公司此后又先后于2011年和2013年8月向FDA递交了有关该药的关键性临床试验设计和Ⅲ期临床试验的有效数据,并于2013年10月14日再次向FDA递交了BLA,FDA所属的内分泌与代谢药物咨询委员会(EMDA)2014年4月1日投票以13:1和14:0的支持率建议FDA批准Afrezza分别用于1型和2型糖尿病患者。Afrezza一旦获得批准,将是首个餐时用超速效胰岛素。
2.2 新型甘精胰岛素
甘精胰岛素(Lantus®)是由法国赛诺菲制药公司于2000年在美国上市的重磅级皮下注射长效(基础)胰岛素类抗糖尿病药,每日1次,用于1型和2型糖尿病患者的血糖控制。U300则是法国赛诺菲制药公司基于甘精胰岛素中生物实体甘精开发的新型胰岛素。Ⅲ期临床试验结果表明,与甘精胰岛素相比,U300控制血糖的作用与其相当,但控制血糖的作用更平缓且持续时间更长,可使夜间发作低血糖的患者比例减少23%,且皮下注射的剂量也更小[26]。赛诺菲制药公司最近完成有关U300的4项Ⅲ期临床试验均达到了试验的主要目标。该公司预计于2014年上半年分别向FDA和EMA递交BLA,一旦获得批准,U300将是赛诺菲制药公司在抗糖尿病药物市场保持其领导地位的关键产品,是治疗1型和2型糖尿病的可选择药物,预计到2018年其销售额可达10亿美元。
2.3 仿制甘精胰岛素
甘精胰岛素是全球最畅销的基础胰岛素和最畅销的抗糖尿病药,其2012年全球销售额为50亿欧元,在欧洲和美国的专利保护期分别在2014年和2015年期满,因此它已成为生物制药公司仿制胰岛素竞争产品的主要目标[27]。美国礼来制药公司与德国勃林格殷格翰制药公司合作开发的用于治疗1型和2型糖尿病的仿制甘精胰岛素LY2963016便是其中之一,这2家公司分别于2013年7月8日和12月20日宣布向EMA和FDA递交了该产品用于治疗1型和2型糖尿病的MAA和BLA。在递交的BLA中,除了包括与目前市售甘精胰岛素进行药动学和药效学比较的数据外,还包括在1型和2型糖尿病患者中进行的比较仿制甘精胰岛素与市售甘精胰岛素疗效的Ⅲ期临床试验结果。该制剂有望于2015年2月获得批准上市。
3 复方制剂类抗糖尿病药物
复方制剂是将2种或多种活性成分整合入同一制剂中,从而提高药物的顺应性,并帮助患者减少服药的负担[28]。随着疾病的进展,许多糖尿病患者单用1种降糖药难以控制其HbA1c水平,例如,HbA1c水平平均基线值在8.2%~8.4%的糖尿病患者单用二甲双胍治疗能够控制血糖水平的仅占25%。据英国前瞻性糖尿病研究(UKPDS)的结果显示,单用1种降糖药治疗3年的患者中50%需用复方制剂治疗,到9年时,需用复方制剂治疗的患者达75%。因此,复方制剂常用于单用1种降糖药不能控制血糖水平的患者[29]。在2013年至今进入Ⅲ期临床试验或递交NDA和获得批准的抗糖尿病药中,有16种为复方抗糖尿病制剂(见表3),包括9种DPP-4抑制剂与其他类型制剂合用的复方制剂、2种GLP-1激动剂与胰岛素合用的复方制剂,3种SGLT-2 抑制剂与双胍类制剂合用的复方制剂和1种胰岛素与胰岛素合用的复方制剂。其中除丹麦诺和诺德制药公司开发的德谷胰岛素加门冬胰岛素复方制剂和比利时杨森研究与开发公司(Janssen Research & Development, LLC)开发的卡格列净加二甲双胍复方制剂分别因“心血管安全性”问题和需补充用于支持2种制剂兼容性的数据于2013年2月8日和2013年12月12日遭FDA驳回其NDA外,苯甲酸阿格列汀加盐酸二甲双胍复方制剂(Kazano®)和苯甲酸阿格列汀加盐酸吡格列酮复方制剂(Oseni®)于2013年1月25日获得FDA批准,英国阿斯利康制药公司与美国百时美施贵宝制药公司合作开发的达格列净加二甲双胍复方制剂(Xigduo™)也有望在近1~2年获得批准上市。
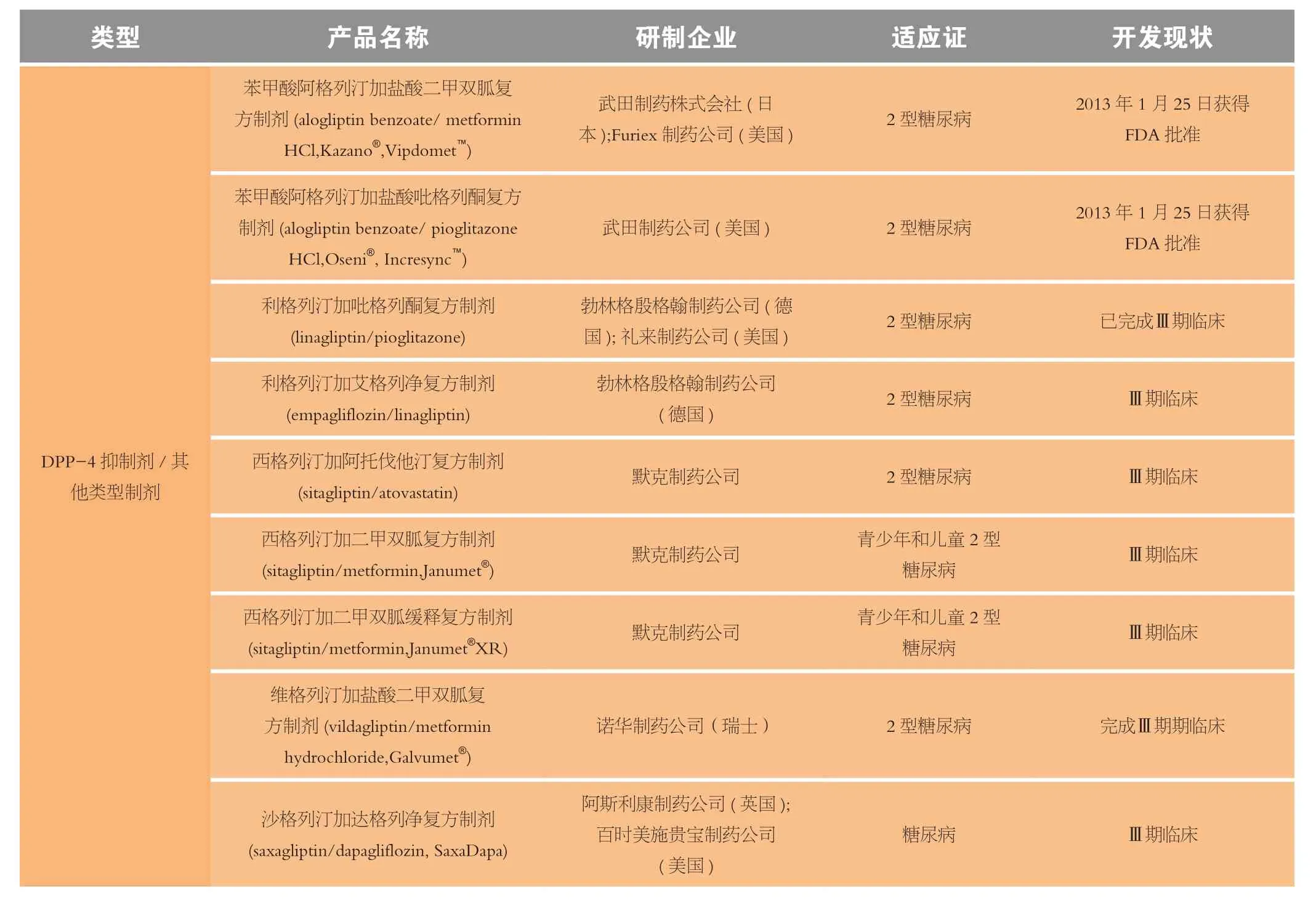
表3 进入Ⅲ期临床试验和已递交NDA(BLA或sNDA)治疗糖尿病的复方制剂Table 3 The fixed-dose combinations for diabetes in Ⅲ phase clinical trials or their New Drug Application (NDA) or Biological License Application (BLA) submitted from 2013 to the present
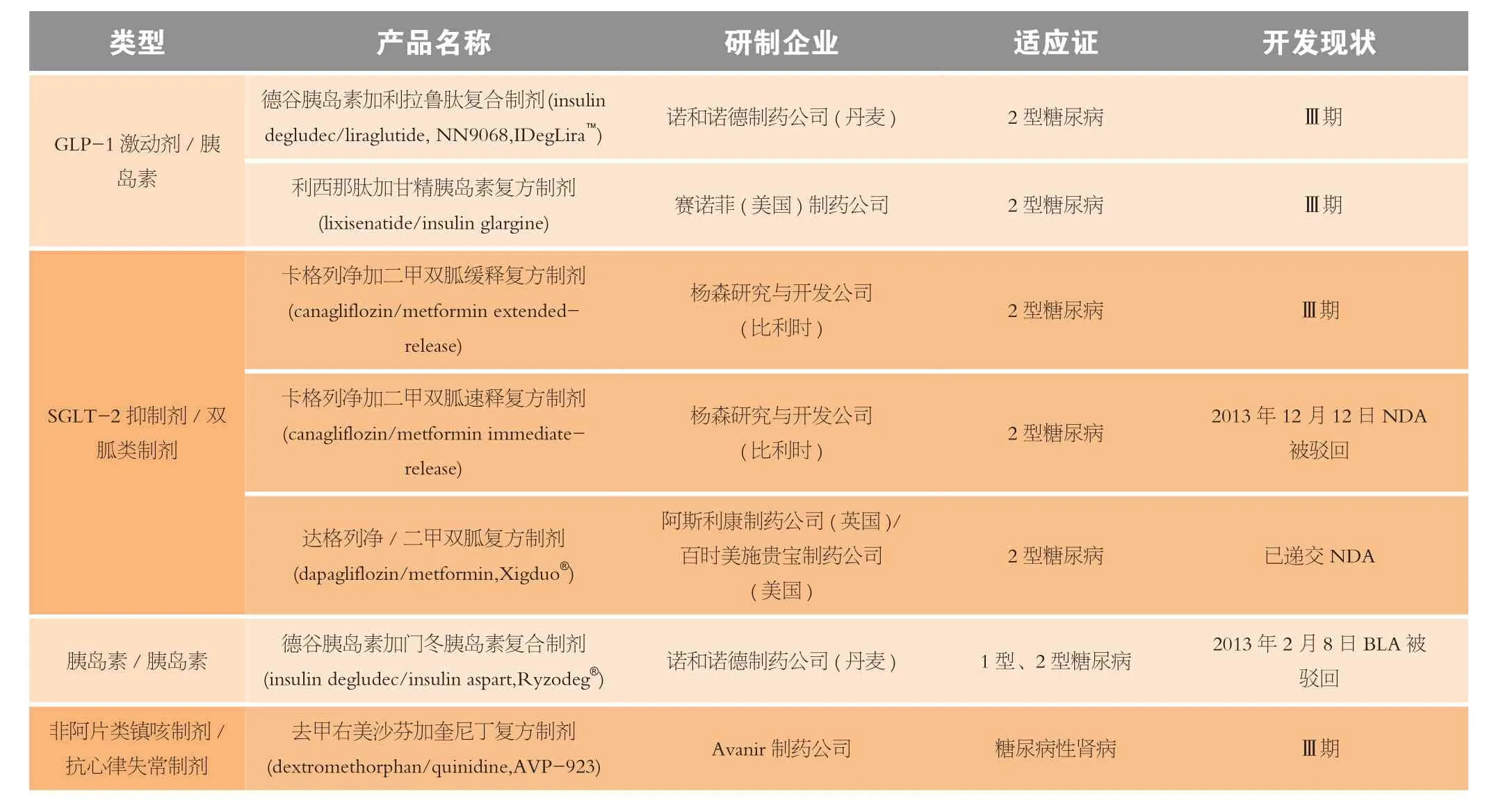
续表3
3.1 苯甲酸阿格列汀加盐酸二甲双胍复方制剂
苯甲酸阿格列汀加盐酸二甲双胍复方制剂(Kazano®,Vipdomet™)由日本武田制药株式会社与美国Furiex制药公司合作开发。阿格列汀是一种DPP-4抑制剂,可减缓肠促胰素GLP-1和GIP的灭活,而二甲双胍是一种临床广泛应用的双胍类降糖药,主要用于减少从肠道吸收进入血液的糖量,减少肝脏产生的糖量,使人体对胰岛素更敏感。该公司对苯甲酸阿格列汀加盐酸二甲双胍与格列吡嗪加二甲双胍用于糖尿病患者进行的临床对照试验显示,与格列吡嗪加二甲双胍组相比,苯甲酸阿格列汀加盐酸二甲双胍组患者可较长时间维持正常血糖水平,降低HbA1c水平方面的效果更佳,且不增加体质量;低血糖的发生率也明显更低[30]。
3.2 苯甲酸阿格列汀加盐酸吡格列酮复方制剂
苯甲酸阿格列汀加盐酸吡格列酮复方制剂(Oseni®,Incresync™)是目前获得FDA批准的唯一一个DPP-4抑制剂加噻唑烷二酮类制剂的复方制剂,其中吡格列酮为增强胰岛素敏感性的噻唑烷二酮类制剂,用作糖尿病患者辅助饮食和锻炼的降糖药。该复方制剂每日最大剂量为苯甲酸阿格列汀25 mg加盐酸吡格列酮45 mg。对1 554名2型糖尿病患者进行的4项临床试验结果显示,苯甲酸阿格列汀加盐酸吡格列酮非常安全和有效,与单用盐酸吡格列酮和苯甲酸阿格列汀相比,该复方制剂能分别使HbA1c水平多降低0.4%~0.6%和0.4%~0.9%,HbA1c和空腹血糖水平变化值具有统计学意义[31]。该复方制剂于2011年7月获得日本MHLW的批准,并于2013年1月25日获得FDA的批准。
3.3 达格列净加二甲双胍复方制剂
达格列净加二甲双胍复方制剂(Xigduo™)是英国阿斯利康制药公司与美国百时美施贵宝制药公司合作开发的SGLT-2抑制剂加双胍类药物的复方制剂,其中达格列净是EMA于2012年11月批准用于治疗2型糖尿病患者的首个SGLT-2抑制剂,于2014年1月8日获得FDA批准。这2家制药公司利用达格列净和二甲双胍的作用互补机制,将二者制备为复方制剂用于增强血糖控制。该复方制剂为片剂,分达格列净5 mg/二甲双胍850 mg和5 mg/1 000 mg 2种规格,用法为每日2次。EMA于2014年1月22日批准达格列净加二甲双胍复方制剂用于治疗用二甲双胍类药或将单剂量达格列净和二甲双胍合用不能适当控制血糖的18岁及以上糖尿病患者[32]。该复方制剂获得批准标志着首个获得批准的SGLT-2抑制剂加双胍类药物的复方制剂的诞生,将为内分泌科医师和成人2型糖尿病患者提供另一个有价值的治疗选择。
4 结语
糖尿病是当代全球最重要的健康问题之一。糖尿病葡萄糖代谢平衡的复杂机制导致药物研发人员发现许多潜在抗糖尿病疗法的新型目标。与此同时,许多制药公司正在开发新的抗糖尿病药物,以解决目前未满足的治疗糖尿病需求。据统计,2013至今进入Ⅲ期临床试验或递交NDA/ BLA或获得批准的用于治疗糖尿病的药物有65种,分为非胰岛素类抗糖尿病药(41种,包括用于治疗糖尿病相关疾病的药物10种,占63.1 %)、胰岛素类药(8种,12.3%)和复方制剂(16种,24.6%)。这些数据表明国际制药公司将开发糖尿病新药的重点集中在非胰岛素类抗糖尿病药物上,并且这些药物的类型很广泛,41种药物细分为14类,其中GLP-1受体激动剂、DPP-4抑制剂与SGLT-2抑制剂共23种,这3类制剂是非胰岛素抗糖尿病候选新药的热点和重点。另外,进入Ⅲ期临床试验的还有2种单抗和2种疫苗等,这表明制药公司在开发热点和重点类型药物的同时,也注重对新型生物制剂的开发和研究。另外,由于一些患者随着病情进展单用1种降糖药难以控制血糖,需要联合用药[28],故制药公司也非常重视复方制剂的开发与研究,该类制剂也占较大的比例。
[1]International Diabetes Federation. IDF Diabetes Atlas,56th[EB/OL]. [2013-12-10].http://www.idf.org/sites/default/files/EN _6E_Atlas_ Full_0.pdf.
[2]蔡旭,苑冀蓉, 邓正华,等.Ⅱ型糖尿病患者血清脂联素水平的测定及临床意义[J].医学理论与实践,2008,21(11): 1333.
[3]PhRMA. Report (2013): Medicines in development for older Americans[R/OL].[2013-12-10].http://www.phrma. org/sites/default/ fles/pdf/oac2013.pdf.
[4]PhRMA.2014 Report: Medicines in Development for Diabetes[R/ OL].[2014-02-20].http://www.phrma.org/ sites/default/ files/pdf/ diabetes2014.pdf.
[5]Toscano D. The market for type 2 diabetes therapeutics - dey fndings from a recent analysis of global drug development efforts[EB/OL]. [2014-01-18].http://www.drugdeliverytech.com/Main/Back-Issues/ MARKET-BRIEF- The-Market-for-Type-2-Diabetes-Therap-641.aspx.
[6]Kameoka J, Tanaka T, Nojima Y, et al. Direct association of adenosine deaminase with a T cell activation antigen,CD26[J].Science, 1993,261(5120):465-469.
[7]张俊清.DPP-4抑制剂调节血糖的作用机制及临床效[J].药品评价,2011,8(21):27-30.
[8]Ghatak S B, Patel D S, Shanker N, et al.Alogliptin: a novel molecule for improving glycemic control in typeⅡ diabetes mellitus[J].Curr Diabetes Rev,2010,6(6):410-421.
[9]White W B, Cannon C P, Heller S R, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes[J].N Engl J Med,2013,369(14):1327-1335.
[10]Novartis International AG. Novartis Q3 and 9M 2013 Condensed Interim Financial Report - Supplementary Data[EB/OL].[2013-10-21].http://www.novartis.com/downloads/investors/financial-results/ quarterly-results/2013-10-interim-fnancial-report-en.pdf.
[11]Holst J J. The physiology of glucagon-like peptide 1[J].Physiol Rev,2007,87(4):1409-1439.
[12]Jimenez-Solem E,Rasmussen M H,Christensen M. Dulaglutide,a long-acting GLP-1 analog fused with an Fc antibody fragment for the potential treatment of type 2 diabetes[J].Curr Opin Mol Ther,2010,12(6):790-797.
[13]Eli Lilly and Company. Lilly's investigational GLP-1 receptor agonist,dulaglutide,showed superior glycemic control versus comparators in patients with type 2 diabetes[EB/OL].[2014-01-18]. https://investor.lilly.com/ releasedetail.cfm?ReleaseID=773117.
[14]FierceBiotech.Dulaglutide,EliLilly[EB/OL].[2014-01-08].http://www. fercebiotechcom/special-reports /dulaglutide-10-top-drugs-biopharmaslate-stage-pipeline.
[15]Werner U, Haschke G, Herling AW, et al. Pharmacological profile of lixisenatide: a new GLP-1 receptor agonist for the treatment of Type 2 diabetes[J].Regul Pept,2010,164(2/3):58-64.
[16]Kanai, Y, Lee W S, You G, et al.The human kidney low affinity Na+/glucose cotransporter SGLT-2. Delineation of the major renal reabsorptive mechanism for D-glucose[J].J Clin Invest,1994,93(1):397-404.
[17]Cada D J, Ingram K T, Levien T L, et al.Canagliflozin[J].Hosp Pharm,2013,48(10):855-867.
[18]Stenlof K, Cefalu W T, Kim K A, et al. Efficacy and safety of canagliflozin monotherapy in subjects with type 2 diabetes mellitus inadequately controlled with diet and exercise[J].Diabetes Obes Metab, 2013,15(4):378-382.
[19]Albarrán O G, Ampudia-Blasco F J.Dapagliflozin, the first SGLT-2 inhibitor in the treatment of type 2 diabetes[J].Med Clin,2013,141(Suppl 2):36-43.
[20]宋金芝,王玉丽,徐为人.新型钠-葡萄糖协同转运蛋白2抑制剂empaglifozin[J].现代药物与临床, 2013,28(5): 791-795.
[21]Palmer E. Boehringer Ingelheim handed FDA warning letter[EB/ OL].[2013-05-22].http://www.fiercepharma.com/story/ boehringeringelheim-handed-fda-warning-letter/2013-05-22.
[22]Schloot N C. Cohen I R.DiaPep277®and immune intervention for treatment of type 1 diabetes[J].Clin Immunol,2013,149(3):307-316.
[23]Dagan S. Andromeda announces the acceptance of two manuscripts for publication describing its phase 3DIA-AID1Study[EB/ OL].[2014-01-12].http://globenewswire.com/news-relea se/2014/01/12/601796/10063891/en/Andromeda-Announces-the-Acceptance-of-Two-Manuscripts-for-Publication-Describing-Its-Phase-3-DIA- AID-1-Study.html.
[24]American Diabetes Association. Insulin Basics[EB/OL].[2013-12-25].http://www.diabetes.org/living-with- diabetes/treatment-and-care/ medication/insulin/insulin-basics.html.
[25]Pfeffer M. MannKind resubmits new drug application to U.S. FDA for AFREZZA for the treatment of adults with diabetes[EB/OL].[2013-10-14].http://www.news.mannkindcorp.com/phoenix.zhtml?c=147953&p= RssLanding&cat=news&id=1863976.
[26]Cox J.Sanofi Announces New Phase 3 Results for Investigational New Insulin U300[EB/OL].[2014-01-14]. http://m-en.sanofi.com/ Images/35096_20131203_U300_ED_Ⅱ_Ⅲ_IV_ JPI_en.pdf.
[27]Rotenstein LS, Ran N, Shivers J P.Opportunities and challenges for biosimilars: What's on the horizon in the global insulin market? [J].Clin Diabetes, 2012,30(4):138-150.
[28]杜海洲,杨青,宋金燕,等.获批准的抗人类免疫缺陷病毒/获得性免疫缺陷综合征及其并发症的药物研究[J].中国药学杂志,2009,44(2):81-87.
[29]Turner R C, Cull C A, Frighi V, et al. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus:progressive requirement for multiple therapies (UKPDS 49)[J]. JAMA, 1999,281(21):2005-2012.
[30]Del Prata S, Camisasca R, Wilson C, et al. Durability of the efficacy and safety of alogliptin compared to glipizide over 2 years when used in combination with metformin[EB/OL].[2014-02-10].http:// www. abstractsonline.com/Plan/ViewAbstract.aspx?sKey=0687e7c8-c97d-442b-92ec-ae505e051854&cKey=f9db1f36-e10e-4182-a6d5-175c4983ba21&mKey=89918d6d-3018-4ea9-9d4f-711f98a7ae5d.
[31]Fala L. Nesina, Kazano, and Oseni: three alogliptin-based agents approved for the treatment of type 2diabetes[EB/OL].[2014-02-15.http:// www.ahdbonline.com//select-drug-updates/1525-nesina- kazano-andoseni-three-alogliptin-based-agents-approved-for-the-treatment-of-type-2-diabetes.
[32]AstraZeneca plc.XIGDUO™(dapagliflozin and metformin hydrochloride) approved in the European Union for type 2 diabetes[EB/ OL].[2014-01-22].http://www.europeanpharmaceuticalreview. com/23718/news/industry-news/xigduo-dapagliflozin-metforminhydrochloride-approved-european-union-type-2-diabetes/.
Latest Progress in the International Development of Antidiabetic Medicines
DU Haizhou
(Medical Library of the Chinese PLA, Beijing 100039, China)
The international clinical development of 65 new medicines for diabetes and their related diseases in Ⅲ phase clinical trials or their New Drug Application (NDA) or Biological License Application (BLA) submitted and approved from 2013 to the present has been reviewed based on the data in the reports and the Medicines in Development Database published by the Pharmaceutical Research and Manufacturers of America (PhRMA). The 65 new medicines are classifed into non-insulins, insulins and fxed-dose combinations for diabetes. And the new antidiabetic candidates that their NDA/BLA was submitted for approval and the new medicines approved from 2013 to the present are mainly analyzed and discussed.
antidiabetic medicine; insulin; non-insulin antidiabetic medicine; fxed-dose combination; new medicine
R977.15
A
1001-5094(2014)03-0185-11
接受日期:2014-02-17
*通讯作者:杜海洲,编审;
研究方向:医药信息研究与开发;
Tel:010-88178621;E-mail:duhz168@sina.com
