吲哚胺2,3-双加氧酶在T细胞介导的排斥反应移植肾组织中的表达
2014-09-07刘佳王晓勃郭涛刘丽丰贵文尚文俊刘磊李金锋
刘佳 王晓勃 郭涛 刘丽 丰贵文 尚文俊 刘磊 李金锋
(1.河南医学高等专科学校诊断学教研室,河南郑州 451191;2.郑州大学第一附属医院肾移植科,河南郑州 450052)
随着肾移植技术的提高以及强效免疫抑制药物的应用,肾移植已成为治疗终末期肾病最有效的方法。近年来,移植肾的短期存活率大幅度提高,但远期存活率并不理想[1]。肾移植后受体对移植肾的排斥反应影响肾移植患者长期存活[2-3]。色氨酸在哺乳动物体内普遍贫乏,而它却是T细胞增殖活化过程中合成蛋白质所必需的氨基酸[4]。吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)作为肝脏以外的催化色氨酸沿犬尿氨酸途径代谢的限速酶,耗竭色氨酸而抑制T细胞的免疫反应[5]。本研究通过免疫组织化学方法检测移植肾组织中IDO的表达情况,初步探讨IDO在T细胞介导的排斥反应中的作用。
1 资料与方法
1.1 一般资料 选择郑州大学第一附属医院2008年4月—2012年10月经病理确诊为T细胞介导的排斥反应移植肾组织标本38例,其中移植肾穿刺标本35例,移植肾切除标本3例。38例肾移植患者中,男性24例,女性14例;年龄24~52岁,平均年龄(35.2±9.4)岁;25例患者术后采用他克莫司+吗替麦考酚酯+糖皮质激素三联免疫抑制方案治疗,13例患者采用环孢素A+吗替麦考酚酯+糖皮质激素三联免疫抑制方案治疗。另外随机选取同期10例肾穿刺活组织检查正常的肾组织标本作为对照组。
1.2 肾组织获取 患者排空膀胱后取仰卧位,在彩色多普勒超声探头引导下,采用18 G穿刺枪,选取移植肾下极外侧1/3区域作为穿刺点。嘱患者在平静呼吸状态下屏气,斜角(20~30°)进针,经皮肤、皮下至移植肾表面,避开血管及肠管等重要器官,击发穿刺针,拔出穿刺针后将获取的组织作病理分析,每例患者均穿刺2次。穿刺后,穿刺部位局部敷料包扎,手按压15 min后改用质量为1 kg的盐袋压迫,嘱患者平卧8 h以上,并观察患者生命体征、尿液颜色和尿量等。3例移植肾切除组织均取自移植肾失功能切除患者。
1.3 病理检查及免疫组织化学染色 穿刺获得的组织标本经石蜡包埋、切片,HE、PAS、Masson染色后进行病理诊断,标准参照文献[6]。应用鼠抗人IDO单克隆抗体(美国Chemicon公司),按照二步法免疫组织化学检测试剂盒(北京中杉金桥生物技术有限公司)说明书进行免疫组织化学染色,检测排斥反应移植肾组织中IDO的表达情况。
1.4 结果分析 采用人工计数法,于光学显微镜下观察组织切片的显色反应,细胞浆内出现棕黄色颗粒、染色强度高于背景的非特异性染色为IDO阳性细胞。在高倍镜下随机选取5个不同视野,阳性细胞数0~2%为阴性,3%~25%为弱阳性,26%~50%为阳性,>50%为强阳性。
1.5 统计学处理 采用SPSS 19.0统计软件进行统计学处理,计数资料比较采用χ2检验及Fisher确切概率检验,等级资料的比较采用Kruskal-Wallis H检验,2组间比较采用Nemenyi检验,采用Spearman等级相关分析进行相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 IDO在T细胞介导的排斥反应移植肾及正常肾组织中的表达 T细胞介导的排斥反应移植肾组织中IDO阳性表达率(73.7%)明显高于正常肾组织(0),差异有统计学意义(P<0.01)。T细胞介导的急性排斥反应移植肾组织中IDO阳性表达率明显高于T细胞介导的慢性排斥反应移植肾组织,差异有统计学意义(P<0.05)。见图1~3及表1。
2.2 IDO在T细胞介导的急性排斥反应不同病理分析的移植肾组织中的表达情况 在T细胞介导的急性排斥反应移植肾组织中,不同病理分级的移植肾组织中IDO阳性表达率差异不同:T细胞介导的Ⅰ级急性排斥反应移植肾组织与T细胞介导的Ⅱ级急性排斥反应移植肾组织间的IDO阳性表达差异无统计学意义(P=0.435);T细胞介导的Ⅰ级急性排斥反应移植肾组织与T细胞介导的Ⅲ级急性排斥反应移植肾组织间的IDO阳性表达差异有统计学意义(P=0.002);T细胞介导的Ⅱ级急性排斥反应移植肾组织与T细胞介导的Ⅲ级急性排斥反应移植肾组织间的阳性表达差异有统计学意义(P=0.017),见表1。Spearman等级相关分析发现,IDO的阳性表达强度与T细胞介导的急性排斥反应强度呈负相关(r=-0.696,P<0.05)。IDO在不同病理分级的T细胞介导的急性排斥反应移植肾组织中的免疫组织化学染色情况见图4~6。
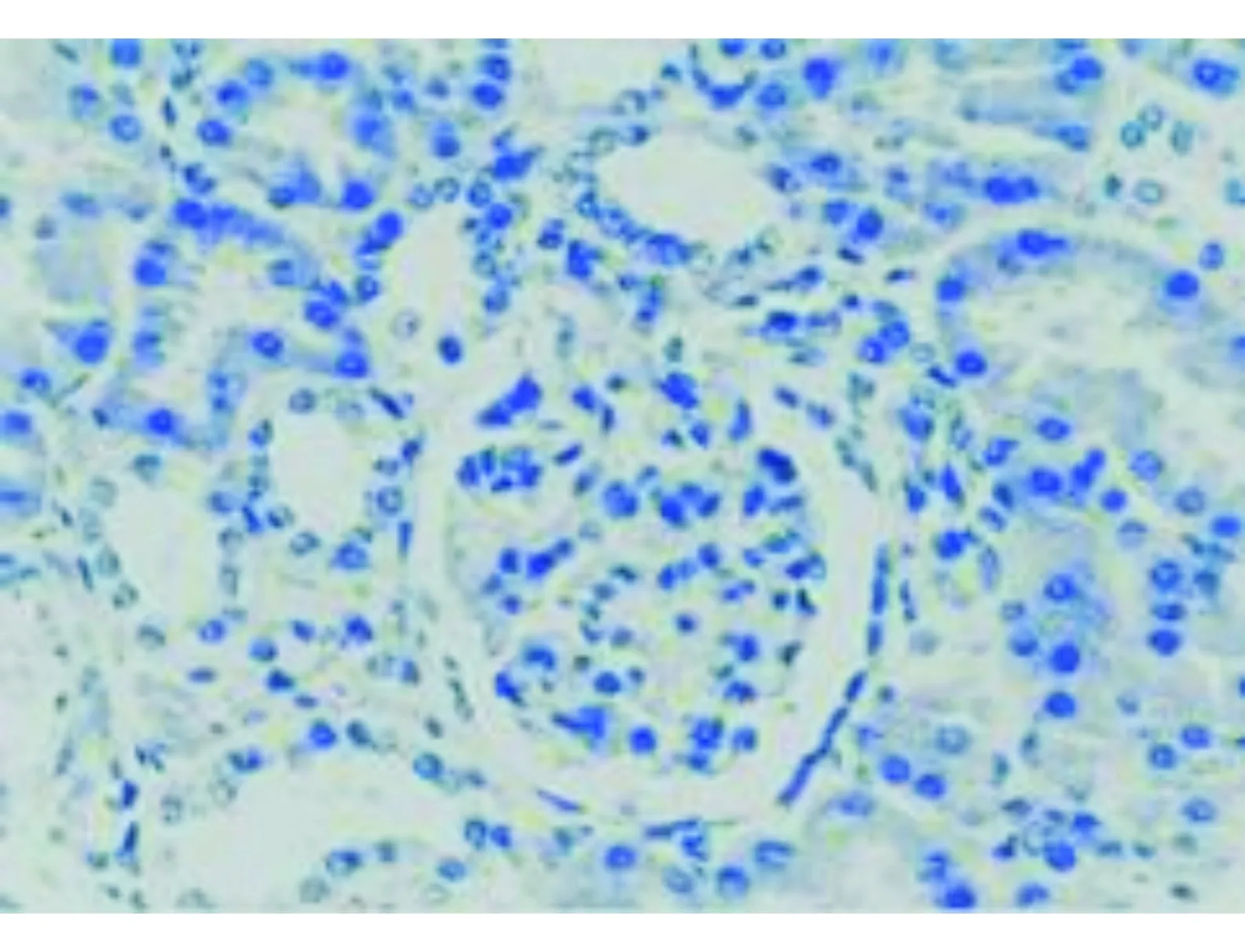
图1 正常肾脏穿刺组织(×400)

图2 IDO在急性排斥反应移植肾组织中表达(×400)

图3 IDO在慢性排斥反应移植肾组织中表达(×400)
表1IDO在不同肾组织中的表达

肾组织分类nIDO表达(n,%)阴性弱阳性阳性强阳性总阳性率/%正常肾组织1010(100.0)0(0.0)0(0.0)0(0.0)0.0 T细胞介导的慢性排斥反应肾组织105(50.0)5(50.0)0(0.0)0(0.0)50.0T细胞介导的Ⅰ级急性排斥反应肾组织130(0.0)6(46.1)5(38.5)2(15.4)100.0T细胞介导的Ⅱ级急性排斥反应肾组织101(10.0)8(80.0)1(10.0)0(0.0)90.0T细胞介导的Ⅲ级急性排斥反应肾组织54(80.0)1(20.0)0(0.0)0(0.0)20.0

图4 IDO在T细胞介导的Ⅰ级急性排斥反应移植肾组织中的表达(×400)
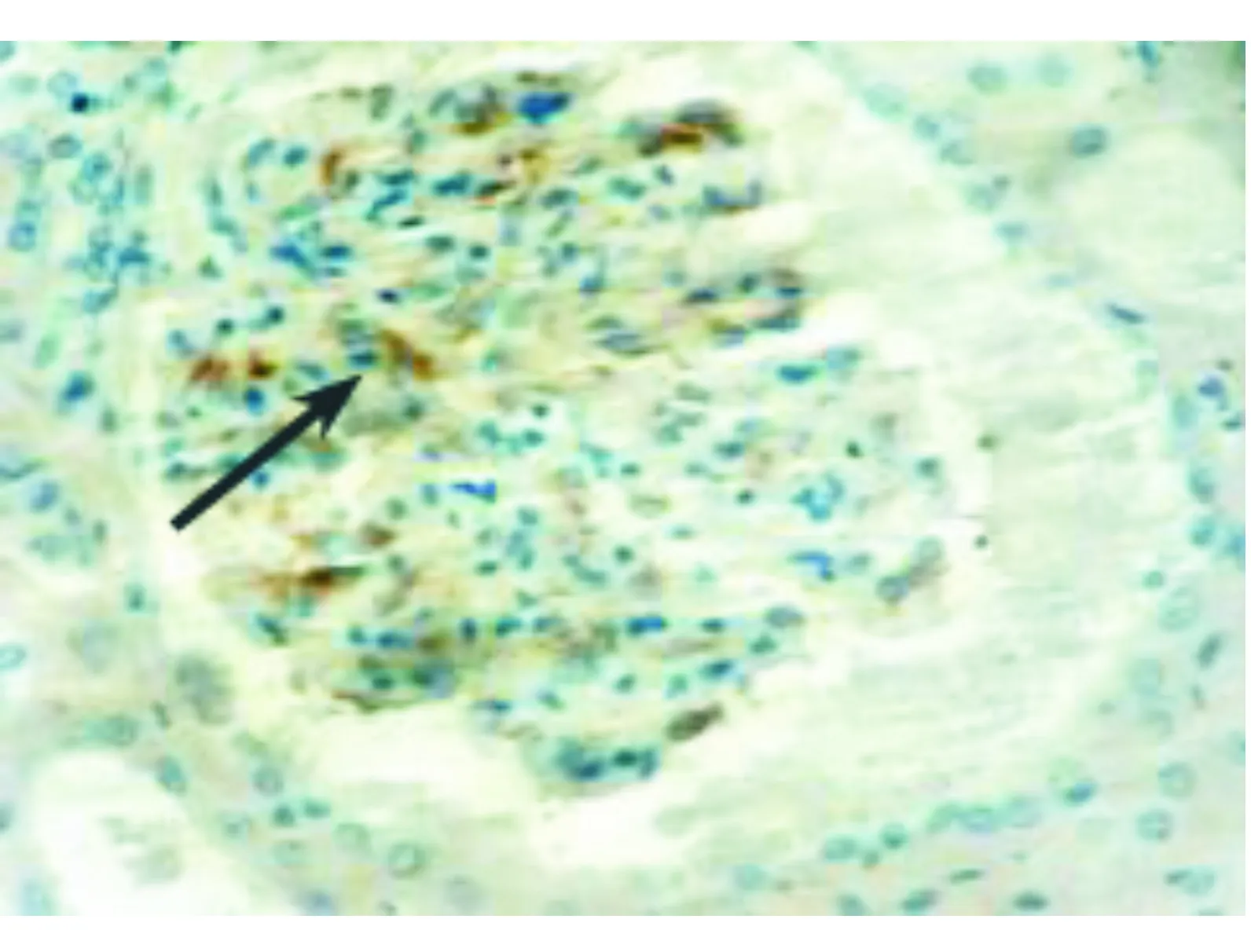
图5 IDO在T细胞介导的Ⅱ级急性排斥反应移植肾组织中的表达(×400)

图6 IDO在T细胞介导的Ⅲ级急性排斥反应移植肾组织中的表达(×400)
3 讨 论
IDO在人的器官组织细胞中均有表达,一些与排斥反应相关的细胞中表达尤为明显,如巨噬细胞和树突状细胞[7]。此外,IDO还分布于一些免疫特赦或免疫耐受的组织中,如附睾、胃肠道黏膜、胎盘和胸腺等。IDO在这些组织中的免疫抑制作用机制可能与其对色氨酸的分解代谢及其代谢产物有关。正常人体内的IDO生物活性很低,人体主要通过肝内的色氨酸加氧酶(tryptophan dioxygenase,TDO)氧化代谢色氨酸。在器官移植后、妊娠状态或存在自身免疫性疾病等非生理状态时,体内IDO表达显著上调,血清中的色氨酸/犬尿氨酸比值也明显降低[8-9]。
研究[10]显示,正常情况下,肾组织中不表达IDO;而肾移植后由于不断受到宿主的免疫攻击,肾组织中可高表达IDO,说明IDO可能在发生排斥反应的移植肾中发挥一定作用。本研究结果亦显示,正常肾组织中不表达IDO,T细胞介导的排斥反应移植肾组织中IDO的阳性表达率达73.7%。当IDO处于高表达、高活性状态时,其产生的免疫抑制效应可以有效地对抗T细胞介导的排斥反应,此时T细胞介导的急性排斥反应的发生率较低,排斥反应的级别也较低;在IDO表达较少、活性较低的情况下,其免疫抑制效应不能有效地对抗T细胞介导的排斥反应,此时T细胞介导的急性排斥反应的发生率较高,排斥反应的级别较高。本研究进行的Spearman等级相关分析也表明,随着IDO表达强度的提高,T细胞介导的急性排斥反应强度逐渐降低,这可能与低表达的IDO所产生的免疫抑制效应减弱有关。
综上所述,肾移植术后,由于受体免疫状态的改变,免疫细胞不断刺激移植肾,诱导移植肾组织中IDO的表达,其表达强度与T细胞介导的急性排斥反应的程度呈负相关,高表达的IDO可能会抑制T细胞介导的排斥反应。
[1]Padiyar A,Akoum FH,Hricik DE.Management of the kidney transplant recipient[J].Prim Care,2008,35(3):433-450.
[2]Giral M,Foucher Y,Karam G,et al.Kidney and recipient weight incompatibility reduces long-term graft survival[J].J Am Soc Nephrol,2010,21(6):1022-1029.
[3]Yeates K,Wiebe N,Gill J,et al.Similar outcomes among black and white renal allograft recipients[J].J Am Soc Nephrol,2009,20(1):172.
[4]Takikawa O.Biochemical and medical aspects of the indoleamine 2,3-dioxygenase-initiated L-tryptophan metabolism[J].Biochem Biophys Res Commun,2005,338(1):12-19.
[5]Frumento G,Rotondo R,Tonetti M,et al.Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2,3-dioxygenase[J].J Exp Med,2002,196(4):459-468.
[6]Solez K,Colvin RB,Racusen LC,et al.Banff 07 classification of renal allograft pathology:updates and future directions[J].Am J Transplant,2008,8(4):753-760.
[7]Mellor AL,Munn DH.IDO expression by dendritic cells:tolerance and tryptophan catabolism[J].Nat Rev Immunol,2004,4(10):762-764.
[8]Espey MG,Namboodiri MA.Selective metabolism of kynurenine in the spleen in the absence of indoleamine 2,3-dioxygenase induction[J].Immunol Lett,2000,71(1):67-72.
[9]Hainz U,Obexer P,Winkler C,et al.Monocyte-mediated T-cell suppression and augmented monocyte tryptophan catabolism after human hematopoietic stem-cell transplantation[J].Blood,2005,105(10):4127-4134.
[10]Brandacher G,Cakar F,Winkler C,et al.Non-invasive monitoring of kidney allograft rejection through IDO metabolism evaluation[J].Kidney Int,2007,71(1):60.
