不同方法制备的Ce0.9Zr0.1O2固溶体对硫转移剂脱硫性能的影响
2014-09-06李春义杨朝合
金 萍,张 强,李春义,杨朝合
(中国石油大学(华东)重质油国家重点实验室,山东 青岛 266580)
不同方法制备的Ce0.9Zr0.1O2固溶体对硫转移剂脱硫性能的影响
金 萍,张 强,李春义,杨朝合
(中国石油大学(华东)重质油国家重点实验室,山东 青岛 266580)
采用共沉淀法、改进的溶胶凝胶法、反相微乳液法及水热合成法合成了Ce0.9Zr0.1O2固溶体,并以此铈锆固溶体作为氧化促进剂,采用酸法合成相应的硫转移剂。利用X射线衍射(XRD)、氮气吸附-脱附、程序升温还原(H2-TPR)及储氧量(OSC)测定法对Ce0.9Zr0.1O2固溶体的结构组成、储氧性能进行表征。利用模拟FCC工业装置的实验室微型反应装置对硫转移剂进行贫氧氧化脱硫性能评价。结果表明,采用改进的溶胶凝胶法合成的Ce0.9Zr0.1O2固溶体具有优异的热稳定性、低温氧化-还原性及储氧性能,由其作为氧化促进剂制得的硫转移剂在贫氧条件下具有最佳的脱硫活性,并且具有较好的活性稳定性。
Ce0.9Zr0.1O2固溶体 制备方法 储氧能力 硫转移剂
硫转移剂法是催化裂化烟气脱硫技术中最常用的方法[1]。硫转移剂的活性位包括吸硫组分和氧化-还原促进组分。吸硫组分的研究已相当成熟,常用的吸硫组分为镁铝尖晶石及类水滑石[2],氧化促进组分为单一的金属氧化物,以CeO2应用最为广泛。普遍认为CeO2对SO2的氧化促进作用与其立方相萤石结构和易变的价态是密不可分的。然而,CeO2存在两个弊端[3]:①高温环境导致氧化铈立方萤石结构破坏,最终导致CeO2储放氧性能下降甚至丧失;②含量少的氧空位导致氧离子传导率低,尤其对于催化裂化两段再生工艺,第一个再生器中氧气体积分数一般不大于0.5%,而沉积在焦炭中约80%的硫在第一再生器中生成SOx,主要是SO2,部分SOx不经过第二再生器直接排放入大气中,严重影响了硫转移剂的脱硫性能,即以CeO2为氧化促进剂的硫转移剂在贫氧条件下脱硫效果差。因此,寻找一种储氧能力更高的储氧材料势在必行。铈锆固溶体在汽车尾气三效催化剂(TWCs)中被广泛研究及应用,半径较小的锆离子部分取代铈晶格中的铈,使晶胞收缩,产生更多的缺陷位,同时弥补了Ce4+/Ce3+转变过程中的体积膨胀效应,从而使体相反应过程变得容易,因而铈锆固溶体具有更好的低温储氧能力[4]。铈锆固溶体的制备方法主要有微乳液法、共沉淀法、溶胶凝胶法、固相反应法、浸渍法、水热合成法等。高典楠等[5]研究了共沉淀法、均相沉淀法和微乳液法,发现微乳液法相比于其它两种方法制备的固溶体具有粒径均一、比表面积大、储氧性能好的优势。Alifanti等[6]对比了溶胶凝胶法和柠檬酸法,发现溶胶凝胶法可得到均相的铈锆固溶体(CeO2的质量分数低于20%)。研究表明,同种材料的颗粒大小和粒径分布若不同,其催化效果亦不同,因此,选择一种合适的制备方法,制备出高纯度、均相、粒度分布均匀、储氧性能优异的材料是非常关键的。
1 实 验
1.1 样品的合成
1.1.1 Ce0.9Zr0.1O2固溶体的合成 ①反相微乳液法:按n(Ce4+)n(Zr4+)=91的比例称取硝酸铈和氧氯化锆,溶于一定量去离子水中配成溶液A,取58 g正庚烷、15 g环己烷及19 g Triton X-100配成乳浊液B,在搅拌状态下将溶液A逐滴加入至乳浊液B中,搅拌均匀得到乳浊液C。将乳浊液C逐滴加入至乳浊液D(与乳浊液C类似,只是水中含有0.35 molL的四甲基氢氧化铵)中,搅拌2 h后,在室温下陈化5 h,随后用无水乙醇过滤洗涤,在140 ℃下干燥2 h,在700 ℃下焙烧2 h得实验样品,将其命名为IME。②共沉淀法:按n(Ce4+)n(Zr4+)=91的比例称取硝酸铈和氧氯化锆,溶于一定量去离子水中,在不断搅拌的过程中逐滴加入氨水直至pH为11左右,搅拌2 h后在室温下陈化24 h,随后过滤,用去离子水洗涤至pH不再发生变化,在140 ℃下干燥2 h,在700 ℃下焙烧2 h得实验样品,将其命名为CP。③改进的溶胶凝胶法:按n(Ce4+)n(Zr4+)=91的比例称取硝酸铈和氧氯化锆,与柠檬酸一并溶于一定量去离子水中,搅拌2 h后转移至80 ℃的水浴锅中,继续搅拌直至形成透明黄色的湿凝胶,在140 ℃下干燥2 h,在700 ℃下焙烧2 h得实验样品,将其命名为CSG。④水热合成法:按n(Ce4+)n(Zr4+)=91的比例称取硝酸铈和氧氯化锆,溶于一定量去离子水中,在不断搅拌的过程中逐滴加入氨水直至pH为11左右,搅拌2 h后转移至晶化釜中,在115 ℃下晶化24 h,随后过滤、洗涤至pH不再发生变化,在140 ℃下干燥2 h,在700 ℃下焙烧2 h得实验样品,将其命名为HS。
1.1.2 硫转移剂的合成 采用酸法制备硫转移剂,制备方法如下:按样品中n(Mg2+)n(Al3+)=1.181、n(Al3+)n(Fe3+)=91的比例称取拟薄水铝石、轻质氧化镁和硝酸铁。首先将拟薄水铝石和一定量蒸馏水的悬浊液搅拌均匀,逐滴向其中加入一定量浓盐酸,形成均匀溶胶后转移至65 ℃恒温水浴锅中调节至pH为3。然后将轻质氧化镁制成的均匀镁浆与铝凝胶充分混合,并加入硝酸铁和制备的Ce0.9Zr0.1O2固溶体(Ce0.9Zr0.1O2固溶体质量分数为10%并以原子级混合方式加入)。在140 ℃干烘箱中烘干2 h,在700 ℃马福炉中焙烧2 h,最后研磨成80~120目颗粒。分别将以IME,CP,CSG,HS为氧化促进剂制备的硫转移剂命名为IMEMgAlFe,CPMgAlFe,CSGMgAlFe,HSMgAlFe。为了便于对比,以相同制备方法、相同添加量制备未改性的硫转移剂CeO2MgAlFe。
1.2 样品的表征
利用Panalytical公司生产的X’Pert PRO MPD衍射仪对实验样品进行物相结构分析。测定条件:Cu靶,Kα射线,管电流40 mA,管电压45 kV,在2θ=5°~75°的范围内扫描。
利用Quantachrome公司生产的Quadrasorb SI吸附仪,采用氮气低温静态吸附容量法测定实验样品的比表面积和孔结构。首先将实验样品在300 ℃下抽真空处理3 h,然后在液氮温度(-196 ℃)下测定吸附-脱附曲线。
利用天津先权公司生产的TP-5079化学吸附仪进行程序升温还原测试。称取约100 mg实验样品放入石英管中,首先升温至200 ℃对样品进行预处理,目的是脱除样品表面物理吸附的杂质,然后在氦气流中降温至80 ℃,切换测试气体(TPR采用10% H2-90% N2),待基线平稳后记录热导池检测器(TCD)信号。气体流量为30 mLmin,升温速率为10 ℃min。
利用天津先权公司生产的TP-5079化学吸附仪进行氧脉冲吸附测定样品储氧量的试验。称取50 mg实验样品放入吸附石英管中,首先在混氢(10% H2-90% N2)气流中升温至600 ℃,并在此温度下保持还原2 h。随后在混氢气氛中降温至80 ℃,切换为高纯氦气,吹扫30 min,并开始记录,待基线平稳后每隔2 min脉冲进一次纯氧,直至吸附饱和,采用热导池检测器检测氧气信号值。气体流量为30 mLmin,升温速率为10 ℃min。
4)ADC采样序列转化完成,进入中断处理,连续10次采样后,对每个通道10次采样数据按从小到大排序、滤波;通过参考电压ADCINA0和ADCINB0来计算Gain和Offset的值;最后由这两个参数来自动校准其他通道的采集信号。
1.3 硫转移剂的脱硫活性及再生性能评价
硫转移剂的氧化脱硫性能评价采用固定床微型反应器在稳态贫氧(2 400 μgg的SO2,0.9%的O2和N2平衡气)模拟条件下进行。取0.500 0 g样品装填在微型反应器中间,反应器上部和下部均装填石英砂以固定催化剂床层,利用热电偶控制反应温度在700 ℃,以模拟FCC再生器环境,反应后气体由TESTO 350 EPA型烟气分析仪分析其中SO2的浓度。本实验定义脱硫率降至90%时的时间为失活时间。再生性能的评价是将失活样品在600 ℃下用88 mLmin的H2还原40 min,再生后再次进行氧化脱硫性能评价,采用4次连续氧化脱硫-还原再生循环考察硫转移剂的活性稳定性。
2 结果与讨论
2.1 XRD表征
图1为不同方法所制铈锆固溶体的XRD图谱。由图1可知:反相微乳液法合成的样品IME只存在Ce2Zr2O7.04特征衍射蜂;而其余3种制备方法所合成的样品只存在CeO2特征衍射峰,均合成出目标产物,且其晶体结构均为立方相萤石结构。值得注意的是,一方面,由于按n(Ce4+)/n(Zr4+)=9/1加料,其中锆添加量甚少,尚未形成晶相,因而XRD谱图中并未出现Ce0.9Zr0.1O2固溶体的特征衍射峰,而仅出现了CeO2的特征衍射峰;另一方面,XRD分析软件尚未收录Ce0.9Zr0.1O2固溶体卡片信息,因此这里暂称为Ce0.9Zr0.1O2固溶体。相比CeO2的特征衍射峰,这4种制备方法所制铈锆固溶体的衍射峰均往大角度方向偏移,主要是离子半径较小的Zr4+部分取代了晶格中的Ce4+所造成的(CeO2的特征衍射峰:28.59°,33.13°,47.56°,56.43°;反相微乳液法:28.78°,33.36°,47.60°,56.67°;共沉淀法:28.59°,33.11°,47.61°,56.61°;改进的溶胶凝胶法:28.69°,33.24°,47.73°,56.78°;水热合成法:28.63°,33.11°,47.71°,56.50°)。由其偏移程度可知Zr4+进入CeO2晶格的程度,反相微乳液法所制样品中有更多Zr4+进入CeO2晶格,其次是改进的溶胶凝胶法、水热合成法和共沉淀法制备的样品。采用反相微乳液法时,合成物并非目的产物,说明相比其余3种制备方法,反相微乳液法不易按投料比控制目的产物的生成。

图1 不同方法所制铈锆固溶体的XRD图谱◆—CeO2; ▲—Ce2Zr2O7.04
表1为不同方法所制铈锆固溶体的平均晶粒尺寸。由表1可知:反相微乳液法所制样品IME的平均晶粒尺寸最小,为8.20 nm,但是由于该法在制样过程中对合成比例控制上的劣势,及实际制样中的时长限制等不利因素,不将其考虑在内;而在剩余的3种制备方法中,以改进的溶胶凝胶法所制样品CSG的晶粒尺寸最小,为10.10 nm,共沉淀法所制样品CP的平均晶粒尺寸最大,为12.20 nm,原因是Ce3+和Zr4+同时沉淀,使铈、锆原子的混合均匀程度较差。

表1 不同方法所制铈锆固溶体的平均晶粒尺寸
2.2 N2吸附-脱附表征
图2为不同方法所制铈锆固溶体的吸附-脱附曲线。由图2可知,4种方法所得铈锆固溶体的吸附-脱附曲线均具有滞后回环,说明样品存在介孔结构,且相比于其它3种制备方法,改进的溶胶凝胶法所制样品的孔类型为圆柱形管状孔,而其它3个样品均为墨水瓶状孔[6]。
表2为不同方法所制铈锆固溶体的结构特征参数。由表2可知, 不同的制备方法对铈锆固溶体的比表面积具有较大的影响,反相微乳液法所得新鲜样品IME的比表面积最大,为69.61 m2/g,这与其水油体系下的微乳前躯体的形成有关,而水热合成法和共沉淀法所制样品的比表面积依次减小,主要与制备过程中的陈化和晶化操作相关。比较老化前后4种制备方法所得固溶体的比表面积,它们的烧结率分别为58.13%(反相微乳液法)、50.70%(水热合成法)、49.90%(共沉淀法)、47.19%(改进的溶胶凝胶法),表明圆柱形孔类型有利于抵抗高温水热环境。对于催化裂化高温水热环境,需要一种热稳定性能良好的氧化促进剂。因此,推测改进的溶胶凝胶法为适宜的制备方法。此外,4种方法所制样品的平均孔径由大到小的顺序为CSG>CP>HS>IME,对于较高空速的催化裂化反应,要求催化材料具有大孔径结构。
2.3 OSC测试
表3为不同方法所制铈锆固溶体的储氧量。由表3可知:4种样品中,以改进的溶胶凝胶法所制样品CSG的储氧量最大,说明该样品具有最多的氧空穴数量,且吸氧能力最强;反相微乳液法所制样品IME的储氧量较小,可能与它合成了非预期物质有关,而该物质的晶相可能也并非立方相,而是某些亚稳态相,这需要通过拉曼光谱进一步测试。将表3与表2比较可知,大比表面积的样品不一定具有大的储氧量,说明样品的储氧量与样品的比表面积关系不大,主要原因是体相氧的参与削弱了这一作用。因此,提高固溶体的均匀单一性和缺陷性可以有效提高样品的储氧性能[7]。根据氧脉冲吸附法可知累计氧吸附量随氧脉冲次数的变化,吸氧动力学参数由大到小的顺序为:改进的溶胶凝胶法>水热合成法>反相微乳液法>共沉淀法,与储氧量测定结果一致。
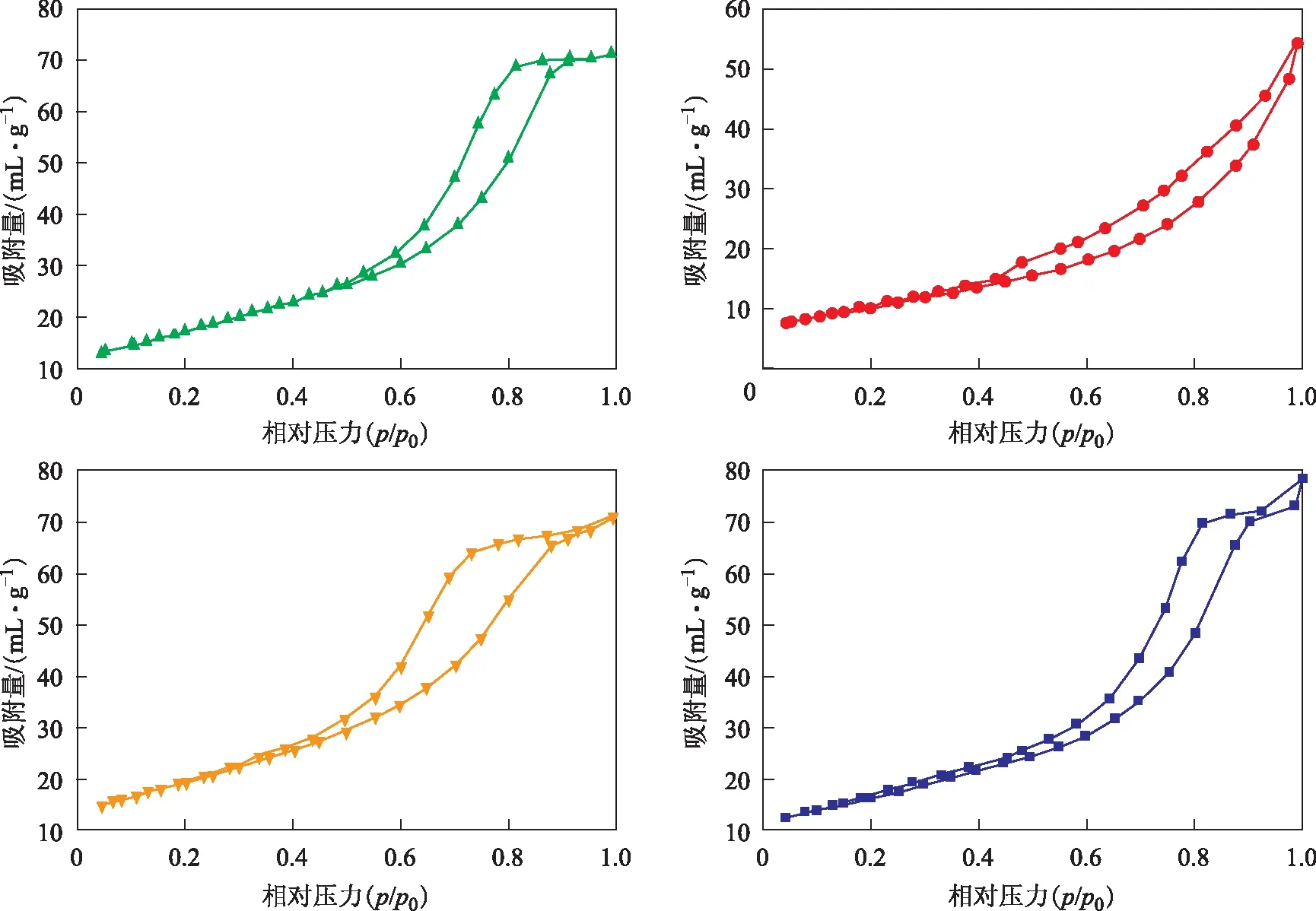
图2 不同方法所制铈锆固溶体的吸附-脱附曲线▲—HS; ●—CSG; ; ■—CP

样 品新鲜样品比表面积∕(m2·g-1)平均孔径∕nm老化样品比表面积∕(m2·g-1)IME69616302884HS61837113048CP58128331754CSG473414592500

表3 不同制备方法所制铈锆固溶体的储氧量
2.4 H2-TPR表征
图3为不同方法所制铈锆固溶体的H2-TPR图谱。由图3可知,CeO2存在两个还原峰,归属于520 ℃的表面氧和大于800 ℃的体相氧,这与刘成文等[8]的研究结果非常接近,他们认为,单组分CeO2的低温还原峰温为535 ℃,高温还原峰温大于800 ℃。除反相微乳液法外,其余3种方法所制铈锆固溶体的H2-TPR谱图在低温区(小于700 ℃)均存在两个还原峰,且峰与峰之间存在一定程度的重叠,因此谱图上表现为一个肩峰和一个大宽峰。值得注意的是,催化裂化反应-再生系统的反应温度分别为700 ℃和550 ℃左右,因而这里讨论的铈锆固溶体低温氧化-还原性能和低温储氧量的温度以700 ℃作为上限。4种制备方法中,以改进的溶胶凝胶法所制固溶体具有最低的出峰温度和峰顶温度,分别为275 ℃和575 ℃,且该法所制样品具有最大的低温(小于700 ℃)还原峰面积,说明该法所得固溶体的体相氧移动能力强,更易向表面、次表面移动,因而其低温氧化-还原性能最好,低温储氧量最大,这归功于该法所得Ce0.9Zr0.1O2固溶体含有更多的氧缺陷位和较小的晶粒尺寸。铈锆固溶体中起氧化-还原促进作用的有效组分是铈,锆的添加只是改变了反应路径,使氧化铈中不易还原的体相氧转变为更易移动的表面氧。改进的溶胶凝胶法所制样品的低温(小于700 ℃)峰面积比单组分CeO2的低温(小于700 ℃)峰面积增大许多,说明锆与铈之间发生了相互作用,提高了样品的储氧量。
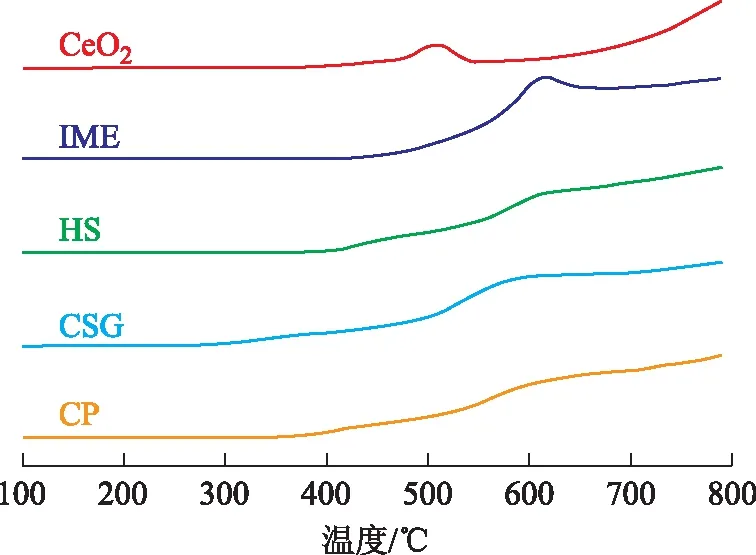
图3 不同方法所制铈锆固溶体的H2-TPR图谱
2.5 硫转移剂氧化脱硫活性和再生性能
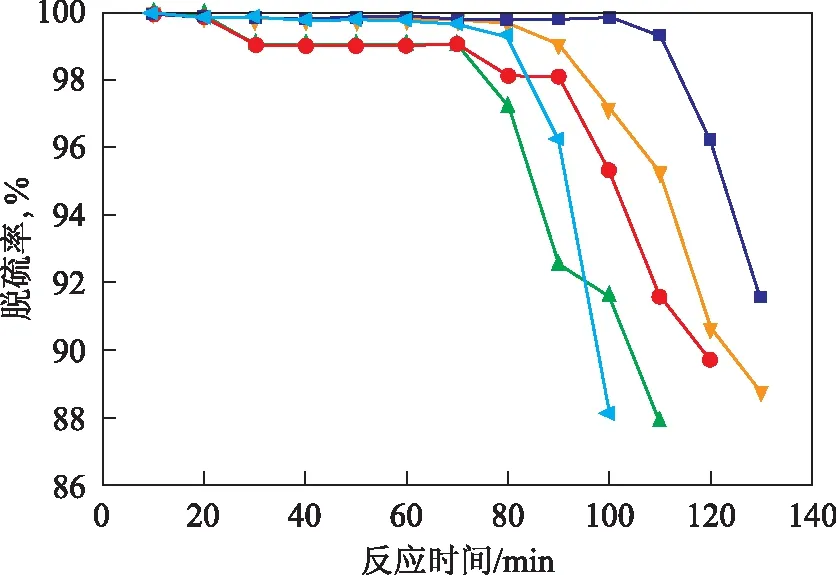
图4 不同方法所制铈锆固溶体基硫转移剂的稳态贫氧氧化脱硫活性评价结果■—CSG/MgAlFe; /MgAlFe; ●—IME/MgAlFe; ▲—CP/MgAlFe; /MgAlFe
图4为不同方法所制铈锆固溶体基硫转移剂的稳态贫氧氧化脱硫活性评价结果。由图4可知,以改进的溶胶凝胶法所合成的CSG/MgAlFe硫转移剂的失活时间最长,接近140 min,原因是相比其它制备方法,该法所制固溶体具有最优异的低温储氧量和氧化-还原性能。根据Royer等[9]的研究结果,体相氧可扩散到表面或以同速率扩散到晶界,因而体相氧的参与弥补了该法所制Ce0.9Zr0.1O2固溶体比表面积较小的劣势。CP/MgAlFe,IME/MgAlFe,HS/MgAlFe硫转移剂的失活时间分别为110,120,130 min。此外,当以未改性的CeO2作为氧化促进剂时,所制硫转移剂CeO2/MgAlFe的失活时间仅为100 min,说明改性后的铈锆固溶体基硫转移剂可在一定程度上改善目前常用的硫转移剂(常以CeO2作为氧化促进剂)在贫氧条件下脱硫效果较差的现状。
硫转移剂的活性稳定性评价结果如图5所示。由图5可知:CSG/MgAlFe硫转移剂比CeO2/MgAlFe硫转移剂具有更好的氧化-还原再生性能,新鲜剂第一次氧化脱硫的失活时间为140 min,一次再生后氧化脱硫失活时间为110 min,二次和三次再生后氧化脱硫的失活时间均为100 min,二次再生后,活性开始稳定;对于CeO2/MgAlFe硫转移剂,其第一次氧化脱硫失活时间为100 min,一次再生后的氧化脱硫的失活时间为70 min,二次和三次再生后的氧化脱硫失活时间均为50 min。CSG/MgAlFe硫转移剂再生性能优异,且能抵抗长时间的高温水热环境,这是因为单纯的CeO2热稳定性差,在氧化脱硫及再生后结晶度提高,晶粒尺寸变大,而铈锆固溶体因具有良好的热稳定性而能维持较小的晶粒尺寸,使有效铈量维持较高的比例。
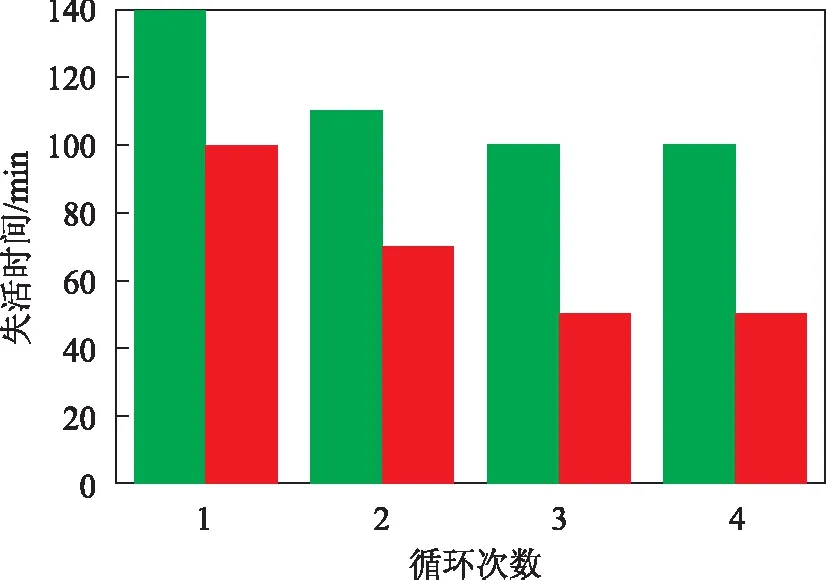
图5 硫转移剂的活性稳定性评价结果■—CSG/MgAlFe; ■—CeO2/MgAlFe
3 结 论
(1) 改进的溶胶凝胶法所制Ce0.9Zr0.1O2固溶体的晶相结构为立方相萤石结构,且除反相微乳液法外,该法所合成样品的晶粒尺寸最小,仅为10.10 nm。
(2) 改进的溶胶凝胶法所制备的Ce0.9Zr0.1O2固溶体孔类型为圆柱形管状孔,而其它3种方法所制样品均为墨水瓶状孔,圆柱形管状孔有利于抵抗高温水热环境。
(3) 改进的溶胶凝胶法所制备的Ce0.9Zr0.1O2固溶体具有高储氧量及优异的氧化-还原性能,因而CSG/MgAlFe硫转移剂具有较好的贫氧氧化脱硫活性,失活时间长达140 min,并且具有较好的活性稳定性,二次再生后,活性开始稳定,失活时间维持在100 min。
[1] 齐文义,丁全福,郝代军.降低催化裂化再生烟气中污染物助剂的研究进[J].炼油技术与工程,2009,38(6):53-56
[2] 田雨.大比表面积水滑石材料的合成及性能研究[D].北京:北京化工大学,2012
[3] 王欣全.过渡金属改性铈基材料电子结构及储放氧机理研究[D].天津:天津大学,2009
[4] 张钺伟.铈锆储氧材料的纳米级制备及性能研究[D].天津:天津大学,2011
[5] 高典楠,刘娜,杜霞如,等.不同制备方法对铈锆复合氧化物结构及性能的影响[J].中国稀土学报,2006,24(1):6-9
[6] Alifanti M,Baps B,Blangenois N,et al.Characterization of CeO2-ZrO2mixed oxides:Comparison of the citrate and sol-gel preparation methods[J].Chemistry of Materials,2003,15(2):395-403
[7] 赵波.富铈基铈锆复合氧化物材料的制备及其负载单Pd催化剂三效催化性能的研究[D].杭州:浙江大学,2011
[8] 刘成文,罗来涛,赵旭.Ce1-xEuxOy固溶体的制备及甲烷燃烧催化性能研究[J].中国稀土学报,2006,24(4):429-432
[9] Royer S,Duprez D,Kaliaguine S.Oxygen mobility in LaCoO3perovskites[J].Catalysis Today,2006,112(1):99-102
EFFECT OF SYNTHESIS METHOD ON PROPERTIES OF Ce0.9Zr0.1O2SOLID SOLUTIONS AND ITS PERFORMANCE IN SULFUR TRANSFER CATALYSTS
Jin Ping, Zhang Qiang, Li Chunyi, Yang Chaohe
(StateKeyLaboratoryofHeavyOilProcessing,ChinaUnversityofPetroleum(EastChina),Qingdao,Shandong266580)
Ce0.9Zr0.1O2solid solutions were prepared by co-precipitation, modified sol-gel (CSG), inverse microemulsion and hydrothermal synthesis method, respectively. The corresponding sulfur transfer catalysts containing Ce0.9Zr0.1O2solid solutions were made by acid process. The Ce0.9Zr0.1O2solid solutions was characterized by X-ray diffraction (XRD), N2adsorption-desorption, oxygen storage capacity test (OSC) and temperature-programmed reduction (H2-TPR). The corresponding sulfur transfer catalysts were evaluated under conditions similar to those in the typical FCC unit. The results indicate that Ce0.9Zr0.1O2solid solution prepared by CSG method shows a relative higher thermostability, better redox behavior and larger OSC value which contribute to a better desulfurization rate of the corresponding sulfur transfer catalysts under the conditions of lean oxygen.
Ce0.9Zr0.1O2solid solution; synthesis method; oxygen storage capacity; sulfur transfer catalyst
2014-05-09; 修改稿收到日期: 2014-08-29。
金萍,硕士研究生,主要从事催化裂化烟气硫转移剂方面的研究工作。
张强,E-mail:girlzhangqiang@163.com。
青岛市民生计划项目(13-1-3-126-nsh)。
