河北省甲型H1N1流感裂解疫苗异常反应监测分析
2014-09-04张振国孙丽张富斌郝玲王丽娜
张振国 孙丽 张富斌 郝玲 王丽娜
·调查研究·
河北省甲型H1N1流感裂解疫苗异常反应监测分析
张振国 孙丽 张富斌 郝玲 王丽娜
目的分析甲型H1N1流感疫苗大规模接种后AEFI 监测情况,评价疫苗的安全性及 AEFI 监测系统敏感性,为制定相关策略提供依据。方法通过全国AEFI信息管理系统,收集河北省2009年10月至2010年5月接种甲流疫苗后报告的AEFI个案,采用描述性方法分析相关数据。结果河北省共接种616万剂次甲流疫苗,报告1 296例AEFI,发生率210.24/100万剂次。报告一般反应1 147例,发生率186.06/100万剂。其中发热/红肿765例,发生率124.10/10万剂。异常反应84例,发生率13.63/100万剂;其中我省报告1例格林巴利综合征,报告发生率分别为0.08/100万。严重AEFI报告25例,发生率为4.05/100万剂,其中死亡报告发生率为0.32/100万剂,病死率为0.15%。78.93%的个案发生在接种后≤1d,个案在发现后≤1d报告率94.98%,在报告后≤1d调查率98.15%。结论大规模接种甲型 H1N1 疫苗AEFI发生率较底,以一般反应为主,异常反应发生率低,河北省AEFI监测的敏感性和及时性较好。
甲型H1N1流感裂解疫苗;疑似预防接种异常反应;安全性;监测
流行性感冒简称流感,是由流感病毒引起的一种急性呼吸道传染病,传染性强、发病率高、容易引起暴发流行或大流行。接种流感疫苗,是预防流感的有效手段之一。2009年6月,世界卫生组织(WHO)将全球流行性感冒(流感)预警级别提高到最高级别6级[1],标志着甲型H1N1进入全球流行阶段,我国是全球第一个完成甲型H1N1流感疫苗研发和注册使用的国家,加强疫苗大规模应用后的疑似预防接种异常反应(adverse events following immunization,AEFI)监测显得十分重要。河北省自建立AEFI监测系统以来,监测系统运转良好。通过对H1N1受种者接种疫苗后的被动和主动监测,收集接种疫苗后的AEFI发生情况。现对监测系统报告的甲流疫苗AEFI个案数据进行分析,评价甲流疫苗的安全性。
1 对象与方法
1.1 对象 2009年10月至2010年5月,河北省共接种6 164 518剂次甲流疫苗,共报告1 296例AEFI,发生率210.24/100万剂。其中一般反应1 147例,发生率186.06/100万剂,占88.50%;异常反应84例,发生率13.63/100万剂,占10.66%;偶合症38例,发生率6.16/100万剂,占2.93%;心因性反应26例,发生率4.22/100万剂,占2.01%;待定1例,发生率0.16/100万剂,占0.08%;无疫苗质量事故及接种事故报告。见表1。
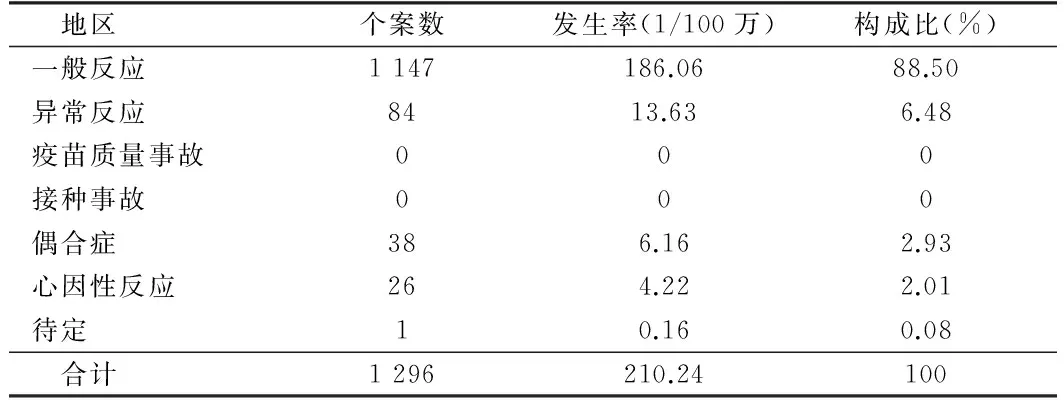
表1 河北省2009年10月至2010年5月甲流疫苗AEFI报告发生率
1.2 AEFI 定义与分类 AEFI指在预防接种过程中或接种后发生的可能造成受种者机体组织器官或功能损害,且怀疑与预防接种有关的反应。包括:(1)一般反应;(2)异常反应;(3)疫苗质量事故;(4)接种事故;(5)偶合症;(6)心因反应。
1.3 接种对象及接种剂量
1.3.1 接种对象:≥6月龄人群,优先考虑关键岗位的公共服务人员、学生及教师、慢性病患者等。根据本省实际工作情况,将优先对以下人群接种:一线医疗卫生人员,一线公安干警,出入境检验检疫、边检人员,民航工作人员,交通运输人员,中小学生、中小学生教师以及慢性病患者。所有受种者接种前进行接种告知、自愿接种(学生由监护人知情同意)。禁忌证:对鸡蛋或疫苗中任何其他成分(包括辅料、甲醛、裂解液等),特别是卵清蛋白过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发病期、感冒和发热者;格林巴利综合征(感染性多发性神经根炎)患者;未控制的癫痫和患其他进行性神经系统疾病者;严重过敏体质者,对硫酸庆大霉素过敏者。
1.3.2 疫苗剂量及程序:6~35月龄儿童采用7.5 μg、2剂次免疫程序,2剂次间隔21~28d;其他适龄人群接种1剂,每1次人用剂量15 μg。
1.4 AEFI 数据来源
1.4.1 报告方式及内容:医疗机构、接种单位、疫苗生产企业、疫苗经营企业及其执行职务的人员发现AEFI后,应填写AEFI个案报告卡或群体性AEFI登记表,并以电话或传真等最快方式进行报告。
1.4.2 报告程序与时限:AEFI报告实行属地化管理。责任报告单位/人发现AEFI后应在24 h内向所在地的县级卫生行政部门、食品药品监管部门报告。县级卫生行政部门、食品药品监管部门收到报告后,立即组织县级疾病预防控制、医疗、药品不良反应监测等机构对AEFI进行调查处理,经核实属于报告范围的AEFI,立即通过全国AEFI报告系统进行网络直报。
怀疑与预防接种有关的死亡、严重残疾、格林巴利综合征和群体性反应等严重的AEFI,医疗机构、接种单位、疫苗生产企业、疫苗经营企业及其执行职务的人员应在2 h内逐级报告。卫生行政部门和食品药品监管部门及时向上一级卫生行政部门和食品药品监管部门报告。属于突发公共卫生事件的,同时按照《突发公共卫生事件与传染病疫情监测信息报告管理办法》等规定进行报告。
1.4.3 AEFI报告范围:包括:①24 h内发生的:过敏性休克,不伴休克的过敏反应(如荨麻疹、斑丘疹、喉头水肿等)。②5d内发生的:发热 (腋温≥37.6℃),血管性水肿,接种部位发生的红肿(直径≥2.6 cm)、硬结(直径≥2.6 cm)。③15d内发生的:过敏性紫癜,血小板减少性紫癜,局部过敏坏死反应(Arthus反应),热性惊厥,癫痫,多发性神经炎。④3个月内发生的格林巴利综合征。⑤其他怀疑与接种有关的死亡、严重残疾或组织器官损伤、群体性反应等。
1.5 资料分析方法 对全国AEFI信息管理系统中的甲流疫苗AEFI个案进行审核,导出、整理数据,使用excel表进行分析。采用描述性方法对AEFI发生特点及相关指标进行流行病学分析。
2 结果
2.1 AEFI性别、年龄及职业分布 在1 296例AEFI中,男性586例、女性710例,男女比例为1∶1.37,女性多于男性;男、女性AEFI报告发生率分别为95.06/100万剂、115.18/100万剂。年龄最小6个月,最大69岁;病例主要集中在5~20岁,占57.41%。报告发生率最高的是10~14岁48.18/100万剂。报告的AEFI个案,主要职业是中小学生709例(54.71%),其次是医务人员和教师,分别为178(13.73%)和164例(12.65%)。见表2、图1。
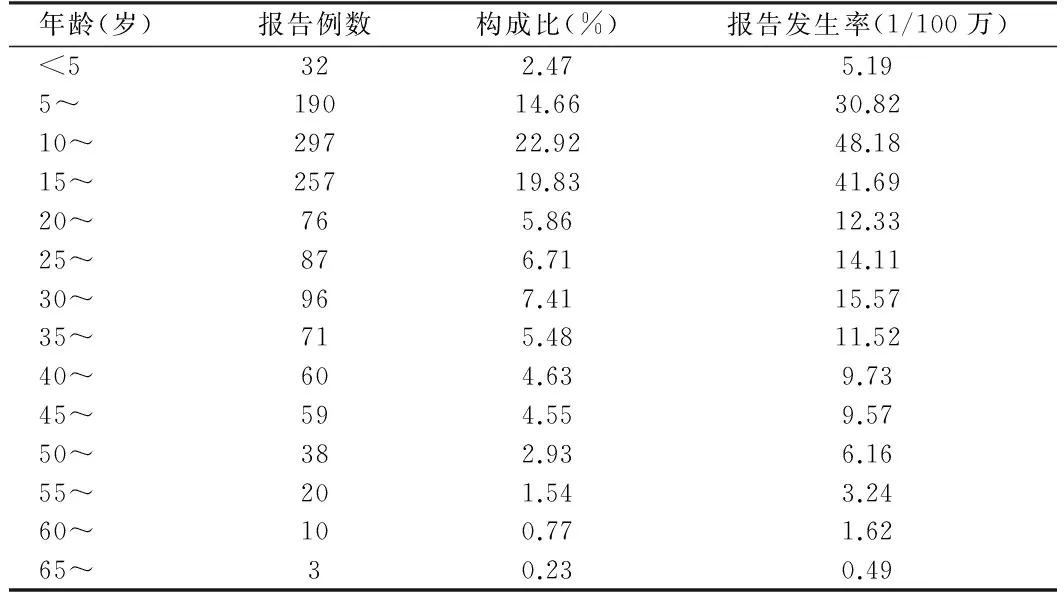
表2 河北省2009年至2010年甲流疫苗AEFI年龄分布

图1 河北省2009至2010年甲流AEFI职业分布
2.2 AEFI地区分布 报告病例覆盖全省11个市区,沧州报告例数最多为384例(29.63%),其次是唐山216例(16.67%),张家口报告例数最少41例(3.16%)。见图2。
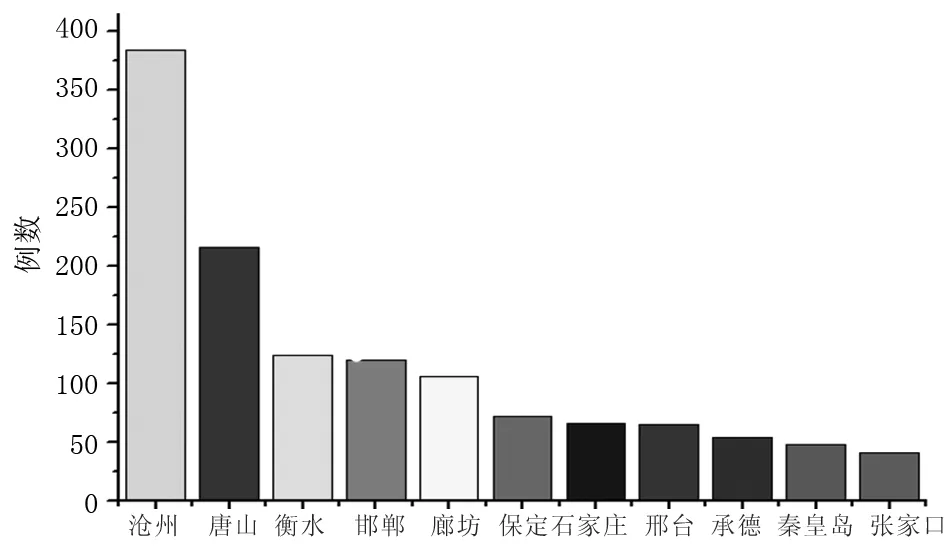
图2 河北省2009至2010年甲流AEFI地区分布
2.3 AEFI时间分布 接种甲型H1N1流感疫苗报告的AEFI自10月份逐渐上升,至11月份达到高峰,而后逐渐下降。见图3。

图3 河北省2009至2010年甲流疫苗AEFI个案时间分布图
2.4 AEFI发生时间间隔 AEFI发生在接种后≤1d的占78.94%,2~3d占16.05%。发生反应后在1d进行就诊的占94.98%,2~3d的占3.32%。报告病例在1d进行调查的占98.15%,2~3d占1.77%。见表3。
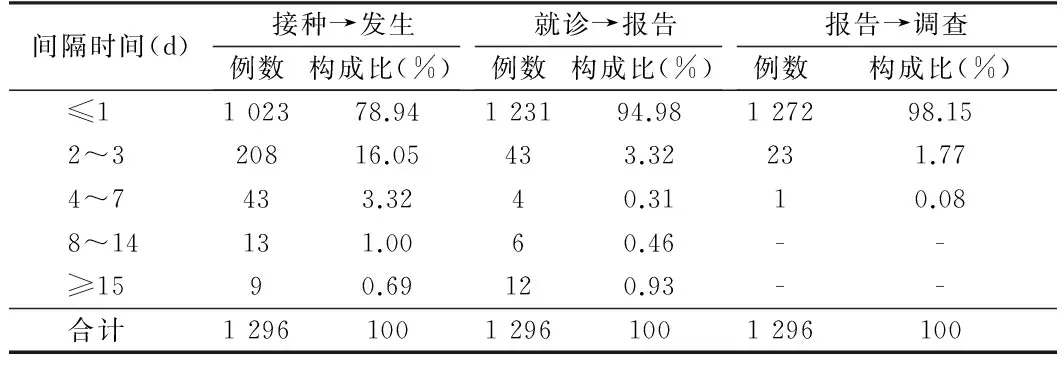
表3 河北省2009至2010年AEFI报告及时性情况
2.5 3不同类型反应发生时间间隔 不同类型反应发生在1d以内的占78.94%,2~3d的占16.05%,4~9d的占3.78%,发生>10d的占1.23%。见表4。
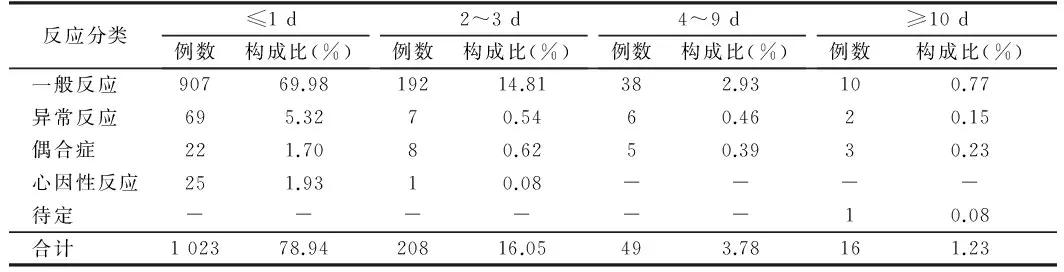
表4 河北省2009至2010年甲流AEFI不同类型发生时间间隔
2.6 AEFI临床诊断及报告发生率 在一般反应中,发热/红肿/硬结765例,报告发生率124.10/100万剂,占总数的59.03%。在异常反应中,过敏性皮疹46例,报告发生率7.46/100万剂,占总数的3.55%;过敏性紫癜和荨麻疹各9例,臂丛神经炎和热性惊厥各3例,过敏性休克和喉头水肿各2例,多发性神经炎、格林巴利综合征、脑炎和脑膜炎、血管性水肿和血小板减少性紫癜各1例,报告发生率分别为0.69/100万、0.23/100万、0.15/100万和0.08/100万。严重AEFI报告25例,发生率为4.05/100万剂,其中死亡报告发生率为0.32/100万剂。在心因性反应中,晕厥9例,发生率0.69/100万剂;癔症2例,发生率0.15/100万剂。偶合症主要为上呼吸道感染、扁桃体炎、全身不适等症状。见表5。
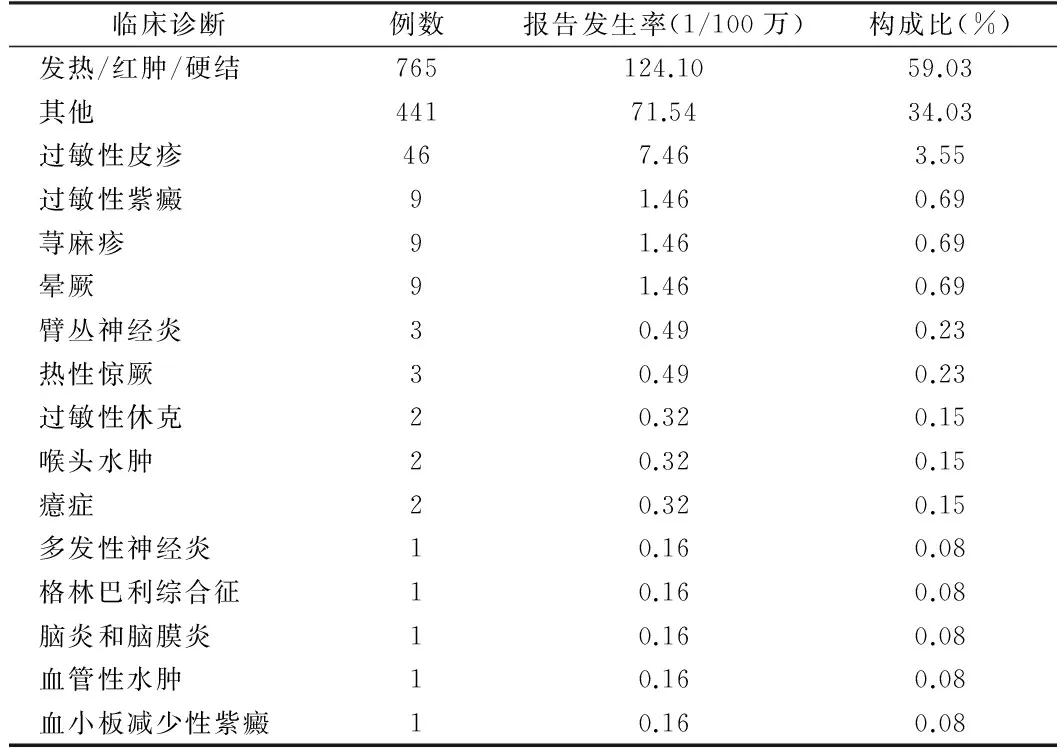
表5 河北省2009至2010年甲流AEFI报告临床诊断分布
2.7 转归及监测方式情况 1 296例AEFI报告中,41例住院,1 088例未住院治疗。最终1 250例已治愈或好转;死亡2例,均为偶合症,1例为病毒性心肌炎,1例为其他;后遗症1例异常反应为过敏性紫癜;不详43例。 被动监测方式获得856例AEFI,占65.97%,主动方式占34.03%。见图4。
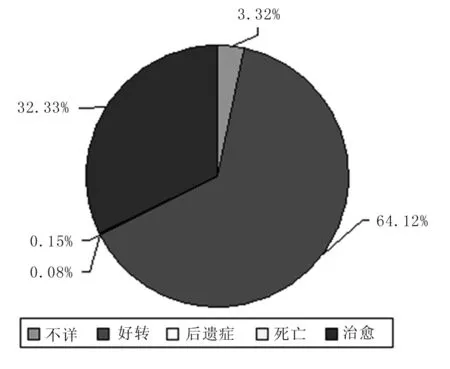
图4 河北省2009至2010年AEFI报告转归情况
3 讨论
甲型H1N1流感疫苗是新研制成功的疫苗,公众对其接种后引起的AEFI尤为关注,因此甲流疫苗上市后的安全性监测显得十分重要。我省在实施大规模甲型H1N1流感疫苗接种前组织了AEFI监测培训,统一了AEFI监测方法和要求,提高了监测的敏感性和及时性。
3.1 AEFI报告发生率及临床损害 我省搜集2009至2010年接种甲流疫苗后AEFI个案,AEFI 报告发生率为210.24/100万,高于2010年1月11日,中国卫生部公布的甲型H1N1流感疫苗AEFI累计报告发生率(11.37/10万),可能与我省AEFI监测系统较为敏感有关;以一般反应为主,报告发生率为186.06/100万,其中发热/红肿/硬结,报告发生率124.10/100万剂,各指标均低于广东省[2]甲流疫苗的AEFI的报道;其次是异常反应报告发生率为13.63/100万,接近中国卫生部公布的异常反应报告发生率(1.36/10万),严重AEFI的报告发生率高于中国卫生部公布的甲型H1N1流感疫苗严重异常反应报告发生率(0.11/10万);死亡报告发生率低于截至 2010 年 3 月 8 日,欧盟官方网站报道的数据[3](0.47/10万)。我省报告1例格林巴利综合征,发病率高于2010 年 2 月26日美国CDC发病率病死率周报(morbidity and mortality weekly report,MMWR) 报道的结果(0.08/10 万)[4],但也有研究表明接种甲流疫苗不会导致GBS发病率的增加[5],还有待于进一步研究。大规模接种无疫苗质量和预防接种实施差错事故报告,说明我省所用疫苗质量较好,预防接种服务质量良好。
3.2 AEFI流行病学特征 我省AEFI报告结果显示女性多于男性,原因可能与女性自我健康关注程度高、心理暗示性强、接种时精神较紧张等内在因素有关。病例主要是集中在青少年,考虑可能是该人群相对活跃,社交活动范围广,尤其是学生聚集在学校这种人口密集的地方,被病毒感染的机会增加。发病职业主要也是中小学生、医务人员和教师,考虑可能与该人群是甲流接种的重点人群有关,该人群又聚集于人口密集和易发生交叉感染的医院环境可能加重AEFI的发生。报告病例主要集中在沧州市,可能与该地市AEFI监测系统较敏感,且有专人负责,报告责任心强有关。报告病例主要发生在接种后的1d内,与陈恩富等[6]的报道一致;不同反应类型的发生及报告情况也符合该规律,可能与甲流疫苗是我国新研制成功,大部分人对该疫苗还持有怀疑态度,因此更加关注接种后的反应有关,并且就医方便;同时也说明我省AEFI监测系统的及时性较好。
3.3 转归情况良好,提示疫苗安全性较好 主动监测占34%,可见我省AEFI负责人主动监测及报告意识较强。
综上所述,河北省的AEFI监测系统敏感及时有效,能够发现较为罕见的异常反应。接种甲流疫苗后以一般反应为主,严重异常反应较为罕见,疫苗安全性良好。在开展大规模群体接种工作时,应严格做好接种前的体检和询问工作,掌握禁忌证,最大程度的减少AEFI的发生;做好接种后留观工作,对个别反应,及时果断处理,消除其对周围受种者可能造成的影响,防止群体癔症的发生;媒体正确引导公众,配合接种工作,及时消除公众可能存在的顾虑,使公众放心接种。
1 Afterdelays.WHO Agrees:The 2009 Pandemic Has Begun.Science,2009.324.
2 刘宇,赵占杰,彭国文,等.广东省甲型 H1N1流行性感冒疫苗疑似预防接种异常反应监测分析.中国疫苗和免疫,2011,17:362-367.
3 European Medicines Agency.Thirteenth pandemic pharmacovigilance weekly update.Accessed on March 10,2010.
4 CDC.Summary of 2009 Monovalent H1N1 Influenza Vaccinedata-Vaccine Adverse Event Reporting Systemdata through February 26,2010.Accessed on May 04,2010.
5 Black St,Eskola J,Siegrist CA,et al.Importance of background rates ofdisease in assessment of vaccine safetyduring mass immunisation with pandemic H1N1influenza vaccines.Lancet,2009,374:2115-2122.
6 陈恩富,胡昱,凌罗亚,等.甲型H1N1流感疫苗的疑似预防接种异常反应监测.浙江预防医学,2010,22:1-3.
10.3969/j.issn.1002-7386.2014.17.051
050021 石家庄市,河北省疾病预防控制中心
R 195
A
1002-7386(2014)17-2677-04
2013-12-25)
