TNF-α、Fas/FasL在子痫前期胎盘中表达的研究
2014-09-04张素萍蒋凤军周冰霞刘涛张丽红宋飞燕马潇潇张杰英
张素萍 蒋凤军 周冰霞 刘涛 张丽红 宋飞燕 马潇潇 张杰英
·论著·
TNF-α、Fas/FasL在子痫前期胎盘中表达的研究
张素萍 蒋凤军 周冰霞 刘涛 张丽红 宋飞燕 马潇潇 张杰英
目的通过联合检测正常晚期妊娠和子痫前期胎盘中TNF-α及Fas、FasL的表达,探讨子痫前期的相关病因及发病机制。方法选择剖宫产分娩的产妇80例,其中子痫前期轻度组28例,子痫前期重度组22例,正常妊娠(对照组)30例。调查3组孕产妇的孕周、新生儿体重以及胎盘重量等。胎盘娩出后30 min内取胎盘母体面中央绒毛组织固定、常规脱水石蜡包埋连续切片,常规行苏木素-伊红染色。利用免疫组化方法对切片组织行TNF-α及Fas、FasL特殊染色。结果轻度、重度子痫前期组与正常晚孕组孕妇孕周差异无统计学意义(P>0.05)。随着子痫前期病情加重,新生儿体重和胎盘重量明显降低(P<0.05)。子痫前期患者胎盘组织TNF-α的表达明显的高于对照组,差异有统计学意义(P<0.05)。在胎盘滋养细胞和底蜕膜细胞中,轻、重度子痫前期组Fas的表达明显高于对照组(P<0.05)。轻、重度子痫前期组胎盘滋养细胞、底蜕膜细胞上FasL着色较对照组组减弱(P<0.01),并且随着子痫前期的病情加重,FasL表达水平逐渐减弱。结论胎盘中TNF-α及Fas/FasL表达异常在子痫前期的发病过程中扮演着重要的角色。
子痫前期;TNF-α;Fas/Fas
子痫前期(preeclampsia,PE)是发生在妊娠过程中的一种严重并发症,发病率占2%~10%,是导致孕产妇和围生儿发病率和病死率的主要原因之一[1]。目前子痫前期的病因和发病机制不清,临床治疗缺乏有效的预防措施。研究表明,过度的炎性反应可能是导致子痫前期发病的原因之一[1]。子痫前期系统性炎性反应的一个重要特征是健康妊娠向2型辅助性T细胞(helper T cell 2,Th2)倾斜特征的缺失,而以Th1免疫占优势。与正常妊娠相比,Saito等[2]首先报到子痫前期外周血Th1细胞的比例和Th1/Th2的比率明显增加,Th2细胞比例明显减少。在另一项研究中,他们观察到子痫前期外周单核细胞产物细胞因子IL-2,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)明显增加,值得注意的是Th1细胞因子浓度和平均动脉压存在正相关性[3]。这些细胞因子诱导脂肪细胞分解,破坏肝脂肪酸氧化,影响前列腺素和一氧化氮的合成,影响血管内皮功能,从而导致子痫的发生。本研究采用免疫组织化学的方法,联合检测正常晚期妊娠和子痈前期胎盘中TNF-α及Fas、FasL的表达情况,探讨子痫前期的相关病因及发病机制。
1 资料与方法
1.1 一般资料 选择2012年1月至2012年12月我院剖宫产分娩的产妇80例,其中子痫前期轻度组28例,子痫前期重度组22例,正常妊娠(对照组)30例,均因头盆不称行剖宫产术。3组产妇均为单胎。PE的诊断标准依据全国统一教材《妇产科学》第7版。排除标准:多胎妊娠,慢性高血压,糖尿病,自身免疫性疾病,血管病,肾功能紊乱,母亲和胎儿感染和胎儿先天异常,产科并发症(前置胎盘、胎盘早剥、母儿血型不和、胎膜早破),心脏病、甲状腺功能亢进,无复发性自然流产,无吸烟、长期服用药物史。
1.2 方法
1.2.1 胎盘标本的采集及处理:胎盘娩出后30 min内取胎盘母体面中央绒毛组织1 cm×1 cm×1 cm,立即将组织置入10%中性甲醛溶液中固定24 h以上,常规脱水石蜡包埋,每个组织连续切片5张,切片厚度为5 μm。常规行苏木素-伊红染色。
1.2.2 免疫组化方法:①切5 μm 薄片,用 APES 处理过的载玻片捞片,置 58~60℃烤箱中烘烤不少于6 h使切片紧密黏附。②常规脱蜡至水:二甲苯Ⅰ10 min→二甲苯Ⅱ10 min→二甲苯Ⅲ10 min→100%乙醇Ⅰ5 min→100%乙醇Ⅱ5 min→95%乙醇5 min→75%乙醇5 min。③蒸馏水冲洗,PBS浸泡5 min。④抗原修复:将载玻片置0.01 mol/L枸橼酸盐缓冲液中水浴,pH值=6.0,保持温度(92~98℃)15 min,取出室温冷却1 h,蒸馏水冲洗,PBS洗2 min×3次。⑤3%H2O2避光孵育5~10 min,以消除内源性过氧化物酶活性。⑥PBS冲洗3 min×3次。⑦滴加10%羊血清封闭液,室温孵育30 min,倾去,勿洗。⑧分别滴加鼠抗人TNF-α单克隆抗体(1∶500,Santa Cruz,USA)、兔抗人Fas多克隆抗体(1∶250,Santa Cruz,USA)、兔抗人FasL多克隆抗体(1∶400,Santa Cruz,USA),阴性对照以PBS替代一抗,4℃过夜。⑨PBS冲洗3 min×3次。⑩分别滴加相应的二抗:兔抗鼠抗体(1∶500,KPL),羊抗兔抗体(1∶500,KPL),室温孵育30 min。PBS冲洗3 min×3次。DAB显色:1 ml双蒸水中,滴加工作液A、B、C各1滴,混匀后滴加于切片上,在显微镜下观察,显色合适立即用蒸馏水冲洗终止反应。苏木素染色1~2 min。流水冲洗5 min。梯度脱水,二甲苯透明,中性树胶封片。
1.3 结果判断 参考文献[4],免疫组化的结果以细胞膜或细胞浆内出现明显的棕黄色颗粒为阳性细胞,用PBS 代替一抗做阴性对照。所有切片均由两位观察者独立阅片。每个研究对象连取5张切片进行每个抗体染色,每张切片随机选取5个高倍视野,以Image proplus软件测得的平均灰度值代表TNF-α及Fas、FasL在胎盘的表达水平。
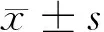
2 结果
2.1 一般资料 轻度、重度子痫前期组与对照组孕妇孕周比较,差异无统计学意义(P>0.05)。随着子痫前期病情的加重,新生儿体重和胎盘重量明显降低,与对照组相比,重度子痫前期新生儿体重改变有统计学意义(P< 0.05);与对照组相比,重度子痫前期胎盘重量也有明显改变(P<0.05)。见表1。
表1子痫前期患者与对照组临床一般特征比较

组别年龄(岁)孕周(周)新生儿体重(g)胎盘重量(g)轻度子痫前期(n=28)26.9±2.837.5±0.63610±252698±50重度子痫前期(n=22)27.7±3.036.4±0.4 3004±237* 616±41*对照组(n=30)26.5±2.938.2±0.63753±271707±47
注:与对照组比较,*P<0.05
2.2 苏木素-伊红染色结果 子痫前期患者(包括轻度和重度)与对照组相比,胎盘常规的苏木素-伊红染色结果提示组织形态没有明显的改变,细胞排列整齐,无明显炎性细胞浸润等。见图1。

图1 胎盘组织染色(HE×100)
2.3 TNF在胎盘、底蜕膜组织的免疫组化检测结果 对照组中TNF-α阳性细胞,主要位于绒毛小叶的合体滋养细胞及蜕膜细胞,胎盘绒毛血管内皮细胞也有少量表达,主要在细胞质和/或细胞膜。子痫前期胎盘组织中TNF-α的阳性细胞分布与对照组相似,但子痫前期组阳性细胞数量明显增多,染色增强。子痫前期患者胎盘组织TNF-α的表达明显的高于对照组,差异有显著性(P<0.05或<0.01)。见表2、图2。
表2子痫前期患者与对照组免疫组化结果

组别TNF-α轻度子痫前期(n=28)103±9*△重度子痫前期(n=22)176±6# 对照组(n=30)59±8
注:与对照组比较,*P<0.05,#P<0.01;与重度子痫前期比较,△P<0.05

图2 胎盘中TNF-α免疫活性(免疫组化×200)
2.4 Fas、FasL在胎盘、底蜕膜组织的免疫组化检测结果 Fas、FasL在胎盘组织的表达定位:Fas、FasL均主要表达于三组胎盘绒毛滋养细胞(包括细胞滋养细胞和合体滋养细胞),部位定位在胞浆及胞膜中,其中细胞膜上表达明显强于细胞浆中, 蜕膜、绒毛血管及间质阴性或表达较弱。Fas在重度子痫前期组为强阳性表达,在轻度子痈前期组为阳性表达,在对照组为弱阳性表达。FasL在重度子痫前期组为弱阳性表达,在轻度子痫前期组为阳性表达,在对照组为强阳性表达。在胎盘滋养细胞和底蜕膜细胞中,轻、重度子痫前期组Fas的表达明显高于对照组,差异有统计学意义(P<0.05)。轻度子痫前期组胎盘滋养细胞、底蜕膜细胞上FasL着色较对照组减弱,差异有统计学意义(P<0.05或<0.01)。见图3、4,表3。

图3 胎盘中Fas免疫活性(免疫组化×200)

图4 胎盘中FasL免疫活性(免疫组化×200)
3 讨论
在引起孕产妇及围产儿发病和死亡的疾病当中,妊娠期高血压因其能引起孕产妇和新生儿病死率和发病率上升而备受关注,同时妊娠期高血压的发病原因和发病机制目前尚未完全清楚。
表3子痫前期患者与对照组免疫组化检测结果

组别FasFasL轻度子痫前期(n=28)210±20*167±20*重度子痫前期(n=22)263±27*129±20#对照组(n=30)122±8 373±35
注:与对照组比较,*P<0.05,#P<0.01
TNF-α是一种主要由活化的巨噬细胞分泌的多肽细胞因子,尽管在某些刺激下别的细胞如T细胞、NK细胞、肥大细胞、平滑肌细胞、成纤维细胞及淋巴细胞等也可合成和分泌[5]。TNF-α的生物学功能广泛,是一种重要的炎性介质和免疫调节因子,参与了体内许多疾病的病理生理过程,与相关跨膜受体(TNF-R)结合后,TNF-α可对人和鼠类等发挥抑制细胞生长和细胞毒性作用[6,7]。TNF-α与受体结合诱导细胞表面受体三聚作用并且在TNF-R胞质尾区形成死亡诱导信号复合(death-inducing signalling complex,DISC),导致Caspase-8的激活和细胞凋亡[8]。除了TNF-α以外,FasL与其受体Fas结合后也可刺激DISC形成并且诱导细胞凋亡[9]。尽管胎盘对母体免疫系统而言是半异体移植体,母体对胎儿却表现为免疫耐受而不是免疫排斥[10]。胎盘是母体-胎儿的一个主要部分,对绒毛结构的维护扮演着重要的免疫抑制角色。当在复杂的子痫前期和胎儿宫内生长受限母体-胎儿免疫交互作用成为病态的时候,胎盘内可以观察到凋亡的发生[11,12]。Fas/FasL系统是诱导细胞和组织凋亡的一个重要的途径[13]。尽管Fas存在于休止细胞的表面一般为低水平,但是淋巴细胞被激活后它的表达增强[14]。妊娠时异体抗原促使母体T林巴细胞激活Th1细胞大量表达Fas,与其配体FasL结合,使Th1细胞凋亡,具有胚胎毒性作用的功能下降,利于胎儿生长发育的Th2细胞功能增强。FasL促进激活的表达Fas的淋巴细胞凋亡并且被认为在眼球,睾丸支持细胞和胎盘中具有免疫豁免[15-17]。如果被异体抗原刺激而大量激活的Th1细胞不能通过Fas/FasL系统诱导的细胞凋亡即为Fas/FasL介导的机制失调。
单核巨噬细胞产生的蛋白TNF-α,其生物学功能比较广泛,参与肿瘤的调节,以及在免疫系统和炎性反应等方面发挥重要的功能,是一种非常重要的细胞因子。TNF-α可直接释放进入血液循环,也可以通过旁分泌和自分泌方式在体内局部发挥作用,可能是妊娠高血压综合征发病机制中的一个重要环节[18]。子痫前期患者血中TNF-α浓度上升,这种浓度的上升可出现在临床症状开始之前,在一定程度上与血管内皮细胞的损害表现为正相关的关系,可直接损伤血管内皮细胞,导致血管内重要的收/缩物质合成比例以及炎性因子发生改变,引起体内的小动脉发生改变从而导致子痫前期的发生。子痫前期患者胎盘滋养细胞的凋亡也和TNF-α增加存在相关性,也就是说胎盘滋养细胞的凋亡率依赖体内TNF-α浓度的变化。在正常人体内TNF-α的产生是由单核细胞(MCP-1)被单核细胞趋化蛋白激活后成为巨噬细胞分泌的,反过来过多的TNF-α则可抑制单核细胞调节机体正常免疫功能,可能与子痫前期的免疫机制有一定的关系[19]。本研究表明,子痫前期组TNF-α蛋白的阳性表达率明显高于对照组,重度组高于轻度组,随着病情的加重表达量明显增加,因为TNF-α蛋白过多产生会影响滋养细胞的增生和血管的重建,引起胎盘缺血缺氧以及功能障碍,最终导致子痫前期。
Fas的氨基酸构成包括三个部分,即胞膜外区、跨膜区和胞浆区,值得注意的是胞浆区,其氨基酸序列由68个氨基酸残基构成死亡结构域,此氨基酸序列在Fas介导的细胞凋亡中发挥着关键的作用。Fas蛋白包括两种形式,膜结合型(mFas)和可溶型(sFas),膜结合型是主要的存在形式。也可通过转录水平的不同拼接产生sFas,sFas对mFas诱导的凋亡有抑制作用,在细胞凋亡中起调节作用。Fas广泛存在于体内各处细胞当中,包括胎盘滋养层细胞,卵巢的上皮细胞,胸腺细胞,T淋巴细胞,B淋巴细胞、NK细胞等[20]。
FasL也分为胞外区、跨膜区和胞内区3个部分。FasL的分布范围比较包括T淋巴细胞、NK细胞、胎盘中的滋养细胞、以及一些免疫豁免部位的细胞(睾丸、角膜等部位)。FasL包括两种存在形式,即膜结合型(mFasL)和可溶型(sFasL),细胞膜中的金属蛋白激酶作用于FasL后发生复杂的化学变化变为sFasL,其在人体内外可发生广泛的生物学功能,当Fas与其天然配体FasL结合后,可以向细胞内传递“死亡信号”,诱导Fas所在的靶细胞凋亡,Fas-FasL相互作用是机体维持自身稳定,保持内环境平衡的一条重要途径[21]。
Fas及Fas配体是目前唯一的通过免疫途径介导细胞凋亡的蛋白分子,他们的发现对细胞凋亡的研究起了很大的促进作用。目前的研究结果表明,在一些人体内的免疫豁免部位如睾丸、角膜等处,是很少会发生免疫反应或者很少对免疫反应的攻击发生应答,这可能就是因为这些免疫豁免部位的组织细胞FasL表达较高的缘故,FasL的过度表达能使淋巴细胞(主要是T淋巴细胞)发生凋亡作用。胎盘不会引起母体的排斥反应,很可能也是因为FasL表达较高的缘故与。胎盘和底蜕膜是胎儿与母体紧密接触的连接部位,而胎盘中的滋养层细胞中包括胎儿的一些抗原物质,与胎儿紧密相关[22]。
妊娠期高血压疾病中免疫细胞因子的改变是非常重要的研究方向,免疫细胞因子在人体的免疫应答和炎症进程以及胚胎的孕育过程中扮演着重要的角色。有许多的研究显示出表达FasL的滋养细胞对胚胎发挥者一定的保护作用。胚胎抗原在进入到妊娠母体后,T淋巴细胞在激活后产生Fas过量表达,而滋养细胞中的Fas配体即FasL将和T淋巴细胞激活后产生的大量Fas结合,引起激活的T淋巴细胞发生凋亡,胚胎进一步发生特异性的免疫耐受作用[23]。对于Fas/FasL系统的深入认识发现,特异性的免疫耐受作用可能在子痫前期的病理改变过程中扮演着重要的作用。
本实验研究应用免疫组织化学方法对正常孕妇及子痫前期患者胎盘的中Fas蛋白的表达进行了探索研究,结果表明子痫前期组患者胎盘中Fas蛋白的表达强度要显著高于对照组,正常胎盘组与轻度子痫前期胎盘组及重度子痫前期胎盘组有显著性差异。子痫前期患者的胎盘中FasL表达要明显低于对照组。妊娠期高血压疾病可能是胎盘部位中的细胞FasL表达较低,从而使Fas阳性细胞凋亡程度下降,进一步导致增强的免疫应答反应损害了胎盘和机体的免疫系统,引起子痫前期的病理进程。T淋巴细胞大量激活使胎盘和患者子宫之间的免疫豁免作用破坏导致病理改变的发生,和母-胎免疫耐受机制破坏引起机体对胎盘发生免疫排斥反应。同时,子痫前期患者胎盘细胞中Fas的过量表达,使其在与FasL结合后引起凋亡的蜕膜细胞数量增加,引起胎盘组织的发育过程受损,表现为胎盘滋养细胞侵蚀能力发生改变,胎盘发育受限,使得胎盘着床过程改变以及发生血管重铸进程改变,从而引起子痫前期病理进程的改变。在人胎盘滋养细胞和母体淋巴细胞之间有两个潜在的交互作用点[24]。第一是绒毛间隙,有漂动的绒毛细胞,基质细胞核的外围由内层的细胞滋养层和外部的合体细胞滋养层,位于母体血液中。 第二是固定绒毛的绒毛外细胞滋养层细胞高度侵袭胎盘床,作为中间滋养层,侵袭蜕膜及子宫肌层。滋养层的Fas/FasL系统位于这些交互作用点上,在维护妊娠上可能起着重要作用。Runic等[25]证实FasL存在与人前3个月的胎盘滋养细胞中并且足月胎盘合体表达最显著。
综上所述,这种诱导凋亡的平衡机制若一旦发生改变,就会引起胎盘发生一系列的连锁反应,特别是免疫反应的改变,使患者进展为子痫前期或者子痫。胎盘中细胞Fas/FasL系统的平衡是一个值得关注的问题,平衡进程破坏可能导致胎盘中一些细胞凋亡增加。Fas/FasL系统以及细胞因子TNF-α的变化在子痫前期的病理进程中扮演着重要的作用,应引起我们的高度重视。
1 Saito S,Shiozaki A,Nakashima A,et al.The role of the immune system in preeclampsia.Mol Aspects Med,2007,28: 192-209.
2 Saito S,Sakai M,Sasaki Y,et al.Quantitative analysis of peripheral blood Th0,Th1,Th2 and the Th1:Th2 cell ratioduring normal human pregnancy and preeclampsia.Clin Exp Immunol,1999,117: 550-555.
3 Saito S,Umekage H,Sakamoto Y,et al.Increased T-helper-1-type immunity anddecreased T-helper-2-type immunity in patients with preeclampsia.Am J Reprod Immunol,1999,41:297-306.
4 Jiang JD,Ma ZM,Liu YS.Expression of aquaporin-4 protein in rats with acute radiation-induced cerebral edema.Zhong Nanda Xue Xue Bao Yi Xue Ban,2008,33:252-256.
5 Beyaert R,Fiers W.Molecular mechanisms of tumor necrosis factorinduced cytotoxicity.What wedo understand and what wedo not.FEBS Lett,1994,340:9-16.
6 Fransen L,Vander Heyden J,Ruysschaert R,et al.Recombinant tumor necrosis factor: its effect and its synergism with interferon-gamma on a variety of normal and transformed human cell lines.Eur J Cancer Clin Oncol,1986,22: 419-426.
7 Ruff MR,Gifford GE.Rabbit tumor necrosis factor: mechanism of action.Infect Immun,1981,31: 380-385.
8 Sheikh MS,Huang Y.Death receptor activation complexes: it takes two to activate TNF receptor 1.Cell Cycle,2003,2: 550-552.
9 Houston A,O’Connell J.The Fas signalling pathway and its role in the pathogenesis of cancer.Current Opinion in Pharmacology,2004,4: 321-326.
10 Chaouat G.Immunology of pregnancy.In: Chaouat G,ed.Immunology of Reproduction.CRC Press Inc,1993,30:1-17.
11 DiFederico E,Genbacev O,Fisher SJ.Preeclampsia is associated with widespread apoptosis of placental cytotrophoblasts within the uterine wall.Am J Pathol,1999,155:293-301.
12 Smith SC,Baker PN,Symonds EM.Increased placental apoptosis in intrauterine growth restriction.Am J Obstet Gynecol,1997,177:1395-1401.
13 Nagata S.Fas and Fas ligand: adeath factor and its receptor.AdvImmunol,1994,57:129-144.
14 Nagata S,Golstein P.The Fasdeath factor.Science,1995,267:1449-1456.
15 Griffith TS,Brunner T,Fletcher SM,et al.Fas ligand-induced apoptosis as a mechanism of immune privilege.Science,1995,270:1189-1192.
16 Bellgraud,Goldd,Selawry H,et al.A role for CD95 ligand in preventing graft rejection.Nature,1995,377:630-632.
17 Bamberger AM,Schulte HM,Thuneke I,et al.Expression of the apoptosis-inducing Fas ligand (FasL) in human first and third trimester placenta and choriocarcinoma cells.J Clin Endocrinol Metab,1997,82:3173-3175.
18 Sunderland NS,Thomson SE,Heffernan SJ,et al.Tumor necrosis factor α induces a model of preeclampsia in pregnant baboons (Papio hamadryas).Cytokine,2011,17:198-206.
19 Serin IS,Ozelik B,Basbug M,et al.Predictive value of tumor necrosis factor alpha (TNF-alpha) in preeclampsia.Eur J Obstet Gynecol Reprod Biol,2002,100:143-145.
20 Walsh K,Smith RC,Kim HS.Vascular cell apoptosis in remodeling,restenosis,and plaque rupture.Circ Res,2000,87:184-188.
21 Walczak H,Krammer PH.The CD95 (APO-1/Fas) and the TRAIL (APO-2L) apoptosis systems.Exp Cell Res,2000,256:58-66.
22 Kauma SW,Huff TF,Hayes N,et al.Placental Fas ligand expression is a mechanism for maternal immune tolerance to the fetus.J Clin Endocrinol Metab,1999;84: 2188-2194.
23 Makrigiannakis A,Zoumakis E,Kalantaridou S,et al.Corticotropinre-leasing hormone promotes blastocyst implantation and early maternal tolerance.Nat Immunol,2001,2:1018-1024.
24 Guller S,LaChapelle L.The role of placental Fas ligand in maintaining immune privilege at maternal-fetal interfaces.Semin Reprod Endocrinol,1999,17:39-44.
25 Runic R,Lockwood CJ,Ma Y,et al.Expression of Fas ligand by human cytotrophoblasts: Implications in placentation and fetal survival.J Clin Endocrinol Metab,1996,81:3119-3122.
ThestudyontheexpressionofTNF-αandFas/FasLinplacentaofpatientswithpre-eclampsia
ZHANGSuping*,JIANGFengjun,ZHOUBingxia,etal*.XinjiMiningDistrictHospitalofNorthernChinaOilFieldGeneralHospital,Hebei,Xinji052360,China
ObjectiveTo observe the expression of TNF-αand Fas/FasL in placenta of patients with pre-eclampsia and normal late pregnancy women,and to explore related cause ofdisease and pathogenesis of pre-eclampsia.MethodsEighty puerperas who underwent cesarean section including 28 cases mild pre-eclampsia (mild pre-eclampsia group),22 cases of severe pre-eclampsia (severe pre-eclampsia group ),30 cases of normal pregnancy (control group ) were enrolled in the study.The gestational weeks,neonate’s weight and placental weight weredetected for three groups.The placenta specimens within 30min after placental expulsion were collected and fixed in 10% neutral formaldehyde for 24h for serial section,then stained with HE.The expression of TNF-αand Fas/FasL in placenta specimens wasdetected by immunohistochemistry.ResultsThere were no significantdifferences in the gestational weeks among mild pre-eclampsia group,severe pre-eclampsia group,control group (P>0.05).The neonate’s weight and placental weight weredecreased with the aggravation of pathogenetic condition of pre-eclampsia (P<0.05).The expression levels of TNF-α in placenta tissue of patients with pre-eclampsia were significantly higher than those of control group (P<0.05).The expression levels of Fas in placenta trophocyte anddeciduas basalis cells of patients with mild and severe pre-eclampsia were significantly higher than those in control group (P<0.05).The coloring of FasL in placenta trophocyte anddecidua basalis cells of patients with mild and severe pre-eclampsia was attenuated,as compared with that in control group (P<0.01),moreover,the expression levels of FasL were furtherdecreased with the aggravation of pathogenetic condition of pre-eclampsia.ConclusionThe abnormal expression of TNF-αand Fas/FasL in placenta may play an important role in the pathogenesis of pre-eclampsia.
pre-eclampsia ;TNF-α;Fas/FasL
10.3969/j.issn.1002-7386.2014.17.004
项目来源:中国石油华北油田公司科技处科研项目(编号:2013-HB-G-17-4)
052360 河北省辛集市,华北油田公司总医院辛集矿区医院(张素萍、刘涛、张丽红、宋飞燕);华北油田公司总医院(蒋凤军、周冰霞、马潇潇);河北医科大学第二医院(张杰英)
张杰英,050000 河北医科大学第二医院;
E-mail:504632206@qq.com
R 714.24+5
A
1002-7386(2014)17-2574-05
2014-02-11)
