猪肺炎支原体巢式PCR诊断方法的建立及应用
2014-09-02张淑云
吉 玛,娘 洛,张淑云
(青海省果洛州班玛县动物疫病预防控制中心,青海 果洛 814300)
猪肺炎支原体巢式PCR诊断方法的建立及应用
吉 玛,娘 洛,张淑云
(青海省果洛州班玛县动物疫病预防控制中心,青海 果洛 814300)
为建立一种快速诊断猪肺炎支原体病原的方法,根据GenBank上登录的Mhp基因组序列,在保守区基因内部设计合成2对引物,经过PCR反应条件的优化,建立了检测猪肺炎支原体的巢式PCR方法。结果表明,该方法对鸡毒支原体、猪鼻支原体、猪传染性胸膜肺炎放线杆菌、猪圆环病毒2型、猪伪狂犬病毒的扩增结果均为阴性;第1次扩增的敏感性是10 pg,第2次扩增的敏感性是0.1 pg,第2次比第1次扩增的敏感性高100倍。巢式PCR检测方法具有特异性强、敏感性高、重复性好等优点,可以在短时间内准确快速的检测出低含量的Mhp病原,为猪肺炎支原体的快速诊断与净化奠定基础。
猪肺炎支原体;巢式PCR;诊断
猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)是引起猪支原体肺炎(MycoplasmaPneumoniaeofswine,MPS)俗称猪气喘病的主要致病原,感染猪常表现为猪呼吸道病综合征(Porcine Respiratory Disease Complex,PRDC)[1]。猪气喘病具有高度传染性,虽死亡率不高,但发病率极高,感染猪主要表现为咳嗽并伴有呼吸困难、肺组织病变或大理石样病变等临床症状和病理变化[2-3]。该病可引起猪的生长受阻,导致饲料转化率大幅下降,猪生产性能降低。目前呈全球性流行与分布,其高发病率给养猪业造成了巨大的经济损失[4-7]。鉴于此,迫切需要加强对本病病原、流行病学、疫苗和诊断方法的深入研究,PCR诊断方法具有操作简单、特异性强、灵敏度高、可以检测早期感染等优点,为猪肺炎支原体的诊断提供了新的模式。张红云等[8]和朱凤琼等[9]先后分别建立了检测猪肺炎支原体的PCR方法,并进行了临床样品的应用检测,取得较好的效果,但其灵敏度依然有限。巢式PCR是在常规PCR结束后,以第一轮PCR扩增产物为模板进行第二轮PCR扩增,故其敏感性更高,适合对病毒含量很低时的样品进行鉴定。本研究将巢式PCR诊断技术应用到Mhp的检测中,建立了一种简单、快速、敏感、特异的Mhp巢式PCR分子生物学方法,从而实现Mhp的快速诊断与检测。
1 材料与方法
1.1 材 料
1.1.1 菌株、毒株与载体 Mhp、鸡毒支原体(MG)、猪鼻支原体(Mhr)、猪传染性胸膜肺炎放线杆菌(App)、大肠杆菌DH5α和BL21(DE3)菌株、猪圆环病毒2型(PCV-2)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)均由青海省海西州动物疫病控制中心实验室保存;克隆载体pMD18-T为大连宝生物工程有限公司产品。
1.1.2 试验试剂 Taq PCR 扩增聚合酶、EcoRI与HindIII限制性内切酶、T4 DNA连接酶为大连宝生物工程有限公司产品;细菌基因组DNA提取试剂盒、病毒基因组RNA提取试剂盒、病毒基因组DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒,购自北京百泰克生物技术有限公司。
1.2 方 法
1.2.1 基因组DNA/RNA的提取 分别用细菌基因组DNA提取试剂盒、病毒基因组DNA提取试剂盒提取Mhp、MG、Mhr、App、PCV-2、PRV的基因组DNA;用病毒基因组RNA提取试剂盒提取PRRSV RNA,并将其合成cDNA。所有DNA与cDNA均-70 ℃保存备用。
1.2.2 引物的设计与合成 根据已发表的Mhp基因组序列,选取P36基因保守区序列设计合成两对特异性检测引物,由生工生物工程(上海)股份有限公司合成。

表1 引物序列Table 1 Sequence of primer
1.2.3 巢式PCR反应条件的优化 在保持其它反应条件不变的前提下,分别以不同的模板用量(1、3、5、7、10 μL)进行PCR扩增反应,确定最适的模板用量;在保持其它反应条件不变的前提下,分别以不同的引物用量(0.2、0.6、1.0、1.4、1.8 μL)进行PCR扩增反应,确定最适的引物用量;在保持其它反应条件不变的前提下,分别以不同的退火温度(48 、50 、52 、54 、56 ℃)进行PCR扩增反应,确定最适的退火温度。
1.2.4 PCR扩增产物的检测与鉴定 取5 μL PCR扩增产物经琼脂糖凝胶电泳和凝胶成像扫描系统进行扩增片段的有无及大小的初步鉴定。将初步鉴定正确的特异性条带用胶回收试剂盒回收,克隆至pMD18-T克隆载体,质粒提取试剂盒抽提质粒DNA,经EcoRI/HindIII双酶切鉴定,将正确的阳性克隆质粒送生工生物工程(上海)股份有限公司测序,以判断PCR扩增产物的准确性。
1.2.5 特异性检测 分别以提取的猪Mhp、MG、Mhr、App、PCV-2、PRV的基因组DNA、PRRSV cDNA为模板,用已优化确定的最佳条件进行第一轮检测。分别以第一轮PCR扩增产物为模板,利用已优化确定的最佳条件进行第二轮PCR扩增,确定巢式PCR检测方法的特异性。
1.2.6 敏感性检测 将提取的猪肺炎支原体基因组DNA依次适当稀释,使其含量分别为1 μg 、0.1 μg、10 pg、1 pg、0.1 pg、0.01 pg DNA,分别以其为模板进行PCR扩增,确定巢式PCR检测方法的敏感性。
1.2.7 重复性检测 用本研究建立的巢式PCR检测方法分别对MG、Mhr、App、PCV-2、PRV、PRRSV、3份Mhp阳性病料和3份Mhp阴性病料重复检测3次,确定巢式PCR检测方法的稳定性和重复性。
1.2.8 临床样品应用检测 利用建立的Mhp巢式PCR诊断方法检测临床疑似Mhp感染的病料共计26份,以验证本巢式PCR诊断方法的临床实用性。同时对部分阳性PCR扩增产物进行克隆和序列测定,以验证本诊断方法的准确性和可靠性。
2 结果与分析
2.1 PCR最佳扩增反应的确定
根据PCR优化试验确定最佳模板含量为0.1 μg,最佳引物含量为10 μmol,最佳退火温度为58℃。确定第一轮PCR反应体系为:5 μL 10×Taq Buffer、4 μL dNTP(2.5 mmol/L)、0.5 μL Taq、上下游引物P1、P2 (20 μmol/μL)各0.5 μL、DNA0.1 μg、加水至50 μL。确定第一轮PCR扩增参数为:95 ℃ 4 min;94 ℃ 40s,52 ℃ 40s,72 ℃ 40 s,30个循环;72 ℃ 10 min。确定第二轮RT-PCR反应体系为:5 μL 10×Taq Buffer、4 μL dNTP(2.5 mmol/L)、0.5 μL Ex Taq、上下游引物P3、P4(20 μmol/μL) 各0.5 μL、模板(第一轮PCR扩增产物)0.5 μL、加水至50 μL。确定第二轮PCR扩增参数为:95 ℃ 4 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
2.2 PCR扩增产物的检测与鉴定
如图1所示,第一轮PCR扩增产物在位于766 bp处、第二轮PCR扩增产物在位于554 bp处均可见明显的特异性DNA扩增条带,与试验设计预期大小相一致。如图2所示,二轮PCR扩增产物分别连接到PMD18-T克隆载体上构建的克隆质粒经EcoRI和HindIII双酶切后分别得到预期的766 bp、554 bp的特异性条带,与理论的设计相一致。生工生物工程(上海)股份有限公司的测序结果表明,插入到PMD18-T克隆载体中的基因片段核苷酸序列均为Mhp P36基因序列。表明PCR扩增产物为特异性Mhp序列,建立的猪肺炎支原体巢式PCR诊断方法具有极高的准确性。
2.3 特异性检测试验结果
如图3、4所示,用建立的巢式PCR诊断方法检测Mhp、MG、Mhr、App、PCV-2、PRV、PRRSV的结果显示,第一轮和第二轮PCR都只能对猪肺炎支原体扩增出大小与预期相符的特异性片段,而对其它菌、毒株均未扩增出目的片段,表明该巢式PCR检测方法具有良好的特异性。

图1 PCR扩增结果Fig.1 The products amplified with the two primersM.DNA标准DL 2000;1.第1轮扩增的PCR产物;2.第2轮扩增的PCR产物;3.4.空白对照M.DNA Marker DL 2000;1.The first round primer amplification product;2.The second round primer amplification product;3,4.Blank controls.

图2 克隆载体的双酶切鉴定Fig.2 Identification of cloning vectorM.DNA标准DL 2000;1.第1轮扩增产物克隆载体的EcoRI and HindIII双酶切;2.第2轮扩增产物克隆载体的EcoRI and HindIII双酶切M.DNA Marker DL 2000;1.The first round amplification product cloning into T vectors digested with EcoRI/HindIII;2.The second round amplification product cloning into T vectors digested with EcoRI/HindIII.
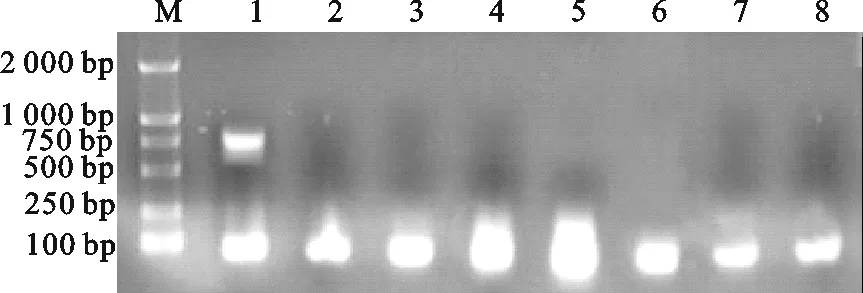
图3 第一轮特异性试验结果Fig.3 The first round amplification specificity testM.DNA标准DL 2000;1.Mhp;2.MG;3.Mhr;4.App;5.PCV-2;6.PRV;7.PRRSV;8.对照M.DNA Marker DL 2000;1.Mhp;2.MG;3.Mhr;4.App;5.PCV-2;6.PRV;7.PRRSV;8.Control

图4 第二轮特异性试验结果Fig.4 The second round amplification specificity testM.DNA标准DL 2000;1.Mhp;2.MG;3.Mhr;4.App;5.PCV-2;6.PRV;7.PRRSV;8.对照M.DNA Marker DL 2000;1.Mhp;2.MG;3.Mhr;4.App;5.PCV-2;6.PRV;7.PRRSV;8.Control
2.4 敏感性检测试验结果
如图5、6所示,建立的巢式PCR诊断方法检测不同梯度的模板含量显示,第一轮PCR检测的灵敏度可以达到10 pg DNA含量,而第二轮PCR检测的灵敏度可以达到0.1 pg DNA含量,表明该巢式PCR检测方法具有良好的敏感性。

图5 第一轮扩增的敏感性试验Fig.5 The first round amplification sensitive testM.DNA标准DL 2 000;1.1 μgDNA;2.0.1 μgDNA;3.10 pgDNA;4.1 pgDNA;5.0.1 pgDNA;6.0.01 pgDNA;7.对照M.DNA Marker DL 2 000;1.1 μgDNA;2.0.1 μgDNA;3.10 pgDNA ;4.1 pgDNA;5.0.1 pgDNA;6.0.01 pgDNA;7.Control

图6 第二轮扩增的敏感性试验Fig.6 The second round amplification sensitive testM.DNA标准DL 2 000;1.1 μgDNA;2.0.1 μgDNA;3.10 pgDNA;4.1 pgDNA;5.0.1 pgDNA;6.0.01 pgDNA;7.对照M.DNA Marker DL 2 000;1.1 μgDNA;2.0.1 μgDNA;3.10 pgDNA;4.1 pgDNA;5.0.1 pgDNA;6.0.01 pgDNA;7.Control
2.5 重复性检测试验结果
用本研究建立的巢式PCR方法重复检测MG、Mhr、App、PCV-2、PRV、PRRSV、3份Mhp阳性病料和3份Mhp阴性病料,结果完全一致,巢式PCR检测方法具有良好的稳定性和重复性。
2.6 临床应用检测试验结果
利用建立的Mhp巢式PCR诊断方法共检测了26份临床疑似Mhp感染的病料,检出阳性病料样品15份,随机选取10份阳性样品PCR产物进行克隆与序列测定,结果显示10份阳性产物均为Mhp,表明建立的Mhp巢式PCR诊断方法能够准确、可靠的检测Mhp感染,具有良好的临床实用价值。
3 讨 论
鉴于Mhp对规模化养殖场的极大危害,因此需加强对该病原的快速、准确诊断。由于Mhp的生长条件十分苛刻,在一般培养基中较难生长,且培养耗时较长、培养菌液的滴度较低[10],通常情况下分离培养诊断并不可行,所以细菌的分离培养与鉴定方法不适合本病的快速诊断。PCR技术可以特异性的检测菌种的核酸,具有极高的准确性,且PCR方法特异性强、灵敏度高、可以检测早期感染,具有常规诊断方法无法比拟的优势。P36基因为一种乳酸脱氢酶蛋白(LDH),具有种族特异性的抗原决定区域,可以诱导早期免疫反应,且P36基因在Mhp进化过程中高度保守,具有高度保守性,适合用于对Mhp的诊断与检测[11-12]。刘茂军等[8]和张红云等[13]根据P36基因的核苷酸序列建立了检测Mhp的常规PCR方法,但敏感性有限。巢式PCR在PCR基础上建立的,敏感性更高,特异性更强。当送检样品含量很低时也可以特异检出病原。
本研究根据GenBank上登录的Mhp基因组P36基因序列,设计合成2对引物,经过PCR反应条件的优化,建立了检测Mhp的巢式PCR方法。该检测对MG、Mhr、App、PCV-2、PRV的扩增结果均为阴性;该方法第1次扩增的敏感性是10 pg,第2次扩增的敏感性是0.1 pg,第2次比第1次扩增的敏感性高100倍;该方法重复检测MG、Mhr、App、PCV-2、PRV、PRRSV、3份猪肺炎支原体阳性病料和3份猪肺炎支原体阴性病料的结果完全一致。因巢式PCR方法的敏感性要比普通PCR方法高很多,其敏感性可与荧光定量PCR方法相当,但所用仪器与试剂只是普通的PCR仪器与试剂,不需要荧光定量PCR方法要求的特殊仪器设备与试剂。由于巢式PCR方法极高的敏感性,故在试验过程中容易出现假阳性,应特别注意避免污染问题,并设立阴性对照加以控制。本研究建立的Mhp巢式PCR诊断方法具有良好的准确性、特异性、敏感性、重复性、稳定性和临床实用性,可以在短时间内快速的检测出低含量的Mhp,为本病的快速检测及早期发现和治疗奠定了基础。
[1]Nathues H,Woeste H,Doehring S,et al.Detection of Mycoplasma hyopneumoniae in nasal swabs sampled from pig farmers[J].Vet Rec,2012,170(24):623.
[2]Potter M L,Kane E M,Bergstrom J R,et al.Effects of diet source and vaccination for porcine circovirustype 2 and Mycoplasma hyopneumoniae on nursery pig performance[J].J Anim Sci,2012,90(11):4 063-4 071.
[3]张 悦,刘茂军,邵国青.猪肺炎支原体主要抗原蛋白的研究进展[J].中国农学通报,2013,29(2):16-22.
[4]Savic B,Ivetic V,Milicevic V,et al.Genetic diversity of Mycoplasma hyopneumoniae isolates from conventional farrow-to-finish pig farms in Serbia[J].Acta Vet Hung,2010,58(3):297-308.
[5]Halli O,Ala-Kurikka E,Nokireki T,et al.Prevalence of and risk factors associated with viral and bacterial pathogens in farmed European wild boar[J].Vet J,2012,194(1):98-101.
[6]Kukushkin S,Okovytaya T.Seroprevalence of Lawsonia intracellularis,Mycoplasma hyopneumoniae and PCV2 in commercial pig farms in Russia[J].Vet Rec,2012,171(5):126.
[7]王娟萍,姚敬明,吴 忻,等.3种猪肺炎支原体疫苗对仔猪的免疫试验[J].中国兽医杂志,2012,48(5):45-46.
[8]张红云,梁晶晶,李回,等.猪肺炎支原体PCR检测方法的建立及初步临床应用[J].广西农业科学,2010,41(3): 256-257.
[9]朱凤琼,陈达燕,杨林富,等.猪肺炎支原体PCR检测方法的建立研究[J].现代农业科技,2012,(03):319-321.
[10]韦艳娜,白昀,孔猛,等.猪肺炎支原体的分离方法[J].江苏农业学报,2012,28(1): 104-107.
[11]Caron J,Ouardani M,Dea S.Diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis infections in pigs by PCR amplification of the p36 and p46 genes[J].J Clin Microbiol,2000,38(4):1 390-1 396.
[12]Zou H Y,Liu X J,Ma F Y,et al.Attenuated Actinobacillus pleuropneumoniae as a bacterial vector for expression of Mycoplasma hyopneumoniae P36 gene[J].J Gene Med,2011,13(4):221-229.
[13]刘茂军,李冬梅,邵国青,等.猪肺炎支原体PCR鉴定方法的建立[J].金陵科技学院学报,2008,24(3): 99-101.
EstablishmentandApplicationofMycoplasmahyopneumoniaeNestedPCRDiagnosisMethod
JI Ma,NIANG Luo,ZHANG Shu-yun
(AnimalDiseaseControlCenter,GuoluoBanmaCountyofQinghaiProvince,Guoluo,Qinghai814300,China)
In order to establish a rapid mycoplasma pneumonia pathogen detection method,the study designed two pairs of primers in internal conserved gene based on Mhp genome sequence in GenBank.after optimization of PCR reaction conditions,a nested PCR method for Mhp detection was established.The results showed that the method appeared negative for M.gallisepticum,M.hyorhinis,APP,PCV2,PRV the amplification result;the first amplification sensitivity of this method was 10pg,the second amplification sensitivity 0.1 pg;the second amplification was 100 times more sensitive than the first amplification.The nested PCR method has the advantages of high specificity,high sensitivity,good reproducibility;it can detect low content of Mhp pathogen in a short period of time,which lays a foundation for rapid diagnosis and purification of Mycoplasma pneumoniae.
Mycoplasmahyopneumoniae;nested PCR;diagnosis;application
2013-05-17,
2013-06-09 [作者简介]吉 玛(1974-),女,藏族,青海乐都人,本科,兽医师,主要从事动物防疫工作。E-mail: jima1974@126.com
S811.6
A
1005-5228(2014)2-0053-05
