利用高浓度秸秆废弃物发酵产氢
2014-09-02刘淑敏白艳霞李彦红樊耀亭
刘淑敏, 白艳霞, 李彦红, 樊耀亭
(郑州大学 化学与分子工程学院, 河南 郑州 450001)
利用高浓度秸秆废弃物发酵产氢
刘淑敏, 白艳霞, 李彦红, 樊耀亭*
(郑州大学 化学与分子工程学院, 河南 郑州 450001)
采用高浓度的玉米秸秆(60 g·L-1)作为产氢底物, 研究了在氢发酵过程中几个关键过程参数对发酵产氢的影响,以期在秸秆废弃物的清洁氢能转化过程中减少发酵废水的生成总量. 结果表明, 在酸化秸秆浓度为60 g·L-1,碳酸氢铵添加量为1.2 g·L-1,十六烷基三甲基溴化铵添加量为30 mg·L-1,菌株Bacillus sp. FS2011添加量为10%(质量分数),以及初始pH= 7.5±0.5、发酵温度(37±1) ℃条件下, 最大产氢量和产氢速率分别为(79.8±1.5) mL·g-1和3.78 mL·g-1·h-1. 与使用低浓度秸秆(≤20 g·L-1)底物时相比, 生成的氢发酵废水总体积减小了约67%.
秸秆废弃物; 发酵; 高底物浓度; 产氢
由于传统化石燃料日趋枯竭以及使用化石燃料所造成的日益严重的环境污染问题,研究开发清洁和可再生的替代能源已成为我国能源研究领域中的一项紧迫任务.与其他能源相比, 氢能具有清洁(燃烧产物为水)、高效(热值是化石燃料的三倍)和可再生(可利用废弃的生物质资源)的特点, 是本世纪公认的清洁可再生能源[1]. 在传统的制氢方法中, 例如电解水、水煤气转化、石油裂解和热化学分解等, 不仅能耗高, 且大多需消耗一次性能源. 与前述方法相比, 暗发酵制氢具有反应条件温和、能耗低, 分离提纯简单的特点[2].
另一方面, 我国生物质资源丰富, 目前秸秆类生物质年产量已达7亿吨, 其中玉米秸秆的年产量约为2.2亿吨[3]. 这些废弃物除少量被用作饲料外, 大多被废弃或焚烧, 不仅污染环境, 也造成资源的重大浪费, 因而将这些废弃的生物质进行资源化处理意义重大. 由于秸秆类废弃物的化学结构复杂, 难以被生物降解, 因此在发酵产氢前需要对其进行水解预处理. 迄今关于秸秆的预处理方法已有许多报道, 但在发酵产氢研究中, 大多仍局限于使用低的秸秆浓度(5.0~20.0 g·L-1), 由此导致了大量发酵废水的生成以及二次环境污染问题[4-6]. 为了解决上述问题, 近年来人们也尝试在秸秆发酵产氢研究中使用较高的秸秆浓度, 例如:AKUTSU等在批式发酵产氢实验中, 把淀粉浓度增加至30 g·L-1, 但液相副产物中VFAs(挥发性脂肪酸)和醇的浓度迅速增加, 导致产氢量的迅速下降[7]. IDANIA等利用20.9%的市政有机废物进行高温发酵产氢实验时, 仅得到了463.7 mL·kg-1·d-1的最大产氢速率. 上述研究表明高浓度底物对产氢存在严重的抑制作用[8]. 李冬敏等在汽爆玉米秸秆固态发酵产氢研究中得到秸秆的最大产氢量仅为44.5 mL·g-1-汽爆秸秆[9]. 白真真等在秸秆发酵产氢研究中发现, 当酸解秸秆浓度从20 g·L-1增加至60 g·L-1时, 最大产氢量则从104.0 mL·g-1-秸秆降至49.6 mL·g-1-秸秆, 介质pH也从4.8降至4.2[10-11]. 综上所述, 高浓度秸秆对发酵产氢的抑制作用是导致其产氢效率不佳的主要瓶颈, 直至现在该研究也仍未获得实质性进展. 因此, 有必要对其开展进一步的研究工作. 本文作者在前期工作基础上, 以高浓度玉米秸秆(60 g·L-1)作为发酵产氢的模型物, 考察并优化了秸秆氢发酵过程中的几个关键参数.
1 实验部分
1.1 实验原料
玉米秸秆: 新收获的玉米秸秆(郑州郊区)经空气风干除尘后备用, 其主要成分如下: 总固体量(TS)75%(质量分数,下同)、纤维素33.64%、半纤维素24.4%、木质素8.65%、可溶性糖0.073 g·g-1-TS. 使用前将玉米秸秆粉碎, 过40目筛,按1∶10的固液比加入0.5%稀H2SO4,并进行煮沸处理1 h, 冷至室温后用氢氧化钙调节pH至7.0后备用.
1.0 g·L-1十六烷基三甲基溴化铵溶液: 将 1.0 g十六烷基三甲基溴化铵(CTAB)溶于1 000 mL水中.
产氢菌源: 以牛粪堆肥(取自河南农业大学科技园)作为天然产氢菌源, 含水量为58%. 将含有堆肥与水的混合物(固液比1∶6 )煮沸30 min, 冷至室温后继续浸泡12 h, 过滤除渣, 参照文献方法[11]在滤液中分别加入蔗糖(10 g·L-1)和营养液(10 mL·L-1), 在(37±1) ℃预培养10 h后作为产氢菌源(种子液).
菌种增强实验: 将实验室分离得到的纯菌株Bacillus sp. FS2011按常规方法驯化培养后用于本文的菌种增强实验. 培养液组成如下(g·L-1): 葡萄糖20, 蛋白胨4, 氯化钠3, 磷酸二氢钾1, 磷酸氢二钾1, 半胱氨酸0.5, 硫酸亚铁0.1, 氯化镁0.1, 营养液10 mL·L-1[11].
1.2 实验方法
在300 mL血清瓶中依次加入30 mL酸解的秸秆和15 mL种子液. 根据实验室前期优化的实验条件, 再依次加入0.6 g·L-1磷酸二氢钾和0.05 g铁粉, 调节介质pH至7.5±0.5, 加水至工作体积为50 mL, 使秸秆浓度为60 g·L-1. 通入氮气置换出反应瓶中的空气, 用橡胶塞密封瓶口, 将其置于恒温振荡器中, 在(37±1) ℃和120 rpm条件下进行发酵产氢实验. 为了保证数据的可信度, 实验组与对照组各设3个平行实验.
1.3 仪器及分析方法
气体体积用排水集气法进行测定: 氢气、甲烷、VFAs(挥发性脂肪酸)和醇含量用Agilent-4890型气相色谱仪(美国安捷伦仪器公司)按照文献方法进行测定[4]; pH用6071型微电脑酸度计测定; 秸秆中还原糖含量用DNS比色法,通过HP 4853型UV-Vis分光光度计测定[6].
2 结果与讨论
2.1 碳酸氢铵对产氢的影响


图1 碳酸氢铵添加量对产氢的影响Fig.1 Effects of ammonium bicarbonate dosage on hydrogen production
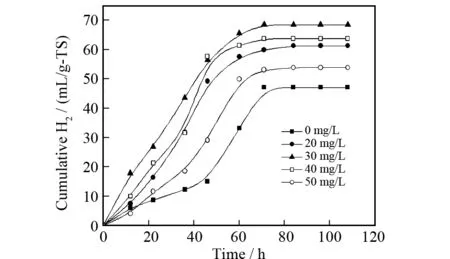
图2 十六烷基三甲基溴化铵添加量对产氢的影响Fig.2 Effects of cetyl trimethyl ammonium bromide dosage on hydrogen production
2.2 十六烷基三甲基溴化铵添加量对产氢的影响

图3 菌株FS2011添加量对产氢的影响Fig.3 Effects of strain FS2011 dosage on hydrogen production
在氢发酵体系中添加适量的表面活性物质有利于增加产氢菌表面的通透性,促进菌体对营养物质的吸收和有害物质的释放能力,从而提高其产氢活性.图2为当十六烷基三甲基溴化铵浓度在0~50 mg·L-1范围内变化时,产氢量随培养时间的变化趋势.从图2可以看出,当十六烷基三甲基溴化铵添加量小于30 mg·L-1时,产氢量随着十六烷基三甲基溴化铵剂量的增大逐渐增加,最大产氢量为68.3 mL·g-1-秸秆,对应的十六烷基三甲基溴化铵用量为30 mg·L-1,与对照样(47.0 mL·g-1-秸秆)相比,产氢量提高了约45.3%,表明在发酵介质中加入适量的表面活性剂十六烷基三甲基溴化铵对发酵产氢有显著的促进作用.其后,随着十六烷基三甲基溴化铵剂量的进一步增加,产氢量呈逐渐下降趋势.例如:当十六烷基三甲基溴化铵剂量从40 mg·L-1增加至50 mg·L-1时,产氢量从最大值的68.3 mL·g-1-秸秆分别降至63.5和53.9 mL·g-1-秸秆,表明在发酵产氢体系中添加过量的十六烷基三甲基溴化铵对产氢菌的抑制作用.因此,为了获得更好的产氢效果,十六烷基三甲基溴化铵添加的剂量应控制在一个合理的水平.
2.3 菌株Bacillus sp. FS2011对产氢的增强作用
利用实验室分离培养的优势产氢菌株Bacillus sp. FS2011考察了菌株添加量对底物产氢的增强作用, 结果如图3所示. 可以看出, 当菌株剂量在0~10%(体积分数)范围内变化时, 累积产氢量随着菌株剂量的增加逐渐增加. 例如: 当菌株剂量从0增加至2.0%时, 产氢量从对照样的52.1 mL·g-1-秸秆增加至53.2 mL·g-1-秸秆, 产氢量的最大值为59.29 mL·g-1-秸秆, 对应的菌株剂量为10%, 与对照样相比, 产氢量增加了13.6%. 其后, 随着菌株剂量的进一步增加产氢量逐渐减少. 例如, 当菌株剂量增加至12%时, 产氢量从最大值的59.3 mL·g-1-秸秆降至54.72 mL·g-1-秸秆. 实验结果表明,在秸秆的发酵产氢体系中加入一定量的纯菌株Bacillus sp. FS2011可以明显改善底物的产氢性能,原因在于菌种间的协同作用有利于改善和加强不同菌种间的互利共生关系,共同完成对复杂底物的降解.
2.4 放大实验
在酸化秸秆浓度为60 g·L-1,初始pH=7.5±0.5和发酵温度为(37±1) ℃的条件下,根据优化的实验参数,在一个10 L连续搅拌反应器中(工作体积为4.5 L)依次加入种子液(菌源),1.2 g·L-1的碳酸氢铵,30 mg·L-1十六烷基三甲基溴化铵和体积百分比为10%的菌株Bacillus sp. FS2011进行氢发酵实验,定时检测生物气中氢气浓度及发酵液中VFAs和醇含量,结果如图4所示.由图4a可知,反应器启动后产氢立即开始,产氢量和氢浓度随着培养时间的增加迅速增加,分别从起始的0 mL·g-1-秸秆和0%增加至培养时间为14 h的58.0 mL·g-1-秸秆和59%,介质的pH水平也从反应起始的8.0迅速降至培养时间为14 h的4.48.有趣的是,这个变化趋势与低浓度底物的发酵产氢曲线相比存在显著的差异[3-5],当培养时间在14~64 h时出现了一个平台区,其间几乎没有氢气生成,介质的pH略有下降,从14 h的4.48降至64 h的4.26. 经历平台区后,随着培养时间的增加产氢速率逐渐恢复,在培养时间为90 h产氢量达到最大值79.8 mL·g-1-秸秆.介质的pH随着培养时间的增加从69 h的4.21增加至90 h的4.73,整个氢发酵过程持续约97 h.在氢发酵期间,最大氢浓度为59.0%出现在培养时间14 h.但在平台区,氢浓度降至64 h的45.7%,经历平台区后,氢浓度维持在50%~60%(质量分数).

图4 产氢量、氢浓度和介质pH随培养时间的变化Fig.4 Developing trends of hydrogen yield, hydrogen content and medium pH value with culture time
与低浓度底物的氢发酵过程类似,在高浓度秸秆(60 g·L-1)的氢发酵期间,通常伴随着气相和液相发酵副产物的生成.气相发酵副产物仅检测到二氧化碳(浓度为39%~49%)及少量水蒸气,但没有检测到甲烷的存在;液相发酵副产物主要为挥发性脂肪酸(VFAs)和醇. 主要液相发酵副产物和残糖随培养时间的变化曲线示于图4b. 可以看出,在氢发酵期间,乙酸、丁酸和乙醇的产量分别为10 997, 7 648和376 mg·L-1,同时伴随少量丁醇和丙酸的生成,其中乙酸和丁酸含量占总VFAs的70%~80%,氢发酵废液中总COD浓度为22 300 mg·L-1.值得关注的是,本实验采用高的秸秆浓度(60 g·L-1),生成的发酵废液(VFAs和醇等)体积总量与使用低浓度底物(≤ 20 g·L-1)相比减少了一半,这对于规模化生物制氢中发酵废液的后续处理具有重要意义.
正如所预期的那样,在氢发酵期间,还原糖含量随着培养时间的增加从起始250.3 mg·L-1-秸秆降至90 h的3.43 mg·g-1-秸秆,表明了秸秆中的还原糖在氢发酵期间几乎被完全降解. 令人困惑的是,在培养时间为14~64 h的平台区仍然有少量还原糖被缓慢消耗,但在此期间几乎没有观察到有相应的氢气生成,而作为主要发酵副产物的VFAs和醇的含量则呈缓慢增加趋势,该现象暗示了在平台期内发酵底物仅仅被转化为液相代谢副产物(VFAs 和醇)及细胞物质.这个不寻常的现象完全不同于传统上使用低底物浓度进行发酵产氢时液相副产物的变化趋势.
此外,本文作者也简要比较了几个类似农业废弃物的发酵产氢特性(见表1).可以看出,本文的实验结果优于一些文献报道的数据[12-16].因此,我们认为可采用高的底物浓度(60 g·L-1)来减少发酵生物制氢中的废水生成量.

表1 不同农业废弃物生物产氢数据的比较Table 1 Comparison of bio-hydrogen production for several agricultural wastes
3 结论
在发酵产氢中,以高浓度玉米秸秆废弃物(60 g·L-1)为原料,通过对系统的参数优化,累积产氢量达到70.9 mL·g-1-秸秆,表明了高浓度秸秆废弃物用于氢发酵是可行的.该方法与低浓度秸秆(≤ 20 g·L-1)的发酵产氢相比,生成的发酵废水总体积减少了一半.在发酵培养14~64 h发现了一个平台区,在此区间,发酵底物仅仅被转化为液相副产物(VFAs和醇),但没有观察到氢气生成.
[1] DAS D. Advances in biohydrogen production processes: an approach towards commercialization [J]. Int J Hydrogen Energy, 2009, 34: 7349-7357.
[2] REN Nanqi. Biological hydrogen production by dark fermentation: challenges and prospects towards scaled-up production [J]. Current Opinion in Biotechnology, 2011, 22: 365-370.
[3] WANG Yubo, LI Ruijun, LI Weiwei, et al. Effects of pretreatment of natural bacterial source and raw material on fermentative biohydrogen production[J]. Int J Hydrogen Energy, 2012, 37: 831-836.
[4] GUO Yiping, FAN Shaoqun, FAN Yaoting, et al. The preparation and application of crude cellulase for cellulose-hydrogen production by anaerobic fermentation [J]. Int J Hydrogen Energy, 2010, 35: 459-468.
[5] ARGUN H, KARGI F, KAPDAN I K. Effects of the substrate and cell concentration on bio-hydrogen production from ground wheat by combined dark and photo-fermentation[J]. Int J Hydrogen energy, 2009, 34: 6181-6188.
[6] 杏 艳, 马红翠, 樊耀亭, 等. 秸秆类生物质发酵法生物产氢的研究[J]. 科学通报, 2009, 54(1): 1-7.
[7] AKUTSU Y, LI Yuyou, HARADA H, et al. Effects of temperature and substrate concentration on biological hydrogen production from starch [J]. Int J Hydrogen Energy, 2009, 34: 2558-2566.
[8] IDANIA V, HE′CTOR M. Alkalinity and high total solids affecting H2production from organic solid waste by anaerobic consortia [J]. Int J Hydrogen Energy, 2009, 34: 3639-3646.
[9] 李冬敏, 陈洪章, 李佐虎. 生物制氢技术的研究进展[J]. 生物技术通报, 2003, 4: 1-4.
[10] 白真真, 吴黎阳, 樊耀亭, 等. 固态发酵对秸秆废弃物产氢性能的影响[J]. 化工学报, 2011, 62(10): 2939-2944.
[11] 白真真. 秸秆废弃物固态发酵产氢的研究[D]. 郑州: 郑州大学, 2011.
[12] KIM D H, KIM S H. Sewage sludge addition to food waste synergistically enhances hydrogen fermentation performance [J]. Bioresour Technol, 2011, 102: 8501-8506.
[13] ZHAO Lei,CAO Guangli, WANG Aijie, et al. Simultaneous saccharification and fermentation of fungal pretreated cornstalk for hydrogen production using thermoanaerobacterium thermosaccharolyticum W16 [J]. Bioresour Technol, 2013, 145: 103-107.
[14] CAO Guangli, XIA Xunfeng, ZHAO Lei, et al. Development of AFEX-based consolidated bioprocessing on wheat straw for biohydrogen production using anaerobic microflora [J]. Int J Hydrogen Energy, 2013, 38: 15653-15659.
[15] CHU Yongbao, WEI Yueli, YUAN Xianzheng, et al. Bioconversion of wheat stalk to hydrogen by dark fermentation: Effect of different mixed microflora on hydrogen yield and cellulose solubilisation [J]. Bioresour Technol, 2011, 102: 3805-3809.
[责任编辑:毛立群]
Hydrogenproductionfromahighconcentrationofmaizestrawwasterbydarkfermentation
LIU Shumin, BAI Yanxia, LI Yanhong, FAN Yaoting*
(CollegeofChemistryandMolecularEngineering,ZhengzhouUniversity,Zhengzhou450001,Henan,China)
A high concentration of maize straw (60 g·L-1) was employed as the feedstock to produce hydrogen, and the effects of several key process parameters on the hydrogen productionviahydrogen fermentation process were investigated with the hope to substantially reduce the amount of effluent generated from the bio-reactor during the conversion of maize straw castoff into biological hydrogen energy. Results indicate that, under 60 g·L-1concentration of acidized maize straw, NH4HCO3dosage of 1.2 g·L-1, cetyltrimethyl ammonium bromide dosage of 30 mg·L-1and 10% dosage (m/m) of strains FS2011, as well as initial pH of 7.5±0.5 and fermentation temperature of (37±1) ℃, the maximum hydrogen yield and hydrogen production rate are recorded to be (79.8±1.5) mL·g-1and 3.78 mL·g-1·h-1. Besides, as comparison with the case involving low concentration of maize straw (≤20 g·L-1), the total volume of the effluent produced by hydrogen fermentation at high concentration of maize straw is reduced by about 67%.
maize straw waste; fermentation; high concentration of substrate; hydrogen production
2014-04-18.
国家自然科学基金(21171147和20871106),国家973重点基础研究发展规划(2009CB220005-1).
刘淑敏(1967—),女,实验师,研究方向为应用化学.*
,E-mail: yt.fan@zzu.edu.cn.
X 382
A
1008-1011(2014)05-0522-05
10.14002/j.hxya.2014.05.017
猜你喜欢
杂志排行
化学研究的其它文章
- 三种席夫碱-Ni(II)配合物的电子结构和吸收光谱的理论计算
- 共混硫化丁腈橡胶-氯丁橡胶的物理性能
- 不同消解方法分析污泥中重金属含量的比较
- Synthesis and characterization of a dysprosium-organic framework incorporating 2-hydroxyl-6-methyl-isonicotinic acid and oxalate mixed ligands
- Crystal structure and proton-conductivity of a complex based on phosphomolybdic acid and 2-(2-hydroxybenzene)benzimidazole
- 纳米材料在蛋白质分离中的应用
