内皮素-1对小鼠脑微血管内皮细胞环氧化酶-2、前列腺素E2表达的影响
2014-09-01李岩琦赵源征高灵利刘恒方
李岩琦,赵源征,高灵利,刘恒方#
1)郑州大学医院内科 郑州 450001 2)郑州大学第五附属医院神经内科 郑州 450052
内皮素-1对小鼠脑微血管内皮细胞环氧化酶-2、前列腺素E2表达的影响
李岩琦1),赵源征2),高灵利2),刘恒方2)#
1)郑州大学医院内科 郑州 450001 2)郑州大学第五附属医院神经内科 郑州 450052
﹟通讯作者,男,1965年8月生,博士,教授,主任医师,研究方向:脑血管病,E-mail:liuhf1965@163.com
内皮素-1;环氧化酶-2;前列腺素E2;脑微血管内皮细胞;小鼠
目的:探讨内皮素-1(ET-1)对小鼠脑微血管内皮细胞中环氧化酶-2(COX-2)及前列腺素E2(PGE2)表达的影响。方法培养小鼠脑微血管内皮细胞bEnd.3株,分别加入不同浓度(1、10、100和1 000 nmol/L)的ET-1处理2、4、6、16和24 h,用Western blot技术检测不同浓度ET-1处理不同时间后细胞内COX-2表达的变化;另取生长良好的细胞与10 nmol/L的ET-1在37 ℃下分别培养2、4、6、16和24 h,以不加ET-1培养的细胞为对照,检测各组细胞上清液中PGE2水平的变化。结果bEnd.3细胞经不同浓度ET-1处理不同时间后,COX-2蛋白表达在2~4 h时显著增加,6 h时达到高峰,具有浓度及时间依赖性(F浓度=127.079,F时间=40.158,F交互=5.783,P均<0.001)。10 nmol/L的ET-1处理不同时间后各组bEnd.3细胞上清液中PGE2释放水平于4 h开始升高,6 h达峰,24 h下降,差异有统计学意义(F=195.630,P<0.001)。结论ET-1可上调bEnd.3细胞中炎症因子COX-2的表达及PGE2的释放,最终对bEnd.3细胞株造成损伤。
脑内的毛细血管和微血管内皮细胞在维持脑血流、微血管张力和血脑屏障功能中起重要作用。有研究[1]表明,内皮细胞过度表达内皮素-1(endothelin-1, ET-1)可加重脑缺血。同时,在脑缺血缺氧时,内皮细胞和星形胶质细胞也产生ET-1[2]。一些研究[3]还表明,体外培养的血管内皮细胞能产生和释放ET-1,可以引发血管收缩和前炎症反应。因此,ET-1通过在脑微血管内皮细胞中的作用,可能在中枢神经系统疾病中发挥重要作用,但其确切的作用机制仍不清楚。该研究通过体外培养小鼠脑微血管内皮细胞,观察ET-1对环氧化酶-2(cyclooxygenase-2,COX-2)表达及前列腺素E2(protaglandin E2,PGE2)释放的影响。
1 材料与方法
1.1主要仪器及试剂DMEM/F-12培养基、胎牛血清(FBS)、Trizol购自Invitrogen公司,硝酸纤维素膜和增强化学发光Western blot检测系统购自GE公司,各种抗体均购自Santa Cruz公司,二喹啉甲酸(bicinchoninic acid, BCA)蛋白分析试剂购自Pierce公司,ET-1、各种酶类及其他化学试剂均购自Sigma公司。
1.2小鼠脑微血管内皮细胞的培养小鼠脑微血管内皮细胞株bEnd.3购自赛尔生物技术有限公司(中国)。加入含100 g/L PBS、100 U/mL青霉素、100 mg/L链霉素和250 μg/L两性霉素B DMEM/F-12的培养基,在37 ℃、体积分数5%CO2培养箱中培养。培养至细胞融合成片时,用0.5 g/L胰岛素/0.53 mmol/L EDTA将其洗脱。将细胞悬液(2×105mL-1)接种于6孔培养板(2 mL/孔),用来测量蛋白的表达。24 h后更换培养基,随后每3 d更换一次。
1.3bEnd.3细胞中COX-2蛋白表达的Westernblot检测生长良好的细胞与不同浓度(1、 10、100 和1 000 nmol/L)的ET-1在37 ℃下分别孵育2、4、6、16和24 h。细胞经冰冷的PBS洗脱,小心刮下细胞,4 ℃下45 000g离心1 h,弃上清液。样本被转移至硝酸纤维素膜,加入COX-2抗体孵育过夜。TTBS洗膜4次,5 min/次,加入1:2 000稀释的抗兔辣根过氧化物酶抗体,孵育2 h后用增强化学发光试剂盒检测蛋白的表达情况。每组均设3个平行对照。
1.4bEnd.3细胞上清液中PGE2水平检测细胞培养同1.2。取生长良好的细胞与10 nmol/L的ET-1在37 ℃下分别培养2、4、6、16和24 h,以不加ET-1培养的细胞为对照。细胞经低速离心后取上清,利用酶联免疫试剂盒(博奥森生物科技公司)检测各组细胞上清液中PGE2水平。每组均设3个平行对照。
1.5统计学处理采用SPSS 17.0进行分析。应用4×5析因设计的方差分析比较不同浓度ET-1培养bEnd.3细胞不同时间后细胞中COX-2蛋白表达的变化,应用单因素方差分析和LSD-t检验比较10 nmol/L ET-1培养bEnd.3细胞不同时间后细胞上清液中PGE2水平的变化,检验水准α=0.05。
2 结果
2.1不同浓度ET1培养bEnd.3细胞不同时间后细胞中COX-2蛋白表达的变化见表1。由表1可知COX-2蛋白表达在2~4 h时增加,6 h时达到高峰,具有浓度及时间依赖性。
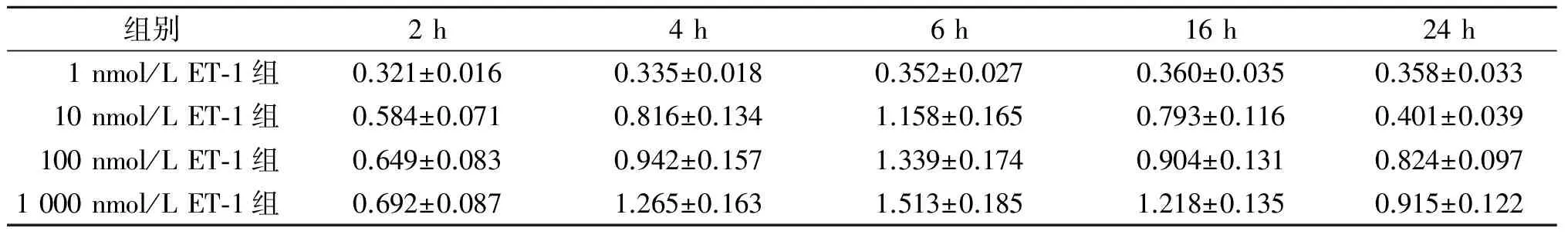
表1 不同浓度ET-1培养bEnd.3细胞不同时间后细胞中COX-2蛋白表达的变化(n=3)
F组间=127.079,F时间=40.158,F交互=5.783,P均<0.001。
2.2 10nmol/LET-1培养bEnd.3细胞不同时间后细胞上清液中PGE2水平的变化与对照组[(278.43±0.05) ng/L]相比,ET-1培养2、4、6、16和24 h后细胞上清液中PGE2水平分别为[(441.52±0.07)、(567.70±0.07)、(618.85±0.09)、(539.83±0.07)和(460.61±0.07) ng/L],差异有统计学意义(F=195.630,P<0.001)。结果显示PGE2水平于4 h开始升高,6 h达峰,24 h显著下降(P<0.05),具有时间依赖性。
3 讨论
脑微血管内皮细胞是构成血脑屏障的重要基础,各种有害因素如缺氧等均可导致其功能异常,而血管内皮细胞功能损伤是缺血性脑卒中的早期病变与基本病因之一。研究[4-5]发现,ET-1是血管内皮细胞分泌、含21个氨基酸残基的多肽,具有强烈的缩血管作用,当血管内皮细胞受到损害时可使ET-1分泌增加,反之,ET-1升高可破坏内皮细胞,且ET-1的增加可使脑血流量降低至病理水平。COX是合成前列腺素(PGs)的关键限速酶,能催化花生四烯酸转化为PGs。COX存在2种亚型:COX-1存在于大多数组织,间接维持生理反应及血管内平衡;COX-2在大多数正常组织和细胞中不能被检测出,但当血管内皮细胞和平滑肌细胞发生炎症反应时,可被细胞因子、内皮素及PGs诱导产生[6]。
研究[7]发现,上调中枢神经系统内的COX-2水平,可将花生四烯酸催化代谢成各种PGs产物,从而加重神经变性疾病的炎症反应。而有文献[8]报道在一些细胞内,ET-1能够通过MAPK途径上调COX-2的表达。作者采用Western blot方法检测bEnd.3细胞中不同浓度ET-1培养不同时间后COX-2蛋白表达的变化,结果显示,bEnd.3细胞在不同浓度ET-1处理后,COX-2蛋白2~4 h时增加,6 h时达到高峰,表明ET-1能够上调COX-2表达,且呈浓度和时间依赖性。而COX-2表达的增加可使微血管的通透性增加,促进单核细胞黏附及聚集、巨噬细胞迁移,激发炎症因子如IL-6等的产生,致使炎症级联反应扩大。另有研究[9]也发现COX-2在正常生理情况下几乎是不表达的,只有一定的条件刺激,才可使COX-2过度表达。可见,一定浓度的ET-1培养脑微血管内皮细胞株bEnd.3可通过上调炎症因子COX-2的表达,致使脑微血管内皮细胞损伤。
另外,该研究结果显示ET-1为10 nmol/L时最有意义。研究[10]发现COX 是作为催化花生四烯酸生成PGs类物质的限速酶,从COX酶活性增高到PGE2合成与释放需要一定的时间。作者采用酶联免疫法检测10 nmol/L ET-1培养不同时间bEnd.3细胞后发现细胞上清液中PGE2的释放水平于4 h开始升高,6 h达峰,24 h显著下降;且不同浓度ET-1刺激下COX-2表达的峰值与PGE2释放的峰值时一致;表明ET-1能够促进PGE2的释放,且呈时间依赖性。提示一定浓度的ET-1培养脑微血管内皮细胞株bEnd.3能够促进PGE2的释放,进而加重血管内皮细胞的损伤。
总之,该研究结果表明一定浓度的ET-1培养脑微血管内皮细胞株bEnd.3能够上调炎症因子COX-2的表达及促进PGE2的释放,进而损伤脑微血管内皮细胞功能,最终引发脑血管病事件。提示ET-1可能在脑血管炎症反应及中枢神经系统其他疾病中发挥重要作用,开发以COX-2/PGE2为靶点的药物,可能为治疗脑损伤及损伤后炎症反应提供新的思路。
[1]McCarron RM,Chen Y,Tomori T Jr,et al.Endothelial-mediated regulation of cerebral microcirculation[J].J Physiol Pharmacol,2006,57(Suppl 11):133
[2]Boehm F,Pernow J.The importance of endothelin-1 for vascular dysfunction in cardiovascular disease[J].Cardiovasc Res,2007,76(1):8
[3]Kawanabe Y,Nauli SM.Endothelin[J].Cell Mol Life Sci,2011,68(2):195
[4]Lerman A,Zeiher AM.Endothelial function:eardiac events[J].Circulation,2005,111(3):363
[5]Wang HH,Hsieh HL,Wu CY,et al.Endothelin-1 enhances cell migration via matrix metalloproteinase-9 up-regulation in brain astrocytes[J].J Neurochem,2010,113(5):1133
[6]Hsieh HL,Sun CC,Wang TS,et al.PKC-δ/c-Src-mediated EGF receptor transactivation regulates thrombin-induced COX-2 expression and PGE(2) production in rat vascular smooth muscle cells[J].Biochim Biophys Acta,2008,1783(9):1563
[7]Minghetti L.Cyclooxygenase-2 (COX-2) in inflammatory and degenerative brain diseases[J].J Neuropathol Exp Neurol,2004,63(9):901
[8]Song HJ,Min YS,Shin CY,et al.Activation of p38 MAPK is involved in endothelin-1-stimulated COX-2 expression in cultured feline esophageal smooth muscle cells[J].Mol Cells,2006,22(1):44
[9]Li H,Gao S,Ye J,et al.COX-2 is involved in ET-1-induced hypertrophy of neonatal rat cardiomyocytes:role of NFATc3[J].Mol Cell Endocrinol,2014,382(2):998
[10]Fang LL,Cheng JC,Chang HM,et al.EGF-like growth factors induce COX-2 derived PGE2 production through ERK1/2 in human granulosa cells[J].J Clin Endocrinol Metab,2013,98(12):4932
(2013-12-17收稿 责任编辑赵秋民)
Effect of endothelin-1 on mice brain microvascular endothelial cells cyclooxygenase-2 and prostaglandin E2 expresstion
LIYanqi1),ZHAOYuanzheng2),GAOLingli2),LIUHengfang2)
1)DepartmentofInternalMedicine,theHospitalofZhengzhouUniversity,Zhengzhou450001 2)DepartmentofNeurology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
endothelin-1;cyclooxygenase-2;prostaglandin E2;brain microvascular endothelial cell;mouse
Aim: To explore the effects of endothelin-1 (ET-1) on the expression of cyclooxygenase-2 (COX-2) and prostaglandin E2 (PGE2) in the mice brain microvascular endothelial cell. Methods: The bEnd.3 cells,a mice brain microvascular endothelial cell line,were added to 1, 10, 100 or 1 000 nmol/L ET-1 in treatment for 2, 4, 6, 16 or 24 h. Different concentrations ET-1 treated with different time COX-2 expression was detected by Western blot; another well-grown cells and 10 nmol/L ET-1 were cultured 2, 4, 6, 16 and 24 h at 37 ℃, the cultured cells without ET-1 treatment was used as control. The changes of PGE2 levels in culture supernatants were detected in each group. Results: Compared with control group, the protein expressions of COX-2 were significantly increased at 2 to 4 h and reached the peak at 6 h, with a concentration- and time-dependent manner(Fconcentration=127.079,Ftime=40.158,Finteraction=5.783,P<0.001); the level of PGE2 were significantly increased at 4 h, reached the peak at 6 h, then were significantly decreased at 24 h after being treated by 10 nmol/L ET-1 in each group bEnd.3 cell supernatant at different times(F=195.630,P<0.001). Conclusion: ET-1 may up-regulate COX-2 expression and PGE2 release in bEnd.3 cells, ultimately cause damage to bEnd.3 cell lines.
10.13705/j.issn.1671-6825.2014.04.021
R743
