蛋白酶体激活因子PA28α对Eca109和EC9706细胞细胞周期和凋亡的影响*
2014-09-01蒋海丽张彦婷王瑞莉龚方华关方霞
蒋海丽,张彦婷,石 科,韩 康,王瑞莉,龚方华,王 静,1,#,关方霞#
1)郑州大学生命科学学院 郑州450001 2)郑州大学第一附属医院细胞生物学研究室 郑州450052
蛋白酶体激活因子PA28α对Eca109和EC9706细胞细胞周期和凋亡的影响*

1)郑州大学生命科学学院 郑州450001 2)郑州大学第一附属医院细胞生物学研究室 郑州450052
#通讯作者:薛乐勋,男,1944年2月生,教授,研究方向:肿瘤标志物与基因工程,E-mail: xuelx@zzu.edu.cn;关方霞,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学,E-mail: guanfangxia@126.com
PA28α;食管鳞癌细胞;细胞周期;细胞凋亡
目的:探讨蛋白酶体激活因子PA28α对食管鳞癌细胞周期和凋亡的影响。方法扩增PA28α的cDNA全长序列并连接到pCMV-Myc上,构建真核表达载体pCMV-Myc-PA28α,脂质体法转染食管鳞癌细胞系Eca109和EC9706,荧光显微镜观察PA28α蛋白在细胞中的定位;Western blot法鉴定重组载体的表达;流式细胞仪检测PA28α在食管鳞癌EC9706细胞中过表达对其细胞周期和凋亡的影响。结果转染了重组载体pCMV-Myc-PA28α的食管鳞癌Eca109和EC9706细胞中PA28α蛋白主要存在于细胞质。与空载体转染组(0.342±0.007)相比,pCMV-Myc-PA28α转染组(1.073±0.040)EC9706细胞中有较高的PA28α蛋白表达(F=984.411,P<0.001)。与空载体转染组(37.642±1.000)相比,pCMV-Myc-PA28α转染组(39.258±0.154)EC9706细胞处于S期细胞比例明显增高(F=24.592,P<0.001)。pCMV-Myc-PA28α转染组EC9706细胞的凋亡率(14.463%±0.634%)明显低于空载体转染组(43.893%±0.473%),差异有统计学意义(F=1 448.569,P<0.001)。结论PA28α与食管鳞癌的凋亡有密切关系,可能成为治疗食管鳞癌的一个有效靶点。
在真核细胞中,蛋白酶体系统是生物体内重要的蛋白质降解系统,受多种复杂因素的调控,通过有目的地降解受损伤的或者错误折叠的蛋白质进而调节整个细胞的生命过程。有资料[1]表明,蛋白酶体是真核细胞中一种主要的非溶酶体蛋白降解系统,细胞内70%或80%以上的蛋白质由蛋白酶体降解。最普遍的蛋白酶体形式为26S蛋白酶体,由20S核心颗粒与具有激活核心颗粒作用的蛋白酶体激活因子组成[2]。在蛋白酶体激活因子作用下,蛋白质底物进入20S核心颗粒的中心水解部位而被降解。
目前,在生物体内主要发现了两大类重要的蛋白酶体激活因子,一类是19S蛋白酶体激活因子,又称PA700,主要参与机体内依赖ATP及泛素的蛋白质的降解;另一类是PA28蛋白酶体激活因子家族,又称11S或REG,主要参与调控机体内非ATP及非泛素依赖的蛋白质降解作用[3]。近年来已陆续发现不少蛋白质,如一些氧化性蛋白、受损伤的及错误折叠的蛋白等,以非泛素依赖的方式被蛋白酶体降解,即由11S和20S组成的蛋白酶体降解,11S包括包括PA28α、PA28β和PA28γ 3个成员[4]。 研究[4]显示PA28α基因编码的蛋白在很多恶性肿瘤组织中的表达都存在异常。作者研究了该基因在食管鳞癌细胞中的重组表达以及重组表达后对细胞周期和凋亡的影响,为进一步深入研究PA28α在食管鳞癌中的作用机制提供实验依据。
1 材料与方法
1.1材料食管鳞癌细胞系(Eca109、EC9706)和pCMV-Myc载体均由郑州大学生命科学学院保存。PCR、qRT-PCR引物(北京六合华大基因科技股份有限公司),反转录试剂盒和SYBR Premix Ex Taq(大连宝生物工程有限公司),RPMI 1640 细胞培养基、胎牛血清和胰蛋白酶(美国Hyclone公司),PA28α多克隆抗体(百奇生物科技有限公司),β-actin多克隆抗体(北京康为世纪生物科技有限公司),LipofectamineTM2000(美国Invitrogen公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(美国SAB公司),细胞全蛋白提取试剂盒[生工生物工程(上海)股份有限公司]。
1.2重组载体的构建与鉴定Trizol法提取食管鳞癌细胞总的RNA,经纯度、浓度以及完整性鉴定合格后,按照反转录试剂盒说明书反转录为cDNA。采用Primer 5.0软件设计引物:PA28α上游引物5’-CGGAATTCGGATGGCCATGCTCAGG-3’,下游引物5’-ATAGTTTAGCGGCCGCTCAATAGATCATTCC-3’,扩增产物大小750 bp。PCR反应条件:预变性94 ℃ 5 min;94 ℃ 30 s,53 ℃ 1 min,72 ℃ 1 min,共循环30次;72 ℃ 10 min,4 ℃终止反应。10 g/L琼脂糖凝胶电泳,分析目的基因扩增结果,并送生工生物工程(上海)股份有限公司进行测序。目的片段PA28α与pMD18-T载体连接,经EcoRⅠ和NotⅠ双酶切,验证目的片段的正确性,回收目的片段。空载体pCMV-Myc和目的片段PA28α同时经EcoRⅠ和NotⅠ双酶切,将酶切后目的片段和载体片段以物质的量的比为3:1连接,转化感受态大肠杆菌后,挑选单个菌落扩大培养并提取质粒。EcoRⅠ和NotⅠ双酶切鉴定质粒,并送生工生物工程(上海)股份有限公司测序。
1.3细胞培养及重组载体的瞬时转染Eca109、EC9706细胞生长于含体积分数10%胎牛血清的RPMI 1640培养基中,在37 ℃、体积分数5% CO2饱和湿度的细胞培养箱中培养。待细胞达到70%~80%融合时,采用LipofectamineTM2000脂质体转染法分别转染空质粒pCMV-Myc(空载体转染组)和重组质粒pCMV-Myc-PA28α(pCMV-Myc-PA28α转染组),以未处理的细胞作为空白对照组。具体操作按照LipofectamineTM2000说明书进行。
1.4pCMV-Myc-PA28α重组蛋白定位的细胞免疫荧光检测重组质粒pCMV-Myc-PA28α转染Eca109、EC9706细胞48 h后,用PA28α多克隆抗体及相对应的二抗做细胞免疫荧光染色,用显微荧光摄像/照相系统分别检测转染了pCMV-Myc和pCMV-Myc-PA28α的食管鳞癌细胞株中PA28α蛋白的表达情况。
1.5pCMV-Myc-PA28α重组蛋白表达的Westernblot检测用全蛋白提取试剂盒提取空白对照组、空载体转染组和pCMV-Myc-PA28α转染组细胞的总蛋白,用改良Bradford法测定蛋白浓度,取出40 μL蛋白加入Loading Buffer,沸水中煮10 min,使蛋白完全变性。SDS-聚丙烯酰胺凝电泳分离蛋白,每孔上样量50 μg,浓缩胶电压80 V(30 min),分离胶电压120 V(1 h)。切下所需大小条带,制作滤纸-PVDF-滤纸“三明治”结构,经半干式电转仪22 V转膜18 min。100 g/L的脱脂牛奶室温封闭1 h,PA28α多克隆抗体(按1:200稀释)4 ℃过夜孵育及相应二抗(按1:3 000稀释) 37 ℃孵育1 h,以β-actin作为内参蛋白,ECL发光液A液和B液等体积混合液处理后暗室内曝光胶片,胶片经扫描仪扫描。每组均设3个平行对照。
1.6重组蛋白过表达后细胞周期的检测收集转染后48 h的EC9706细胞,冰冷PBS洗2遍,体积分数70%的冰乙醇固定,4 ℃过夜。800 r/min离心,弃乙醇,PBS洗2遍。PBS重悬细胞,加入RNAase(终质量浓度50 mg/L)室温放置1 h。调整细胞密度为1×106mL-1,加1 mL PI(终质量浓度100 mg/L)避光30 min,流式细胞仪检测细胞周期。每组均设3个平行对照。
1.7重组蛋白过表达后细胞凋亡的检测用无EDTA、胰蛋白酶的消化液消化、收集转染后48 h的EC9706细胞,0.5 mL PBS重悬细胞,用未处理的、只加Annexin V-FITC、只加PI、加Annexin V-FITC和PI分别作为未染色管、单染Annexin V-FITC管、单染PI管、双染管,以未染色管细胞调零机器,以单染Annexin V-FITC管和单染PI管作为基准参考,流式细胞仪检测细胞的凋亡情况。每组均设3个平行对照。
1.8统计学处理采用SPSS 17.0进行分析,应用单因素方差分析和LSD-t检验比较3组间PA28α的表达水平、PA28α过表达后细胞周期的变化以及PA28α过表达对细胞凋亡的影响,检验水准α=0.05。
2 结果
2.1重组质粒的构建与鉴定如图1A所示,所提RNA的28S和18S条带清晰,没有弥散现象,说明所提总RNA质量较高,达到了反转录为cDNA的要求。退火温度梯度PCR结果(图1B)显示,扩增出的DNA特异条带大小约为750 bp,测序结果表明,目的片段为PA28α,其序列的大小、方向和读码框都正确。将目的基因PA28α与pMD18-T连接,经EcoRⅠ和NotⅠ双酶切后,回收目的片段与pCMV-Myc连接, 双酶切及测序分析结果显示重组质粒构建成功(图1C、图1D)。
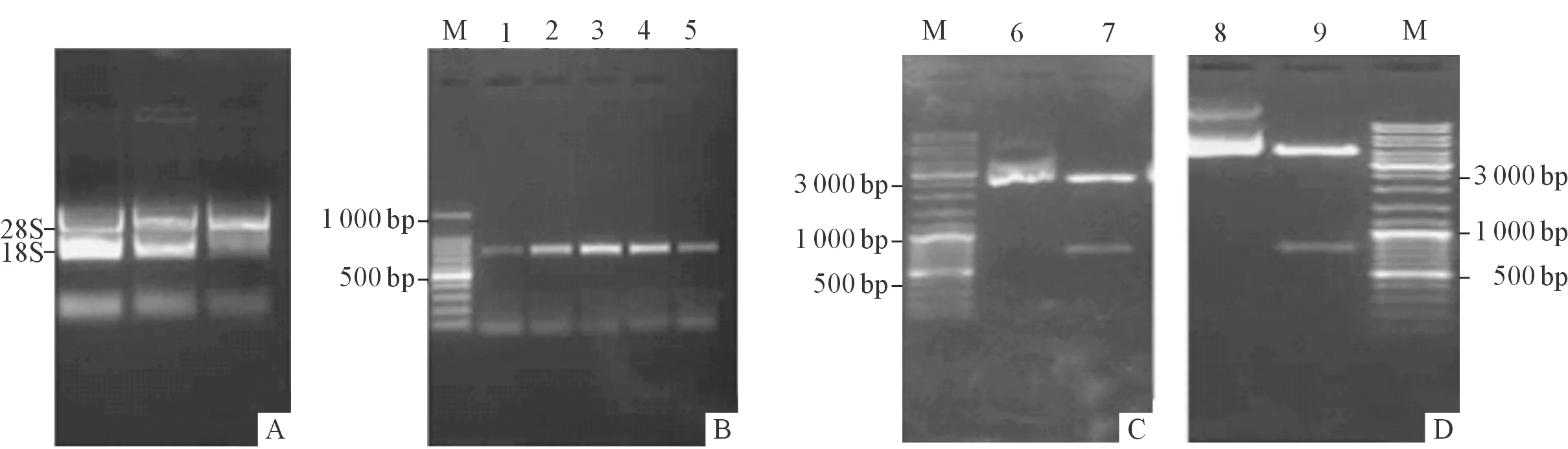
图1 细胞总RNA 完整性鉴定、PA28α的温度梯度扩增及酶切鉴定
A:从左至右依次为Het-1A、Eca109和EC9706 3种细胞总RNA提取结果;B:PA28α的温度梯度扩增;C:PA28α与pMD18-T连接双酶切鉴定;D:PA28α与pCMV-Myc连接双酶切鉴定;M:Marker;1、2、3、4、5:分别代表退火温度为50、52、54、56、58 ℃时PA28α基因扩增产物;6、8:分别为pMD18-T-PA28α、pCMV-Myc-PA28α;7、9:PA28α。
2.2pCMV-Myc-PA28α重组蛋白在食管鳞癌细胞中的定位见图2。由图2可知,PA28α主要分布在细胞质,转染pCMV-Myc-PA28α载体的Eca109和EC9706细胞的荧光均强于未转染pCMV-Myc空载体细胞,证明重组载体pCMV-Myc-PA28α已成功在2株食管鳞癌细胞株中表达。
A、C:pCMV-Myc空载体分别转染Eca109、EC9706细胞;B、D:pCMV-Myc-PA28α载体分别转染Eca109、EC9706细胞。图中蓝色为细胞核,红色为PA28α蛋白。
2.3EC9706细胞中pCMV-Myc-PA28α重组蛋白的表达见图3。结果显示:与空白对照组(0.271±0.012)和空载体转染组(0.342±0.007)相比,pCMV-Myc-PA28α转染组(1.073±0.040)有较高的PA28α蛋白表达水平(F=984.411,P<0.001)。
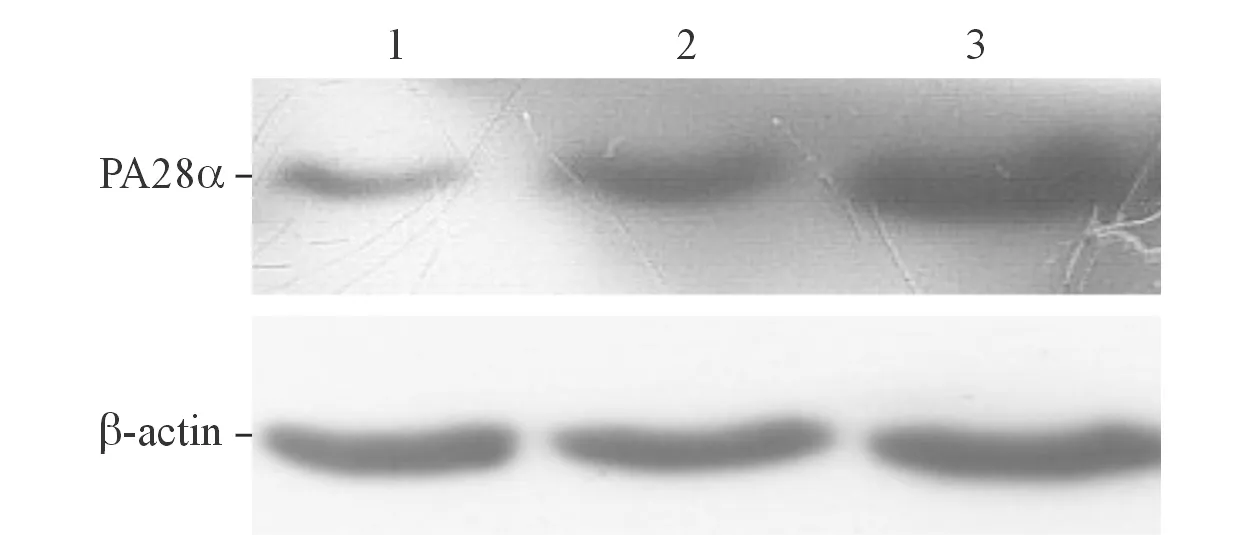
图3 EC9706细胞转染后PA28α的表达
1、2、3:分别为EC9706细胞的空白对照组、空载体转染组、pCMV-Myc-PA28α转染组。
2.4PA28α过表达对食管鳞癌EC9706细胞周期及凋亡的影响见表1、2。

表1 PA28α过表达对食管鳞癌细胞EC9706周期的影响 %
*:与空白对照组相比,P<0.05。
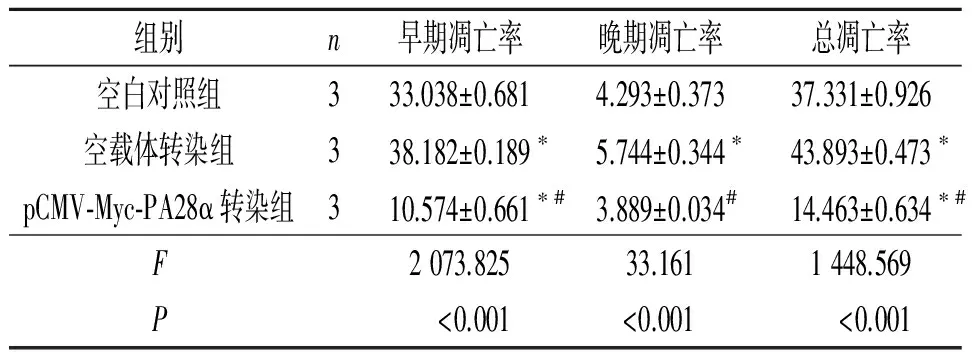
表2 PA28α过表达对食管鳞癌细胞EC9706凋亡的影响 %
*:与空白对照组相比,P<0.05;#:与空载体转染组相比,P<0.05。
3 讨论
蛋白酶体是多亚基蛋白酶,负责选择性降解真核生物体内受损伤的或者错误折叠的功能蛋白分子,能够将蛋白质降解为含7~9个氨基酸肽段。蛋白酶体可以作为治疗肿瘤的药物靶点,其中比较成功的例子是蛋白酶体抑制剂硼替佐米在临床上被用来治疗多发性骨髓瘤,并取得了很好的治疗效果,但易产生耐药性,且对实体瘤的临床实验效果差。
目前研究发现多种人类恶性肿瘤中存在PA28异常表达现象。张林等[5]发现PA28α基因可以抑制胃癌细胞的生长、增殖,同时还影响胃癌细胞的细胞周期,对抑制胃癌细胞的恶性表现有一定的意义。Longuespée等[6]采用蛋白质组学方法检测到PA28α在正常卵巢上皮中定位和在癌细胞中定位不同,分别定位在细胞核、细胞质,因此PA28α可以作为卵巢癌的潜在生物学标记。有研究[7]表明在前列腺癌中PA28有显著的上调现象,并且增强了癌细胞的迁移能力,被作为检测前列腺癌的一个潜在的生理指标。
值得注意的是,经γ-干扰素诱导,PA28α在细胞内表达显著上调,能够参与免疫反应,是免疫蛋白酶体的组成部分;它编码的蛋白与蛋白酶体在机体免疫系统中亦起重要作用,能够辅助MHC-Ⅰ类分子将胞内的抗原肽呈递到细胞表面被CD8+分子识别,进行免疫反应,可影响与MHC-Ⅰ类分子结合的病毒或肿瘤抗原的加工,并与细胞表面细胞毒性T细胞识别的抗原表位的形成和维持有关[8]。γ-干扰素诱导细胞内抗原呈递的机制不是通过诱导免疫蛋白酶体的亚基而是通过诱导蛋白酶体激活因子PA28α的合成,合成的PA28α和20S绑定,进一步参与免疫反应。因此,PA28α基因与恶性肿瘤的相关性可能涉及调节肿瘤相关蛋白的降解和细胞免疫功能两个方面,其确切机制有待进一步研究。
我国是食管鳞癌的高发区,因此,了解食管鳞癌发生发展的分子机制成为解决临床治疗效果不佳的关键所在。该课题利用了脂质体法向食管鳞癌细胞中转染了PA28α的重组表达载体,进一步利用流式细胞仪检测了细胞的周期和凋亡情况,初步证实了PA28α在食管鳞癌中过表达能够将EC9706细胞阻滞在S期,并且可以抑制食管鳞癌细胞株的凋亡,说明PA28α可能参与食管鳞癌的发生发展,为进一步研究PA28α影响肿瘤细胞凋亡的分子机制提供依据。
[1]石科.蛋白酶体亚基PSMD7在纤毛/鞭毛解聚及食管癌发生发展中的作用[D].郑州:郑州大学,2013.
[2]吕晓虹,李伟,何岚,等.20S蛋白酶体表达与类风湿关节炎的关系探讨[J].中国实用医药,2013,8(32):93
[3]Nie J,Wu M,Wang J,et al.REGgamma proteasome mediates degradation of the ubiquitin ligase Smurf1[J].FEBS Lett,2010,584(14):3021
[4]Stadtmueller BM, Hill CP. Proteasome activators Mol[J].Cell,2011,41(1):8
[5]张林,李楠,吴凯,等.PSME1基因对人胃腺癌细胞株SGC-7901生物学特性的影响[J].胃肠病学,2010,15(4):229
[6]Longuespée R,Boyon C,Desmons A,et al.Ovarian cancer molecular pathology[J].Cancer Metastasis Rev,2012,31(3/4):713
[7]Sánchez-Martín D,Martínez-Torrecuadrada J,Teesalu T,et al.Proteasome activator complex PA28 identified as an accessible target in prostate cancer by in vivo selection of human antibodies[J].Proc Natl Acad Sci USA,2013,110(34):13791
[8]Nathan JA,Sha Z,Goldberg AL.Cellular 26s proteasome activity and content is increased in response to oxidative stress[J].Am J Respir Crit Care Med,2012,185:A4954
(2013-09-23收稿 责任编辑赵秋民)
Effects of proteasome activator PA28α on apoptosis and cell cycle of ESCC cells
1)SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)LaboratoryforCellBiology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
PA28α;ESCC;cell cycle;cell apoptosis
Aim: To investigate the effects of PA28α on apoptosis and cell cycle of ESCC. Methods: A recombinant vector pCMV-Myc-PA28α was constructed and then transfected into ESCC cell lines EC9706 and Eca109 cells using LipofectaminTM2000. ESCC cells transfected with pCMV-Myc were served as control. The subcellular localization of PA28α was observed using immunofluorescence. The protein level of PA28α in transfected cells was examined by Western blot. The effects of PA28α on the apoptosis and cell cycle of ESCC were investigated by Annexin V-FITC/PI Flow Cytometry. Results: The fluorescence of PA28α protein was detected mainly in the cytoplasm of ESCC cells. Compared with the control group, the protein expression of PA28α in EC9706 cells transfected with pCMV-Myc-PA28α increased significantly(F=984.411,P<0.001).Compared with the control group,the numder of EC9706 cells in S phase transfected with pCMV-Myc-PA28α inereased as well(F=24.592,P<0.001).The apoptosis cells proportion of the cells transfected with pCMV-Myc-PA28α was much lower than the control group(F=1 448.569,P<0.001). Conclusion: PA28α serves as a key componant in ESCC, which may be a potential therapeutic target for ESCC.
10.13705/j.issn.1671-6825.2014.04.001
*国家自然科学基金资助项目 30700140;科技部国际科技合作基金资助项目 2007DFA01240
R735.1
