新型醋酸优力司特衍生物的合成*
2014-08-30陈正帮甘海峰冯卫杨
陈正帮,甘海峰,冯卫杨,黄 雨,郭 凯
(南京工业大学 生物与制药工程学院,江苏 南京 211816)
·制药技术·
新型醋酸优力司特衍生物的合成*
陈正帮,甘海峰,冯卫杨,黄 雨,郭 凯
(南京工业大学 生物与制药工程学院,江苏 南京 211816)
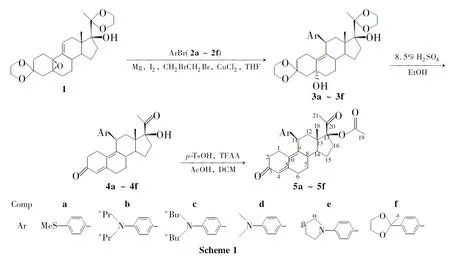
以3,20-双(亚乙二氧基)-17α-羟基-5α,10α-环氧-19-去甲基孕甾-9(11)-烯为起始原料,与芳基溴经格氏加成反应得3,20-双(亚乙二氧基)-5α,17α-羟基-11β-芳基-19-去甲基孕甾-9-烯(3a~3f);3a~3f经羰基脱保护、水分子消除和乙酰化反应合成了6个新型的醋酸优力司特衍生物,其结构经1H NMR,IR,MS和HR-ESI-MS表征。
醋酸优力司特;格式反应;合成
醋酸优力司特(UPA)于2010年由美国FDA批准,是一种选择性孕激素受体调节剂,可以在无保护性交或性交保护失败后120h内服药,且紧急避孕效力不会随用药时间延迟而下降[1]。另外,UPA不会对人的正常乳腺组织产生影响[2],且目前没有关于其衍生物合成的报道。近来,研究发现UPA的11β-位苯环上的取代基对其抗激素活性具有很大的影响[3]。
本文参考文献[4-7]方法设计了在UPA的11β-位引入对取代苯基合成一系列醋酸优力司特衍生物。以3,20-双(亚乙二氧基)-17α-羟基-5α,10α-环氧-19-去甲基孕甾-9(11)-烯(1)为起始原料,与芳基溴(2a~2f)经格氏加成反应制得3,20-双(亚乙二氧基)-5α,17α-羟基-11β-芳基-19-去甲基孕甾-9-烯(3a~3f);3a~3f经羰基脱保护、水分子消除和乙酰化反应合成了6个新型的醋酸优力司特衍生物(5a~5f,Scheme 1),其结构经1H NMR,IR,MS和HR-ESI-MS表征。期待5有较好的药理活性。
1 实验部分
1.1 仪器与试剂
WRS-1B型熔点仪(温度未校正);Bruker AV 500MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Tensor 27FT-IR型红外光谱仪(KBr压片);Agilent Q-TOF 6520型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1)3a~3f的合成(以3a为例)
在反应瓶中依次加入Mg 148mg(6mmol)和THF 2mL,搅拌使其溶解;加入I2一粒,二溴乙烷4μL,搅拌下于60℃反应1.5h。缓慢滴入1-溴-4-(甲硫基)苯(2a)1.128g(6mmol)的THF(5mL)溶液,滴毕,回流反应2h。冷却至室温,加入CuCl260mg(0.6mmol),搅拌下于室温反应0.5h。缓慢滴入10.5g(1.2mmol)的THF(4mL)溶液,滴毕,反应2h。缓慢滴入NH4Cl 1.63g的水(9mL)溶液,滴毕,反应0.5h。分液,水相用二氯甲烷(9mL)洗涤,合并有机相和洗液,依次用溶液(NH4Cl 1g+水9.6mL)和水(5.5mL)洗涤,无水硫酸钠干燥,浓缩后经液相色谱柱纯化得白色固体3a425mg,产率65.34%。
用类似方法合成3b~3f。
(2)4a~4f的合成(以4a为例)
在反应瓶中依次加入8.5wt%H2SO41.25mL和乙醇12.5mL,搅拌使其溶解;氮气保护下于室温反应0.5h。加入3a0.32g(0.64mmol),回流反应2h。冷却至0℃,用4.5mol·L-1碳酸钾溶液调至pH9,加水20mL和二氯甲烷20mL,分液,水相10mL二氯甲烷洗涤,合并有机相和洗液,用水(10mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:A=V(DCM)∶V(EA)=4∶1]纯化得黄色固体4a0.133g,产率53.2%。
用类似方法合成4b~4f。
(3)5a~5e的合成(以5a为例)
在反应瓶中依次加入三氟乙酸酐(TFAA)0.86mL,乙酸0.35mL和二氯甲烷(DCM)10mL,搅拌使其溶解;反应0.5h。冷却至0℃,加入对甲苯磺酸(p-TsOH)53.7mg,于0℃缓慢滴加4a133mg(0.305mmol)的DCM(5mL)溶液,滴毕,于室温反应1h。用4.5mol·L-1碳酸钾溶液调至pH10,加水10mL,分液,水相用DCM(2×10mL)洗涤,合并有机相和洗液,用水(15mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析(A=20∶1)纯化得黄色固体5a70mg。
用类似方法合成淡黄色固体5b~5e。
17α-乙酰氧基-11β-(4-甲硫基苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5a): 产率70%,m.p.233℃~235℃;1H NMRδ: 0.34(s,3H,18-H),2.08(s,3H,19-H),2.13(s,3H,21-H),2.43(s,3H,CH3S),4.41(d,J=7.3Hz,1H,11-H),5.79(s,1H,4-H),7.06(d,J=8.3Hz,ArH),7.16(d,J=8.3Hz,ArH);13C NMRδ: 203.5,199.0,170.3,155.9,144.3,141.0,135.8,129.6,127.1,126.9,123.1,95.8,50.6,46.9,39.7,38.2,36.8,36.6,30.9,30.2,27.7,26.8,25.7,24.0,21.1,15.7,15.5;IRν:2927,1731,1661,1594,1397,1249cm-1;MSm/z(%): 501.2{[M+Na]+,74};HR-ESI-MSm/z: Calcd for C29H34O4SNa{[M+Na]+}501.2070,found 501.2096。
17α-乙酰氧基-11β-(4-(N,N-二丙基氨基)苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5b): 产率52.9%,m.p.173℃~175℃;1H NMRδ: 0.38(s,3H,18-H),0.90(t,J=7.5Hz,6H,CH3in Pr),1.53~1.59(m,4H,CH2in Pr),2.09(s,3H,19-H),2.12(s,3H,21-H),3.17(t,J=7.5Hz,4H,CH2in Pr),4.36(d,J=6.5Hz,1H,11-H),5.77(s,1H,4-H),6.52(d,J=8.8Hz,ArH),6.91(d,J=8.8Hz,ArH);13C NMRδ: 203.6,199.3,170.5,156.4,146.3,145.8,129.7,129.1,127.2,122.8,111.8,96.2,52.8,50.9,47.0,39.2,38.2,36.8,36.5,30.9,30.2,27.7,26.7,25.7,24.1,21.1,20.3,15.6,11.3;IRν:2927,1733,1662,1514,1396,1246cm-1;MSm/z(%): 532.3[M+,92];HR-ESI-MSm/z: Calcd for C34H46NO4{[M+H]+}532.3421,found 532.3498。
17α-乙酰氧基-11β-(4-(N,N-二丁基氨基)苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5c): 产率53.4%,m.p.176℃~178℃;1H NMRδ: 0.38(s,3H,18-H),0.94(t,J=7.3Hz,6H,CH3in Bu),1.31~1.38(m,4H,CH2in Bu),1.50~1.56(m,4H,CH2in Bu),2.10(s,3H,19-H),2.12(s,3H,21-H),3.20(t,J=7.5Hz,4H,CH2in Bu),4.36(d,J=7.0Hz,1H,11-H),5.77(s,1H,4-H),6.52(d,J=8.5Hz,ArH),6.91(d,J=8.5Hz,ArH);13C NMRδ: 203.6,199.4,170.5,156.5,146.3,145.8,129.6,129.1,127.2,122.8,111.8,96.2,51.0,50.7,47.0,39.2,38.2,36.8,36.5,30.9,30.2,29.3,27.7,26.7,25.7,24.1,21.1,20.2,15.6,13.9;IRν:2925,1729,1713,1616,1513,1397cm-1;MSm/z(%): 560.4[M+,82];HR-ESI-MSm/z: Calcd for C36H50NO4{[M+H]+}560.3734,found 560.3785。
17α-乙酰氧基-11β-(4-N,N-二甲基氨基苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5d): 产率36.8%,m.p.183℃~185℃;1H NMRδ: 0.36(s,3H,18-H),2.09(s,3H,19-H),2.12(s,3H,21-H),2.87[s,6H,N(CH3)2],4.39(d,J=7.0Hz,1H,11- H),5.77(br s,1H,4-H),6.64(d,J=8.5Hz,2H,ArH),6.98(d,J=8.5Hz,2H,ArH);13C NMRδ: 203.6,199.3,170.5,156.4,148.7,145.5,131.5,129.3,127.3,123.0,112.8,96.2,50.9,47.0,40.5,39.4,38.3,36.8,31.0,30.2,27.8,26.8,25.8,24.2,21.2,15.6;IRν:2946,1736,1713,1665,1562,1518,1440,1352,1253cm-1;MSm/z(%): 476.3[M+,87];HR-ESI-MSm/z: Calcd for C30H38NO4{[M+H]+}476.2795,found 476.2802。
17α-乙酰氧基-11β-(4-(N-四氢吡咯基)苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5e): 产率62%,m.p.150℃~152℃;1H NMRδ: 0.38(s,3H,18-H),1.95~1.99(m,4H,β-H),2.09(s,3H,19-H),2.13(s,3H,21-H),3.23~3.27(m,4H,α-H),4.39(d,J=7.0Hz,1H,11-H),5.77(s,1H,4-H),6.52(d,J=8.3Hz,ArH),6.97(d,J=8.3Hz,ArH);13C NMRδ: 203.6,199.3,170.5,156.5,145.9,145.7,129.1,127.3,122.8,111.7,96.2,50.9,47.5,47.0,39.4,38.3,36.8,31.0,30.2,29.6,27.8,26.7,25.7,25.3,24.1,21.1,15.5;IRν:2927,1732,1655,1615,1517,1392,1249cm-1;MSm/z(%): 502.3[M+,64];HR-ESI-MSm/z: Calcd for C32H40NO4{[M+H]+}502.2952,found 502.2977。
(4)5f的合成
在反应瓶中依次加入TFAA 0.391mL,乙酸0.173mL和DCM 4mL,搅拌使其溶解;反应0.5h。冷却至0℃,加入p-TsOH 21mg,于0℃缓慢滴加4f0.06g(0.138mmol)的DCM(2mL)溶液,滴毕,于室温反应1h。用4.5mol·L-1碳酸钾溶液调至pH10,加水5mL,分液,水相用二氯甲烷(2×5mL)洗涤,合并有机相和洗液,用水(10mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析(A=9∶1)纯化得黄色固体17α-乙酰氧基-11β-(4-乙酰基苯基)-19-去甲基孕甾-4,9-二烯-3,20-二酮(5f)41mg,产率62.7%,m.p.243℃~245℃;1H NMRδ: 0.31(s,3H,18-H),2.10(s,3H,19-H),2.13(s,3H,21-H),2.57(s,3H,α-H),4.50(d,J=8.0Hz,1H,11-H),5.81(s,1H,4-H),7.26(d,J=8.5Hz,ArH),7.87(d,J=8.5Hz,ArH);13C NMRδ: 203.5,198.8,170.4,155.7,150.1,143.5,135.2,130.2,128.8,127.0,123.5,95.8,50.7,47.0,40.4,38.4,37.0,36.7,31.0,30.3,27.8,27.0,26.4,25.8,24.1,21.2,15.6;IRν:2930,1733,1662,1608,1515,1392,1245cm-1;MSm/z(%): 497.2[M+,42];HR-ESI-MSm/z: Calcd for C30H34O5Na{[M+Na]+}497.2298,found 497.2299。
2 结果与讨论
2.1 合成与表征
通过对新一代甾体避孕药醋酸优力司特的结构进行合成和分析研究后,通过改变其部分结构,设计并合成了6种新型的醋酸优力司特衍生物。
在3的合成中,格氏反应须在严格无水和氮气保护条件下进行,在格氏试剂引发时加入少量的1,2-二溴乙烷,加入一粒碘使引发更容易进行,因为碘的活性比溴更强。
IR分析表明,5中C-N基团或C-S基团的吸收峰在1203cm-1~1351cm-1,苯基的吸收峰位于1660cm-1~1739cm-1。5的1H NMR分析表明,5.77~5.81处吸收峰为CH=的质子峰,2.08~2.13处吸收峰为19-H吸收峰,0.90~0.94,1.31~1.38,1.51~1.59和3.17~3.20处吸收峰分别为Prn或Bun的质子吸收峰,1.95~1.99和3.23~3.27处吸收峰为N-吡咯基上的质子峰,2.4和2.57处分别为4-甲硫基和4-乙酰基上的质子峰。13C NMR分析表明,122.7~123.1处吸收峰归属C4,170.3~170.5处吸收峰归属17α-OAc中的羰基碳。5的MS数据理论值一致。
以上分析结果与5预期结构吻合,表明5为Scheme 1预期产物。
[1] Glasier A F,Cameron S T,Fine P M,etal.Ulipristal acetate versus levonorgestrel for emergency contraception:A randomised non-inferiority trial and meta-analysis[J].Lancet,2010,375(9714):555-562.
[2] Communal L,Vilasco M,Hugon-Rodin J,etal.Ulipristal acetate does not impact human normal breast tissue[J].Hum Reprod,2012,27(9):2785-2798.
[3] Hyun K K,Richard P B,Pemmaraju N R,etal.Structural modification of 19-norprogesterone I:17-α-substituted-11-β-substituted-4-aryl and 21-substituted 19-norpregnadienedione as new antiprogestational agents[P].US 20056900193B1,2005.
[4] 何元.双丁二酮化合物、铕配合物、含该配合物的组合物及其用途[P].2005100429197,2008.
[5] Verardo G,Giumanini A G,Strazzolini P,etal.New experiments in the reductiveN-alkylation andN-peralkylation of aromatic amines[J].Syn Commun,1994,24(5):609-627.
[6] Ju Y H,Varma R S.Studies on some heterocyclic enities[J].J Org Chem,2006,71(1):135-141.
[7] Pemmaraju N R,Martin L B,James E B,etal.A practical large-scale synthesis of 17a-acetoxy-11b-(4-N,N-dimethylaminophenyl)-19-norpregna-4,9-diene-3,20-dione[J].Steroids,65(2000):395-400.
SynthesisofNovelUlipristalAcetateDerivatives
CHEN Zheng-bang, GAN Hai-feng, FENG Wei-yang, HUANG Yu, GUO Kai
(College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 211816,China)
3,20-Bis-ethyl-enedioxy-5α,17α-hydroxy-11β-aryl-19-norpregne-9-ene(3a~3f)were prepared by Grignard reaction of 3,20-bis-ethylenedioxy-17α-hydroxy-5α,10α-epoxy-19-norpregne-9(11)-ene with aryl bromide.Six novel Ulipristal acetate derivatives were synthesized by deprotection of carbonyl group and removal of a molecule water to form an olefinic bond and then acetylation from3a~3f.The structures were characterized by1H NMR,IR,MS and HR-ESI-MS.
Ulipristal acetate;Grignard reaction;synthesis
2014-02-18
中国国家高技术研究发展计划863项目(2012AA02A701)
陈正帮(1989-),男,汉族,安徽六安人,硕士研究生,主要从事药物合成的研究。E-mail: zhengbangchen@163.com
郭凯,教授,Tel.025-58139926,E-mail: kaiguo@njtech.edu.cn
O629.2;O621.3;R914.5
A
1005-1511(2014)05-0698-04
