通用高分子材料的化学和生物改性及其血液相容性研究
2014-08-29栾世方石恒冲殷敬华李勇刚
石 强,栾世方,金 晶,石恒冲,殷敬华,李勇刚
(1.中国科学院长春应用化学研究所 高分子物理与化学国家重点实验室,吉林 长春 130022)(2.威高集团有限公司,山东 威海 264209)
1 前 言
近年来,量大面广的通用高分子材料通过不断地升级改造,成本大幅度降低,使用性能明显提高。各类新型的、适应现代技术发展的高分子材料不断涌现,其中研发与血液接触的医用高分子材料是通用高分子发展的重要方向之一[1]。以此类高分子材料为原料制备的医疗器械主要包括血管导管、血管支架、人工心脏瓣膜、循环支持设备、各种体外循环管、血液透析、肺膜等。由于与血液长期接触,原料的选择需要考虑以下因素:力学性能、稳定性、渗透性、可加工性、价格、非毒性、易于消毒和可以接受的血液相容性[2]。通用高分子材料,如聚烯烃和热塑性弹性体,具有良好的物理、化学和加工性能,且无毒、生物稳定性高。但大部分高分子材料呈现非极性,表面能低,亲水性差,与血液接触后会发生凝血、溶血现象。提高通用高分子材料的生物相容性,特别是血液相容性已成为开发医用高分子材料的关键问题[3]。近年来,通用高分子材料的血液相容性研究取得了明显的成果。本文介绍了医用材料的血液相容性,重点评述了通用高分子材料的化学和生物改性及其血液相容性研究进展。
2 血液相容性
血液相容性指生物医学材料与血液接触后,产生符合要求的生物学反应和起有效作用的功能[1],也是评估生物材料对血液破坏作用的量度。包括是否导致凝血及血栓形成、补体系统激活和白细胞活化及红细胞破坏等[4],这些作用同时发生又相互影响,如图1所示。材料与血液的作用研究虽然取得了一定的进展,但作用机制目前还不完全清楚,有待于深入、系统的研究。
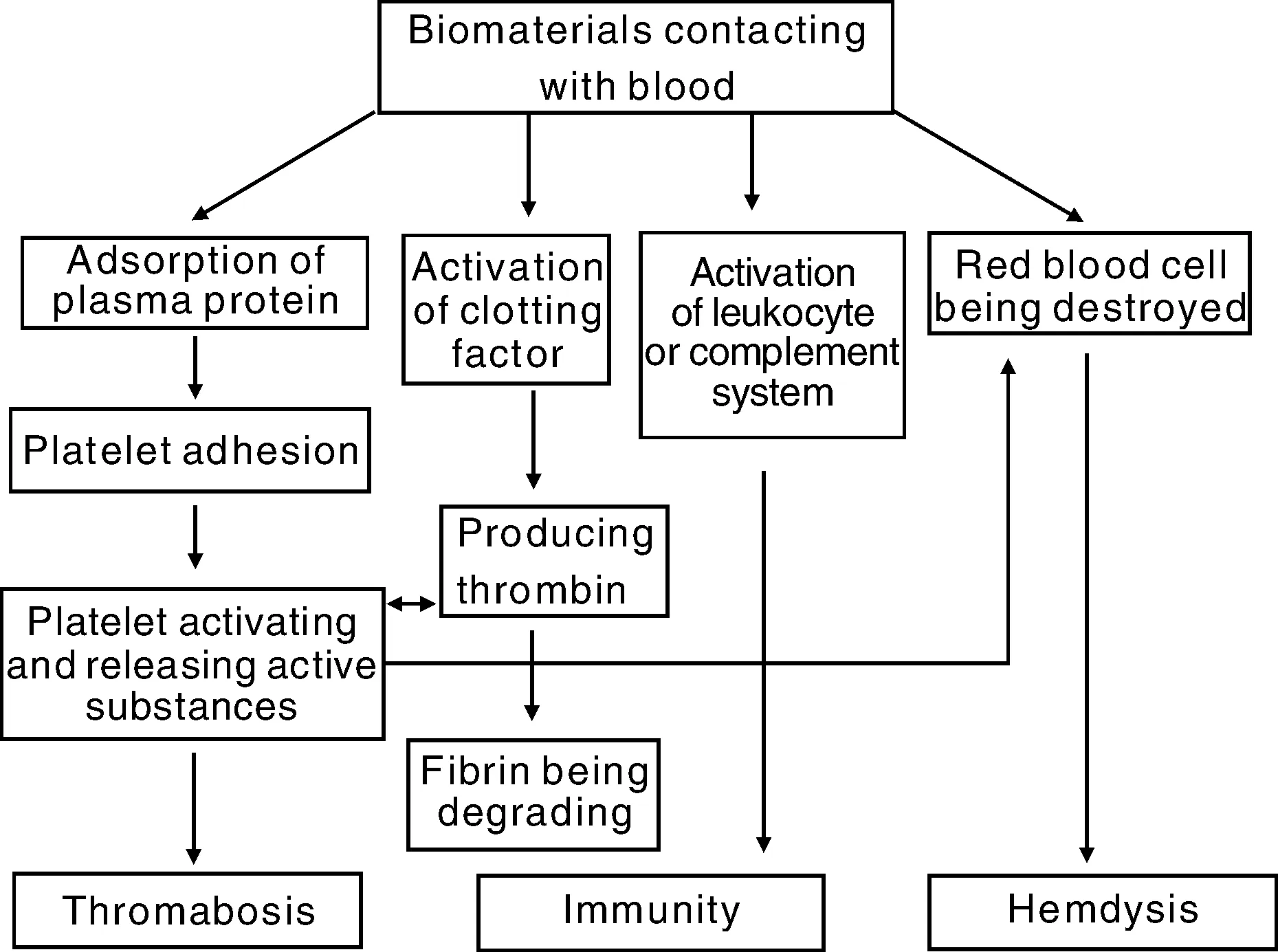
图1 生物材料对血液的作用Fig.1 Effects of biomaterials on blood
2.1 凝血及血栓形成
人体内正常生理凝血包括内源性凝血和外源性凝血。血管内皮受损或血液接触异物所引起的血液凝固为内源性凝血,而机体组织或血管受损释放组织因子进入血液所引起的血液凝固为外源性凝血,通常认为生物材料与血液接触时所引起的血液凝固以内源性途径为主[5]。
2.1.1 血浆蛋白吸附
当生物材料与血液接触时,瞬间会在其表面形成一层血浆蛋白吸附膜。生物材料表面吸附蛋白的种类和数量一般由材料表面的性能及拓扑结构决定,如表面的化学性质、表面能、正负电荷的分布、亲疏水性质、表面几何形状和粗糙度等。蛋白吸附层的组成、构象以及蛋白质的性能直接影响材料的血液相容性[6]。通常情况下,材料表面主要吸附纤维蛋白原或C球蛋白。纤维蛋白原分子量为340 kDa,由α、β和γ肽链构成[7],肽链可以与若干种蛋白和细胞发生特定粘附作用,比如:α肽链可以粘附含有RGD的整联蛋白(Integrin),β肽链倾向于与肝素和钙粘蛋白发生作用,γ肽链易于与血小板膜蛋白产生粘附。当纤维蛋白原吸附到材料表面后首先发生构象改变,使肽链曝露,从而促使血小板粘附和激活而形成血栓,并激活白细胞诱发炎症反应。
2.1.2 血小板的激活和粘附
血小板的粘附与激活是血液相容性研究的重要方面。血小板是血液中的无核细胞,呈圆盘形,平均直径为2~4 μm,厚度约 0.2~1.5 μm。血小板由细胞质和细胞膜组成,细胞膜主要由类脂双分子层和糖蛋白构成,其含有与血小板粘附和聚集功能密切相关的一些重要受体,如: 糖蛋白αIIbβ3和GPIb。目前,血小板的激活和粘附机理还不完全清楚。多数认为血小板首先与吸附在材料表面的纤维蛋白原结合,使血小板粘附到材料的表面,然后发生聚集与扩展。在此过程中,血小板发生从圆形、表面凸起、伪足到收缩形态的变化[8]。同时,释放一些生物活性物质,如P选择素、β-TG、VWF 因子、组胺、5-羟色胺、三磷酸腺苷(ADP)等,释放的ADP可以诱导更多的血小板粘附、变形、扩展、聚集并释放出生物活性物质[9]。活性物质可激活凝血酶原促进凝血,激活补体系统和白细胞等发生炎症反应,并可能造成红细胞溶血。
2.1.3 凝血因子活化与凝血酶产生
当材料与血液接触时,凝血因子活化与血浆蛋白粘附同时发生。血浆中的凝血因子XII首先激活变为凝血因子XIIa,少量的XIIa可激活激肽释放酶原转变成激肽释放酶; 后者又可以激活因子XII,促使凝血因子XIIa大量生成,XIIa 继续激活其它凝血因子,通过酶促反应使凝血酶原转变为凝血酶[10]。凝血酶有多方面的功能:可以加速凝血因子VII复合物与凝血酶原复合物的形成;激活V因子、VIII因子和XI因子,促进凝血因子XIII生成XIIIa;催化纤维蛋白原的分解,使纤维蛋白原分子从N-端脱下四段小分子肽链,变成纤维蛋白单体,纤维蛋白单体相互交织在一起,并与红细胞、白细胞、血小板以及其他成分形成网状结构,在血小板肌钙蛋白的收缩作用下形成坚实的血栓。
2.2 补体系统激活和白细胞活化
补体系统是指由大约30种存在于血清、组织液中的蛋白质共同组成的反应系统,主要功能是通过在病原体表面的作用,破坏其细胞膜或者“调理”病原体表面供巨噬细胞吞食,并能引起免疫反应,一般通过经典途径、旁路途径和凝集素途径激活。当材料与血液接触时,补体蛋白C3在材料表面沉积,活化后续的补体蛋白,释放血小板激活因子,促进血小板粘附、聚集;激活的补体蛋白还可以参与血栓形成。同时,白细胞通过补体受体( CR1、CD35)与C3b 结合粘附到材料表面而被激活,进而引发人体的免疫反应[11]。
2.3 溶血
材料与血液长时间接触还会造成红细胞的溶血。材料主要通过3个途径对红细胞溶血产生作用:本身的毒性损害细胞膜;表面与红细胞接触时造成的细胞膜损害;加速红细胞的氧化和老化进程[12-13]。溶血是红细胞破裂,血红蛋白释放到血浆中的现象,本质上是细胞膜损害和血红蛋白氧化的结果[14]。红细胞是一种含血红蛋白的无核细胞,通过葡萄糖合成能量。其细胞膜主要由蛋白质(49.3%)、脂质(42%)、糖类(8%)和无机离子构成,具有不对称性、流动性以及特殊的功能,如物质运输(离子运输、水运输、葡萄糖转运)、细胞膜的抗原性(血型抗原、老化抗原等)、红细胞的变形性等。血红蛋白是成熟红细胞中的主要蛋白,占细胞干重的96%,占细胞容积的35%。血红蛋白由四条非共价结合的球蛋白链组成,每条链结合一个血红素基团,是血红蛋白分子与氧分子的结合点。因此,血红蛋白赋予红细胞携带氧气、运输二氧化碳、维持体内平衡的生理功能。红细胞膜损害和血红蛋白氧化变性后就会发生溶血,造成细胞膜的变形性、携氧和输送二氧化碳的生理功能显著降低[15]。
3 通用高分子材料的本体改性
医疗器械的安全性和耐用性需要通用高分子具备一定的力学性能、加工性能、生物稳定性和生物相容性。本体材料的化学和生物改性可提高基体材料的血液相容性,并根据实际要求,可加工制备成不同形状和尺寸的医疗器械。本体改性主要包括反应接枝和共混方法[16-22]。
3.1 反应接枝方法
反应接枝方法在通用高分子材料基体上引入高血液相容性的小分子,在不改变通用高分子基体材料的性能基础上,提高材料的血液相容性。功能单体需要在高温下接枝聚合,并保持结构稳定、而且具有一定的反应活性。常见的功能单体包括聚乙二醇酯类单体和2-乙烯基吡啶等[16-18]。常用引发剂包括过氧化物类和偶氮类引发剂,以及预辐照方法原位生成的大分子引发剂。
Yin等人利用部分预辐照的PP作为大分子自由基引发剂,采用反应加工的方法在PP分子链上引入具有生物相容性的PEG支链[16]。其优点为:工艺简单、接枝链的分布均匀、无需添加小分子过氧化物引发剂、有效抑制了基体树脂降解、保持了力学性能。相对PP,接枝产物的接触角随PEG接枝率的增加而下降(从112.2°降低到88.2°),表面能则随接枝率的增加而升高(从15.85 mJ/m2增加到30.34 mJ/m2)。血小板粘附实验表明,接枝后PP膜表面粘附的血小板量显著减少,说明接枝的PEG增加了PP膜血液相容性。
反应接枝虽然简便,但存在两个问题:①亲水性单体由于空间位阻使得接枝程度受限,接枝效率很难提高[17-18],②由于接枝单体表面能高,接枝单体不容易迁移到材料表面,因而材料表面的亲水性与本体接枝率并不呈现线性变化[19-20]。
为提高本体材料的接枝率,Yin等人采用聚烯烃基吡咯烷酮(NVP)作为氢化苯乙烯热塑性弹性体(SEBS)接枝甲基丙烯酸聚乙二醇单甲基醚(PEGM)的共接枝单体。与SEBS单独接枝PEGM相比,NVP辅助接枝后PEGM接枝率提高近5倍[18]。接枝反应过程中,SEBS的分子量没有发生明显的交联或降解副反应,SEBS接枝物的杨氏模量、拉伸强度和断裂伸长率与SEBS的力学性质十分接近。NVP辅助接枝PEGM的反应机理如图2所示,当SEBS大分子自由基形成以后,由于NVP单体与大分子引发剂的反应活性比较高,同时其分子比较小,空间位阻的影响也较弱, NVP首先与大分子自由基反应,形成P-g-NVP·,NVP自由基与甲基丙烯酸酯类单体有较高的反应活性, NVP大分子自由基主要与PEGM单体进行反应,形成P-g-NVP-PEGM·,继续引发反应。在接枝反应过程中,吡咯烷酮会部分地转化形成琥珀酰亚胺,以此同时,稳定的中间产物吡咯烷酮过氧化物PNVP-OOH也会形成,伴随着也有PNVP-OH。PNVP-OOH能够引发有效的交联,足够的大分子自由基能够形成稳定的结构。

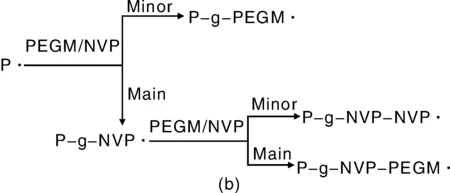
图2 NVP辅助PEGM接枝SEBS反应动力学(a)和机理(b)Fig.2 Kinetics(a) and mechanism(b) of NVP-assistant grafting of PEGM onto SEBS
NVP辅助接枝的样品,不仅接枝率较高,而且显示较好的抗蛋白吸附能力和抗血小板粘附能力。
为使材料表面富含亲水性单体,采用溶剂诱导的方法将亲水性单体诱导至材料表面,进而提高其血液相容性[19-20]。Yin等人将反应接枝与溶剂诱导相结合制备了高血液相容性的高分子表面。他们将PEGMEMA接枝后的聚丙烯悬涂成膜,在空气中退火4 h,然后置于水中诱导24 h。悬涂膜表面的水接触角大约98°,在成膜过程中,接枝链容易进入膜内部,使膜表面的接枝链浓度降低,水接触角大约102°。通过溶剂诱导方法,可以将接枝链重新牵引至膜表面,水接触角大约78°,进而构建了高血液相容性的聚烯烃膜材料,接枝链迁移过程通过氧元素含量的变化来证实,如图3所示。图4是材料表面原子力显微镜(AFM)照片。水诱导24 h后,膜表面微结构从无序转变为明暗相间的图案(图4a);局部放大的照片(图4b)显示膜表面有半径为5~10 nm,深度为2~3 nm的小孔,证实了诱导过程的发生,其接枝链已诱导至膜表面(如图4c,d),图4c,d是分别与图4a,b对应的相图。根据实验结果,他们提出表面诱导的分子机制,如图5所示。由于表面自由能的差距,接枝链在悬涂膜中不是均匀分布,而是从内部向表面梯度分布。退火后,在膜近表层的接枝链聚集在一起,局部浓度较高;采用水诱导后,通过水分子与接枝链的相互作用,使接枝链在膜表面富集,并形成了小孔结构。

图3 水诱导过程中[O]/[C]随材料表面与水接触角的变化Fig.3 [O]/[C] versus contact angle for induction process with water in water phase

图4 改性高分子材料表面形貌的AFM照片:(a)是诱导24 h后AFM高度图,(b)是局部放大的AFM高度图,(c)和(d)是与(a)和(b)对应的相图Fig.4 AFM micrographs of modified commodity polymers:(a)height image of the film after solvent induction for 24 h, (b)height image of an enlarged area of(a),(c) and (d) are phase images of (a) and (b), respectively
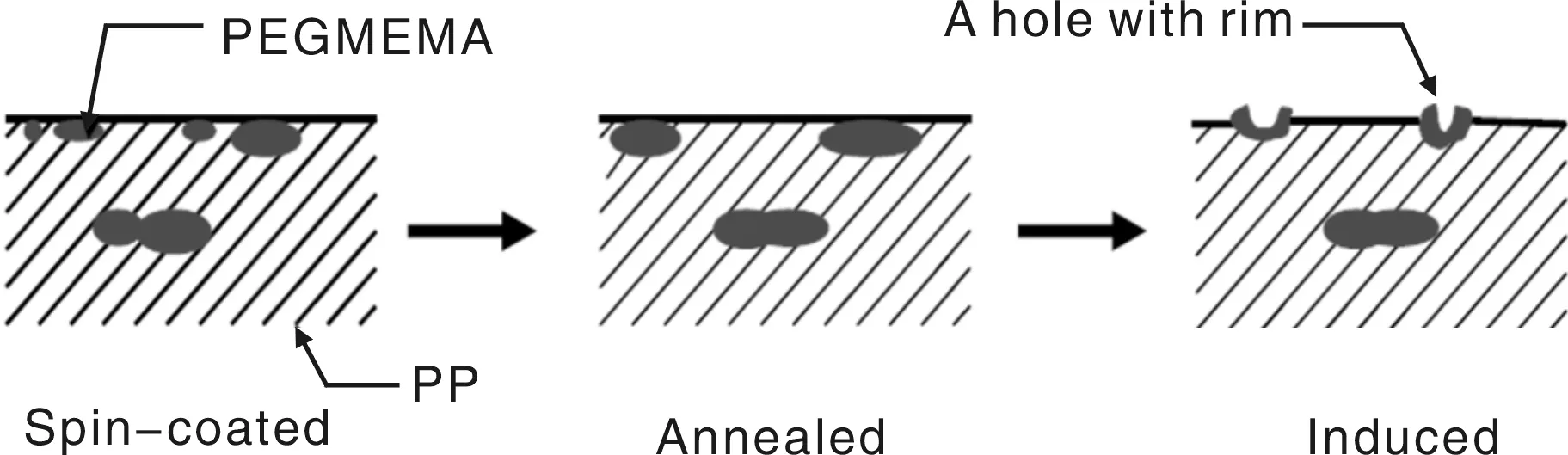
图5 水相诱导单体到材料表面富集的原理Fig.5 Principle diagram of inducing envichment of monomers to polymer surfaces in water phase
比较聚丙烯及其接枝物处理前后蛋白质吸附量发现,纯聚丙烯吸附大量的蛋白质;接枝物蛋白质吸附量略微减少;接枝物经过处理以后,蛋白质吸附量显著降低。血小板粘附实验表明,纯聚丙烯表面粘附了大量的血小板,而且血小板处于激活状态;接枝物表面仍有一些激活的血小板;相比而言,处理后的接枝物表面基本没有粘附的血小板,证明构建了高生物相容性的表面[20]。
3.2 共混方法
随着医疗技术的发展,要求医用材料同时具备多方面的优良性能。单一高分子材料很难满足这一要求,因此采用共混方法提高通用高分子材料的性能和生物相容性成为人们的首选[21-27]。共混法是将通用高分子基体材料与高生物相容性的聚合物通过界面反应,提高共混物之间的相容性,从而提高共混物的力学性能、加工性能和血液相容性。常用的高生物相容性的聚合物包括:聚乙二醇和聚磷酸胆碱。
聚乙二醇(PEG)是用来提高血液相容性的常见组分,一般由环氧乙烷开环聚合得到,根据生产工艺路线的不同,也称作聚氧化乙烯 (PEO)。1940 年由美国陶氏(DOW) 公司商业化生产,因其具备优良的保湿性、润滑性、分散、粘结性和生物相容性,被广泛应用于食品、医药、化工和生物材料等行业。PEG与通用高分子共混可以提高材料的亲水性和生物相容性,并通过其结晶行为影响材料的力学性能[22]。
Xu等人[23]采用红外光谱(FTIR-ATR ) 和扫描电镜(SEM)研究了极性组分聚乙二醇在聚乙烯/ 聚乙二醇共混物中的表面富集特性,发现不同组分表面自由能的差异以及聚乙烯基体的结晶异相排斤作用是导致聚乙二醇组分向共混物表面富集的主要驱动力,而极性组分相区的大小和分布则是影响其选择性迁移过程的重要因素。聚乙二醇组分在材料表面富集能有效改善材料的亲水性和血液相容性,因此,可以通过添加合适相容剂的办法对聚乙二醇组分的表面富集程度进行有效的调控,进而调控血液相容性。
Leung 等人[24]采用原子力显微镜(AFM)和X光激发电子显微镜(XPEEM)研究了聚苯乙烯与聚乙二醇共混物的相行为和蛋白质吸附行为。研究结果表明:聚苯乙烯与聚乙二醇并未完全相分离,富集在PS表面的聚乙二醇降低了蛋白质的吸附量,而33% PS组分停留在聚乙二醇相,可以引起大约0.7~1 nm人血清白蛋白的吸附。
磷脂分子是细胞膜骨架结构的主要组成成分,而磷酸胆碱是组成细胞膜的基本单元的亲水端基,是细胞外层膜中的基团。根据生物仿生原理,磷酸胆碱聚合物能够降低蛋白质在材料表面的吸附,提高材料表面的血液相容性。其中,2-甲基丙烯酰氧乙基-2-(三甲氨基)乙基磷酸盐(MPC)的聚合物作为最具代表性的磷酸胆碱聚合物成为近年来研究的热点[25-27]。
Ishihara等人将磷酸胆碱聚合物(聚2-甲基丙烯酰氧基磷酰胆碱)与聚乙烯共混,用于提高聚乙烯的血液相容性。合金膜通过X光电子能谱,动态接触角等方法进行表征,发现PMPC不仅分散在PE/PMPC合金膜内部,也分散PE/PMPC合金膜外层。经过热处理后,PE/PMPC合金膜的力学性能、抗蛋白吸附、抗血小板粘附性能得到较大提高,如图6所示,PE/PMPC合金膜因而可能成为聚氯乙烯(PVC)的替代产品。磷酸胆碱聚合物还与聚脲(Poly(Ester Urethane)Urea)和聚砜共混,分别提高了其生物相容性[25-27]。

图6 PE/PMPC合金膜制备过程不同阶段的SEM照片Fig.6 SEM images of PE/PMPC alloy membrane during membrane forming process
4 通用高分子材料的表面改性
血液相容性与材料的表面性质密切有关,调控材料表面和界面性质来提高材料血液相容性是一种有效的手段[28-40]。材料表面性质主要考虑表面亲水性,表面电荷,表面粗糙度等因素。目前广泛使用的方法包括:①在材料表面形成聚合物刷或亲水层,减少血液成分与材料表面的接触,维持蛋白质正常的构象;②在材料表面固定生物活性分子,可以与血液中成分相互作用,抗凝血和溶血发生;③在材料表面形成生物仿生膜,提高血液相容性。
4.1 形成惰性表面
通过化学接枝方法将亲水性单体接枝到通用高分子材料表面而形成一种长链亲水性钝化层。常用的接枝单体包括长链聚乙二醇类化合物,2-羟乙基甲基丙烯酸酯,磺基甲基丙烯酸酯等。该钝化层能有效减少血浆蛋白和血小板在材料表面的粘附,并能减轻材料表面非特异性吸附引起的各种不良反应,有效地提高了材料表面的生物相容性[28-31]。
Chen等合成了带有Si-H基团的有机硅橡胶(PDMS),并利用F3CSO3H将PEG接枝到PDMS表面,制备过程如图7所示。改性后的表面有效抑制了血浆蛋白的非特异性吸附:在浓度为1 mg/mL 纤维蛋白原缓冲溶液中,未改性PDMS表面纤维蛋白原吸附量为580 ng/cm2,而改性后表面纤维蛋白原吸附降至40 ng/cm2[28]。
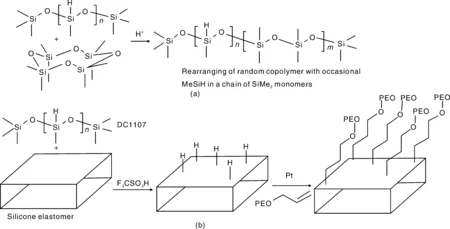
图7 有机硅橡胶的线性链重排(a)和表面接枝PEG过程(b)Fig.7 Redistribution of PDMS linear chain(a) and schematic of grafting PEG on surface(b)
Yin等采用等离子体和紫外辐照相结合的方法,将乙烯基吡咯烷酮(NVP)接枝到SEBS[29]。通过XPS、静态水接触角、原子力显微镜等手段对表面结构进行了表征。由于亲水层聚合物的存在及其特殊微观结构,SEBS表面的亲水性和生物相容性得到明显改善。
4.2 引入生物活性物质
在形成惰性表面的基础上,引入某些生物活性物质,如肝素、白蛋白、赖氨酸等,可以选择性吸附或结合特定的生物大分子,与血液成分发挥有效相互作用,调控血液相容性[32-37]。
肝素是一种具有较强抗凝血作用的天然凝血抑制剂[32]。传统方法是利用间隔臂分子将其固定在高分子表面,步骤较多,效率较低。You等采用一种新方法,利用多巴胺作为粘合剂,将肝素接枝到聚氨酯(PU)膜表面,改性后PU表面的肝素性质稳定、分布均匀,且具有较高的接枝密度,与血液接触时持续释放肝素而达到抗凝血作用。较未改性的PU膜大大降低了血小板的吸附和血栓的形成,呈现良好的血液相容性[33]。
Yin等利用牛血清蛋白(BSA)改性聚丙烯无纺布(PPNWF),先用O2等离子体处理和紫外照射的方法将聚丙烯酸(PAA)接枝到样品表面,再利用PAA作为间隔臂将BSA固定到材料表面[34]。PAA上的羧基可以与蛋白质上的氨基进行反应,因此,PAA可以作为BSA在材料表面固定的间隔臂,此方法反应条件温和,且PAA分子链的存在提供了足够的空间,以避免基底对BSA分子可能造成的影响。图8是BSA和纤维蛋白原在未改性和改性PPNWF样品表面的吸附情况,可以看出,BSA和纤维蛋白原在未改性的PPNWF膜表面吸附量最大(BSA:8.00 μg/cm2,纤维蛋白原:9.00 μg/cm2),改性样品随着BSA表面覆盖度的增加,吸附量逐渐减小;BSA覆盖度达70%的改性样品,BSA和纤维蛋白原的吸附量分别是1.28 μg/cm2和0.80 μg/cm2。固定在样品表面的BSA分子可以有效抑制蛋白质在表面的吸附,形成了一个抵抗非特异性蛋白质吸附的天然屏障。
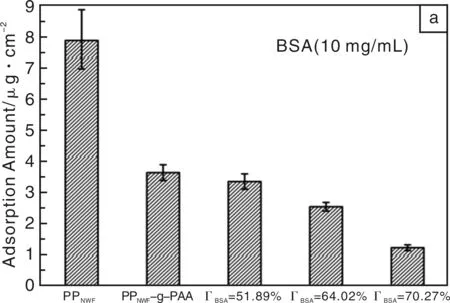
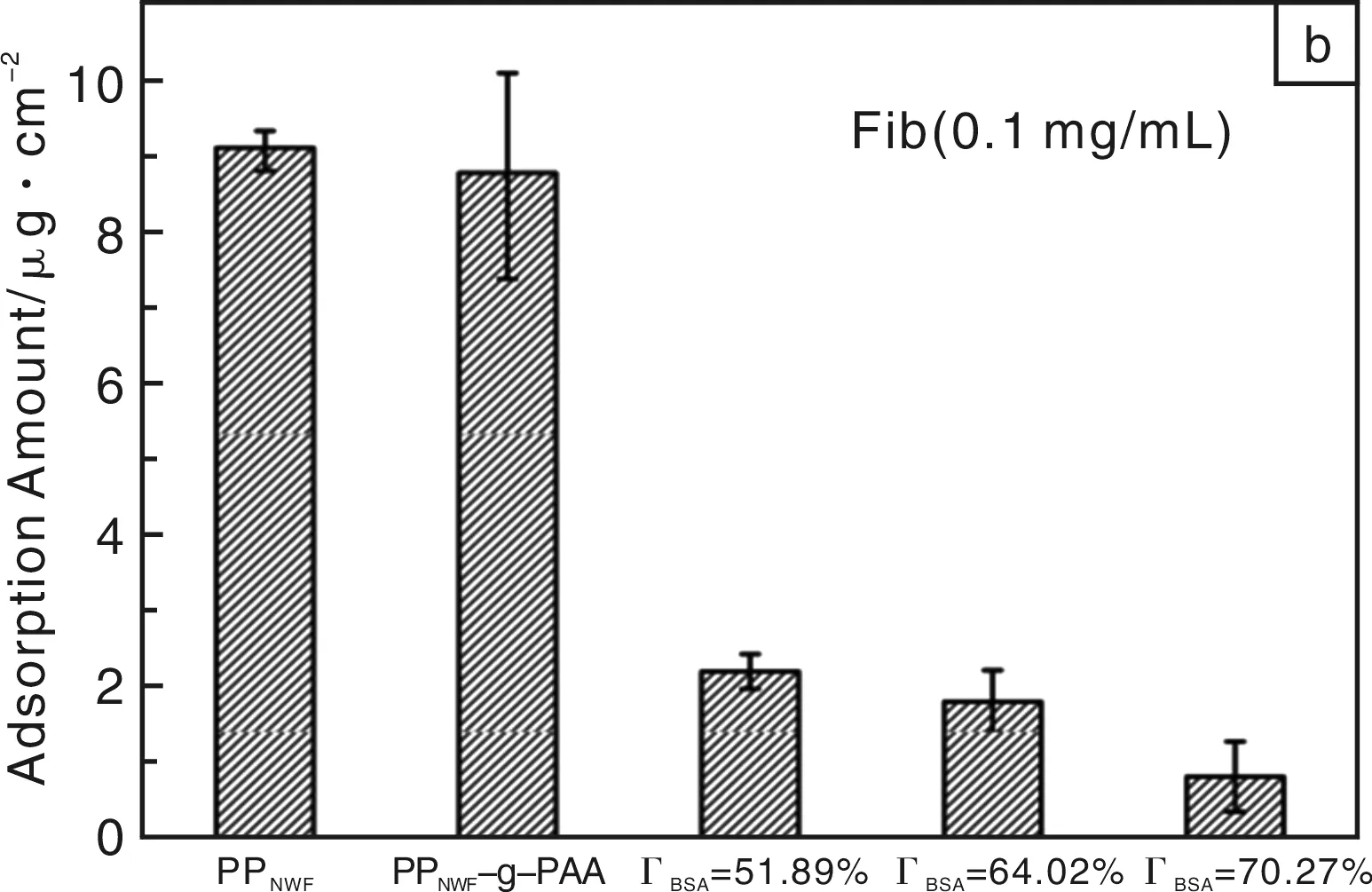
图8 BSA (a) 和纤维蛋白原 (b) 在未改性和改性PPNWF样品表面的吸附Fig.8 Protein adsorption of BSA (a) and fibrinogen (b) on virgin and BSA modified PPNWF, respectively
全血凝血时间测试是将新鲜兔血与样品接触来评价材料抗凝血性能的方法。凝血指数(BCI)可用来表征材料的抗凝血性能,其是样品接触血液的水溶液紫外吸光度与新鲜血液水溶液紫外吸光度之比。在相同的实验条件下,BCI值越大意味着较好的抗凝血性能。图9是未改性、PAA接枝以及BSA改性PPNWF样品的抗凝血指数随时间的变化。血液与样品接触5 min后,3个样品的凝血指数相差不多;但延长接触时间,未改性和PAA改性后样品的凝血指数快速下降;血液与样品接触30 min后,未改性和PAA改性后样品的凝血指数分别下降到5.7%,10.3%,而BSA改性后的样品为23.9%。全血凝血时间测试表明,BSA改性后的样品表面的抗凝血性能显著提升,这是由于BSA改性后的PPNWF表面的亲水性增加,蛋白质吸附量以及血小板粘附的减小,一定程度上阻止了凝血的发生,使得材料拥有更长的凝血时间。而未改性样品表面的强疏水性使蛋白质大量吸附,这些吸附的蛋白质会诱发本体的凝血机制以及血小板的粘附和激活,最终导致血栓形成和血栓塞并发症的发生。全血凝血时间的实验结果再次表明,BSA改性制备PPNWF是提高其抗凝血性能的有效方法[34]。

图9 未改性、PAA接枝以及BSA改性的PPNWF样品不同诱导时间下的抗凝血指数Fig.9 BCT index of the virgin, PAA grafted and BSA modified PPNWF membranes at different contacting time with blood
4.3 材料表面仿生改性
改善材料生物相容性的理想方法是对材料表面进行仿生改性,使其不被血液视为异物,在机体内不会被新陈代谢掉[35-39]。实现仿生化的一种途径为表面内皮化——在材料表面种植、培养血管内皮细胞。健康的内皮细胞具有恰当的亲水性表面,并含有一些重要因子,如:硫酸乙酰肝素,血栓调节蛋白,组织因子途径抑制剂,纤溶酶原激活物和一氧化氮,因此其具有任何人工生物材料无法比拟的血液相容性,内皮细胞可以同时释放或保留不同血管活性因子来保持血液动态平衡,具有抗凝和促凝的双重功能[35]。
Werner 等人在材料表面固定一些低分子量的肝素,利用肝素键连了一定数量的血管内皮细胞生长因子(Vascular Endothelial Growth Factor,VEGF),在PBS缓冲溶液中,内皮细胞生长因子可控释放,促进内皮细胞在材料表面生长。由于肝素和内皮细胞的存在,材料表面具有良好的血液相容性[36]。近年来,Jiang等人从仿生学角度出发,模拟真实血管内表面多尺度微纳复合结构,制备人工的多尺度微纳复合结构表面,有效地减少血小板的粘附,受到了广泛的关注[37]。
另一种方法从仿生膜的磷脂结构出发,在材料表面引入磷脂酰胆碱来模拟生物膜[38]。但磷酸胆碱不稳定,通常采用两性离子聚合物来代替。两性离子聚合物是指大分子链上同时带有阴阳离子基团的高分子[39-41]。通常把正负电荷基团处于同一链节上的称为内盐型两性离子聚合物或高分子甜菜碱,或按习惯称为甜菜碱型聚合物。常见的两性离子有3种,即磷铵、磺铵和羧铵3大类。
Yin等人采用等离子体和紫外照射相结合的方法,将甲基丙烯酰乙二胺磺酸内盐(MPDSAH)接枝到聚丙烯无纺布表面(PPNWF)。两性离子聚合物表面含有两性基团或阴阳离子端基基团混合物,带电端基官能团的溶剂化作用和氢键作用能使两性离子聚合物表面形成水合层,这种基于静电作用形成的水合层表面,可有效阻抗非特异性蛋白质吸附,有效改善了PPNWF的生物相容性[40]。通过自制流通装置仪对纯PPNWF和不同接枝率的PMPDSAH-g-PPNWF进行微孔过滤实验检测,实验结果如图10所示。与未改性膜相比,改性膜的初始流通量有小量降低,随着通过牛血清蛋白时间的增加,各个膜流通量都有大幅的下降,通过进一步的清洗实验发现改性膜的流通恢复率相比未改性膜有显著的提高,相对于纯聚丙烯样品改性后的聚丙烯无纺布抗污能力明显提高,流通恢复率达到90 %以上。流通实验表明,通过接枝改性PMPDSAH-g-PPNWF膜抗污能力明显增强。
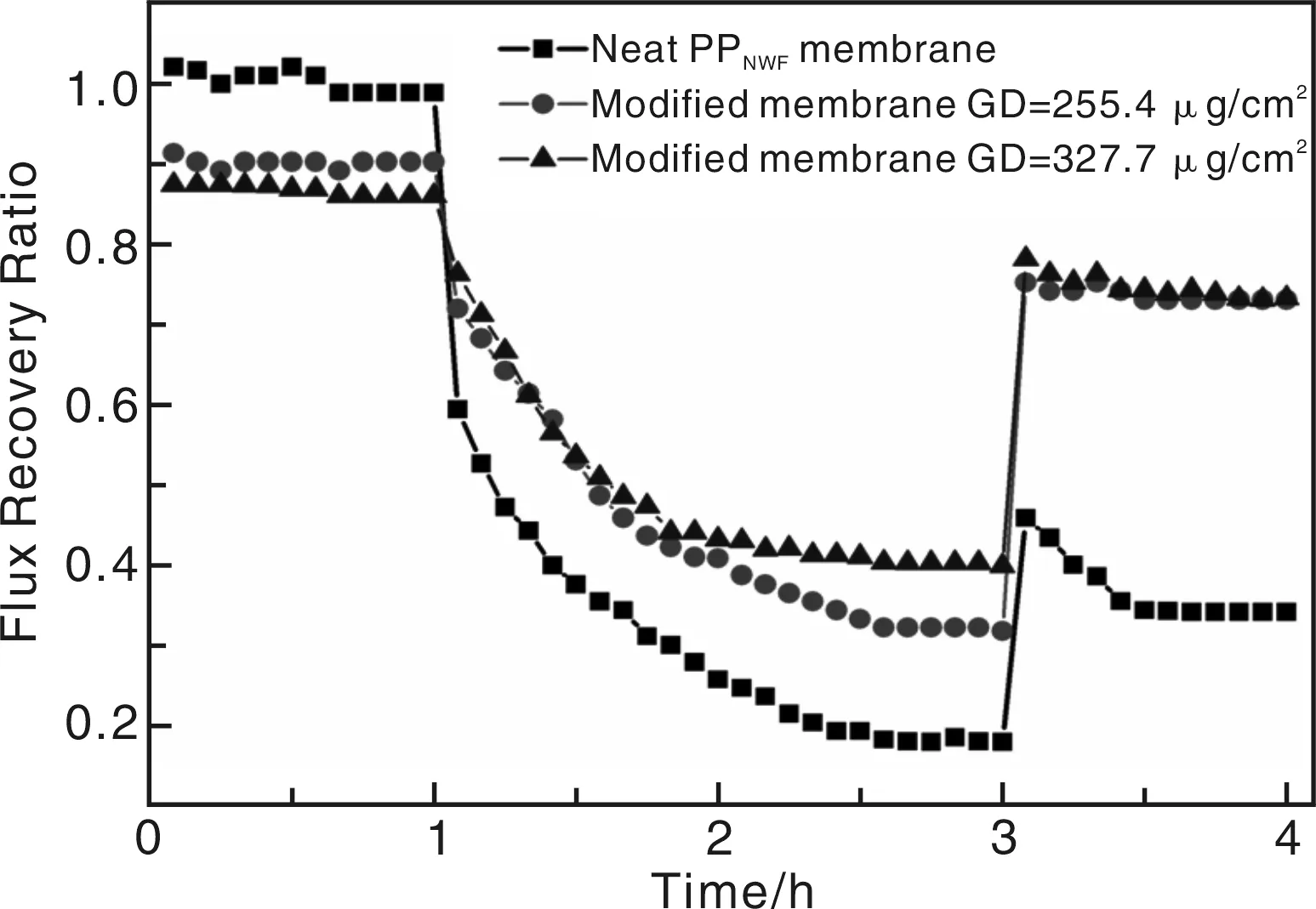
图10 纯PPNWF和不同接枝率的PMPDSAH-g-PPNWF膜的流通率与时间的关系Fig.10 Dependence of flux recovery ratio of neat PPNWF and modified PMPDSAH-g-PPNWF membranes on time during BSA solution microfiltration
5 血液相容性研究
5.1 蛋白质粘附
蛋白质尤其是血浆蛋白在材料表面的吸附是一个复杂的过程,其中的相互作用有范德华力、静电相互作用、疏水相互作用和氢键等。决定材料血液相容性的核心问题是血浆蛋白质与高分子材料表面的相互作用。因此,研究蛋白质在特定结构表面上的吸附、吸附动力学、以及分子链本身的结构,对于通用高分子材料的表面设计,具有十分重要的指导作用[42]。
Yin等人采用等离子体结合紫外光引发的方法在聚丙烯表面上接枝单体PEGMA[32]。蛋白质吸附实验表明:对于PP-g-PEGMA改性膜,小尺寸的BSA蛋白质倾向于吸附在低分子量的接枝单体表面;而大尺寸的棒状纤维蛋白原容易吸附在高分子量单体接枝表面上。由于BSA抑制凝血,而纤维蛋白原促进凝血,Yin等人利用两种不同血浆蛋白的吸附性差异,提出了用抗蛋白质吸附因子r来评价材料的抗凝血性:
(1)
其中,Γpp-Fib和Γs-Fib分别为纤维蛋白原(Fib)在PP原膜和改性膜表面的吸附量;Γpp-BSA和Γs-BSA分别为白蛋白 (BSA) 在PP原膜和改性膜表面的吸附量。
为了研究PEG接枝密度对于血浆蛋白吸附的影响,Yin等人通过酯化反应合成了两种不同分子量的接枝改性物。血小板粘附和全血凝时间以及溶血率的测试证明,改性样品具有良好的血液相容性[43]。利用QCM-D实时在线监测BSA和Fib在材料表面上的吸附。图11是血浆蛋白在不同材料表面吸附量同时间的关系,图12是其吸附机理示意图。改变蛋白质的吸附顺序发现,不同的血浆蛋白质在改性样品上的吸附机理明显不同。预先吸附BSA能有有效抑制Fib的吸附,预先吸附Fib会导致BSA交换吸附的加剧。PEG的表面覆盖率是决定非特异性蛋白质(BSA)吸附的关键,而不是PEG的分子链的长度。这主要是由于密实的PEG分子链释放出更多的结合水,来抑制蛋白质的吸附。而在预先通入Fib的流程中,预吸附的Fib会逐步被高浓度的BSA替换下来,表面亲水性是影响Fib取代替换的重要因素。
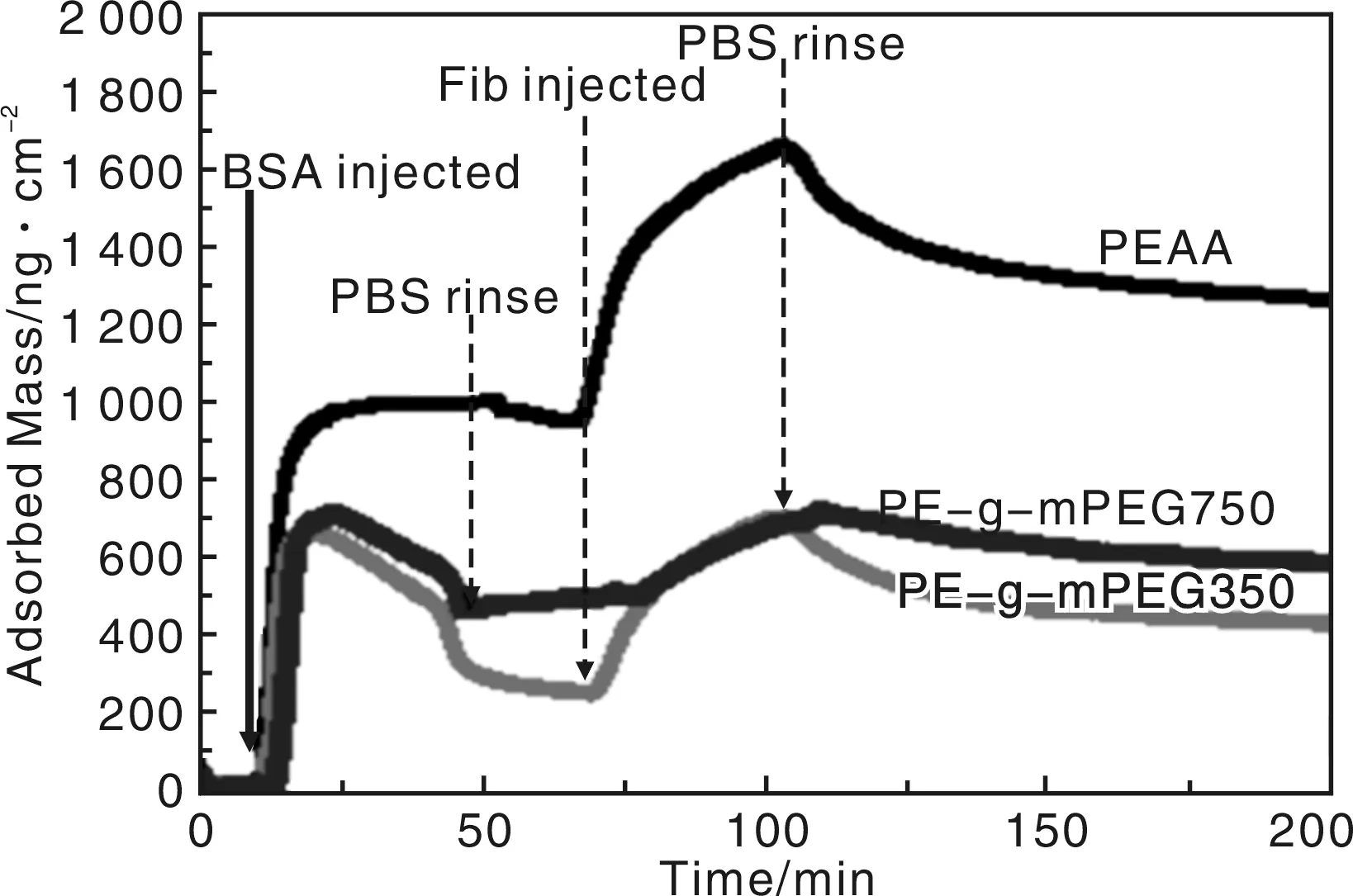
图11 血浆蛋白在不同材料表面吸附量同时间的关系Fig.11 Adsorbed mass of plasma proteins on surface of various materials versus time
Yin等人随后在DPI中构建了不同构象的PEG表面,实时在线研究了BSA、溶菌酶(LYZ)和Fib与不同PEG表面之间的相互作用,图13是BSA和LYZ在不同构象PEG表面吸附示意图。研究发现, PEG1000在表面形成粉饼状构象,PEG2000和PEG5000分别形成紧密的蘑菇状和松散的蘑菇状构象。所有蛋白质在低表面覆盖率的粉饼状的PEG1000表面都呈现较大的吸附量,这主要是由于表面裸露出更多的异质结构诱导蛋白质变性失活。而具有松散蘑菇状构象的PEG5000表面由于长链的柔顺性和高弹性,能够更好的抑制蛋白质的吸附,保持蛋白质的天然构象。因为这种分子链内部的高弹性,在与接下来蛋白质相互作用时,更释放出更多的熵弹性来抑制蛋白质的吸附。

图12 血浆蛋白在不同材料表面吸附机理示意图Fig.12 Schematic diagram of adsorbtion mechanism of plasma proteins on surface of various materials
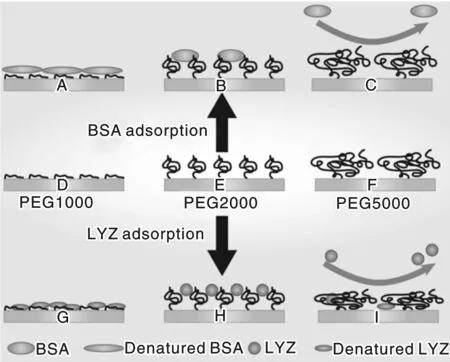
图13 BSA和LYZ在不同构象PEG表面吸附Fig.13 Adsorption of BSA and LYZ on the surface of PEG with different conformations
5.2 血小板粘附
在血液相容性研究中,血小板粘附是产生凝血的关键步骤。传统材料表面无法追踪和调控血小板的粘附。相比而言,采用图案化聚合物表面,不仅可以调控血小板粘附行为,而且易于研究血小板粘附和激活机制,力学收缩方式和动力学行为,同时可以在线检测发生病变的血小板,为血小板研究提供新思路和方法[44-46]。
Yin等人采用UV辐照与模板技术相结合,在SEBS表面选择性接枝MPC单体,制备了图案化的SEBS表面[47]。通过UV照射时间可以精确调控SEBS膜表面图案化结构和相应的血小板粘附模式,图14是该过程和机理的示意图。照射2 min后,紫外曝光的区域中形成接枝层PMPC,SEBS曝光部分和遮盖部分边界明显,由于接枝层的厚度足够(接枝密度约30 μg/cm2),血小板不粘附在UV曝光区域,主要粘附在UV-未曝光的领域,表现出“on”状态(图14a,b,c)。随着照射时间延长,UV曝光区域上的接枝链开始降解,接枝层逐渐破坏,而未曝光区域相反,由于UV衍射和散射效应,光引发剂开始引发MPC的共聚,降解和接枝竞争取决于光掩模板尺寸和曝光剂量。此时,紫外线曝光和未曝光区域边界变得模糊。照射6 min,血小板粘附处在切换(Switching)的状态(图14d,e,f);10 min后,紫外线暴露表面上的接枝层已完全刻蚀掉,而紫外线未暴露表面上的接枝层仍在形成,因此,两个结构域之间的边界变得明显,血小板仅粘附在UV曝光区域,示出“off”状态(图14g,h,i)。在特定的紫外线照射时间,PMPC层的大小和位置,可通过光掩模的尺寸控制,进而,可以调控血小板粘附的尺寸。血小板粘附数目随光掩模的尺寸的减小,从数百,几十个到几个血小板,这个结果非常重要,因为许多实验研究和临床检验需要血小板在单细胞水平检测。
本文将从晚唐时期镜湖周边地区外在的文学环境和隐士方干特殊的创作心态入手,阐释此时镜湖地区特有的文学生态以及诗人方干“清丽”诗风的形成原因。

图14 通过控制UV辐照时间调控SEBS膜表面血小板粘附机理,图中左面和底下的照片分别是试样的AFM和SEM照片Fig.14 Mechanism of different platelet adhesion on the surface of SEBS by controlling UV radiation time, three pieces of pictures lied at left and at the base are AFM and SEM micrographs of samples, respectively
5.3 红细胞溶血
近年来,人们逐渐发现目前使用的血液存储材料存在严重的安全问题。血液存储材料主要由软质聚氯乙烯(PVC)制备。PVC血袋制品中,含有占总量40%~60%(质量分数)的有机酯类增塑剂(主要为邻苯二甲酸(二乙基己)酯,简称DEHP)[48]。使用过程中,DEHP会被血液或保养液逐渐抽提出来,随输血进入人体,却不易排出,引起肝脏病变和睾丸萎缩,对外周神经系统有损伤作用,可引起多发性神经炎和感觉迟钝、麻木等症状。人们还发现DEHP对中枢神经系统也有抑制和麻醉作用,严重时有可能使患者出现呼吸困难、肺原性休克等症状[49]。为此,寻找取代PVC的新型血液存储材料,成为迫切解决的任务。各类新型材料都必须解决红细胞的溶血问题。
Yin等人研究发现,SEBS是取代PVC作为血液存储的理想材料之一[18,50]。为进一步提高SEBS的抗溶血性能,他们利用表面原子——转移自由基引发聚合(SI-ATRP),在SEBS表面接枝了密度和厚度可以调控的高分子刷[50]。ATRP引发剂固定采用了一种绿色环保的水相固定方法,主要通过氧等离子体处理和溴化处理两步完成。在SEBS膜表面引入Br基团,而且Br固定在与苯环相邻的碳原子上,提高了Br的引发效率。图15展示了不同样品表面溶血率的测试结果。原SEBS膜的溶血率为0.47 %,溴化膜SEBS-Br的溶血率增加到0.60 %左右,分析可能为表面分布的大量Br对红细胞膜产生了一些毒害作用,导致膜破损。而接枝聚乙二醇类单体OEGMA后溶血率明显降低,并且溶血率随着表面P(OEGMA)聚合物刷接枝密度的增长而逐渐降低,SEBS-g-P(OEGMA)-1 (接枝密度为12.5 μg/cm2)、SEBS-g-P(OEGMA)-2(接枝密度为32.5 μg/cm2)和SEBS-g-P(OEGMA)-3(接枝密度为72.5 μg/cm2)的溶血率分别为0.34%、0.21%、0.19%。表面聚合刷增长会使得其水化层厚度增加,当水化层厚度达到一定程度会使得红细胞与膜本身的接触机会大大降低,因而膜本身对红细胞膜造成的破坏逐渐降低。与SEBS膜相比,基本不引起溶血的SEBS-g-P(OEGMA)-3适合用作红细胞存储材料。
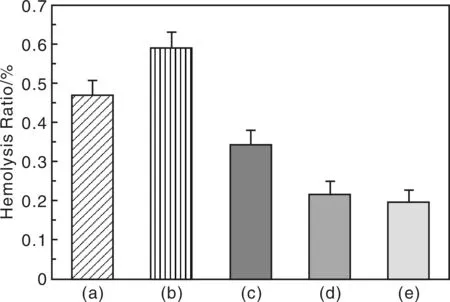
图15 SEBS及SEBS改性膜表面的溶血率:(a) SEBS 原膜, (b) SEBS-Br, (c) SEBS-g-P(OEGMA)1, (d) SEBS-g-P(OEGMA)2, (e) SEBS-g-P(OEGMA)3Fig.15 Hemolysis ratio of virgin SEBS, brominated SEBS and grafted SEBS with polymer brushes:(a) virgin SEBS, (b) SEBS-Br, (c) SEBS-g-P(OEGMA)1, (d) SEBS-g-P(OEGMA)2, and (e) SEBS-g-P(OEGMA)3
6 结 语
从血液相容性的角度来看,通用高分子材料的化学和生物改性虽然取得了一定的成功,但仍存在以下问题:①高分子材料改性未能从血液接触环境的需要出发,常造成材料设计与实际需要脱节;②血液相容性研究仅针对单一血液组分,未能考虑血液整体的协同作用;③忽略了改性后材料与血液长期接触效应,包括血液引发的材料老化和降解,进而造成对血液及人体的损害。未来研究亟待在以下3个方面有所突破:①化学和生物改性新发法和新技术的建立;②材料表面与血液相互作用的深入研究,不仅研究材料对血液成分的破坏,而且探讨血液成分引起的材料的老化和损害;从研究材料与单一血液成分的作用进入到研究材料与多种血液成分的协同作用;将材料与血液接触的短期效应与长期效应结合起来评估高分子材料的血液相容性;③加快开发具有明确的使用需求和产业化前景的生物材料,比如:血液存储、血液透析、人造血管和心脏支架等。这些研究将有助于保障国民健康并推动社会发展。
参考文献 References
[1] Michel V. Polymeric Biomaterials: Strategies of the Past vs. Strategies of the Future [J].ProgressPolymerScience, 2007, 32 (8-9):755-761.
[2] Werner C, Mait M F, Sperling C. Current Strategies Towards Hemocompatible Coatings [J].JournalofMaterialChemistry, 2007, 17 (32): 3 376-3 384.
[3] Cheng H, Yuan L, Song W,etal. Biocompatible Polymer Materials: Role of Protein-surface Interactions [J].ProgressPolymerScience, 2008, 33 (11): 1 059-1 087.
[4] Yang Lifeng (杨立峰),Xu jianxia (许建霞),Xi Tingfei (奚廷斐). 生物材料血液相容性的研究与评价 [J].JournalofBiomedicalEngineering(生物医学工程学杂志), 2009, 26 (5): 1 162-1 166.
[6] Roach P, Farrar D, Perry C C. Surface Tailoring for Controlled Protein Adsorption: Effect of Topography at the Nanometer Scale and Chemistry [J].JournaloftheAmericanChemicalSociety, 2006, 128 (12): 3 939-3 945.
[7] Evan A, Donald L. Mass Spectrometric Mapping of Fibrinogen Conformation at Poly(ethylene terephthalate) Interfaces [J].Biomaterials, 2007, 28 (27): 3 904-3 917.
[8] Li Z, Kim E S, Bearer E L. Arp2/3 Complex is Required for Actin Polymerization during Platelet Shape Change [J].Blood, 2002, 99(12): 4 466-4 474.
[9] Ruggeri Z M, Mendolicchio G L. Adhesion Mechanisms in Platelet Function.CirculationResearch, 2007, 100 (12): 1 673-1 685.
[10] Zhou R, Vogler E A. Practical Application of a Chromogenic FXIIa Assay [J].Biomaterials, 2006, 27 (28): 4 840-4 845.
[11] Gorbet M B, Sefton M V. Complement Inhibition Reduces Material-induced Leukocyte Activation with PEG Modified Polystyrene Beads (Tentagel) but not Polystyrene Beads [J].JournalofBiomedicalMaterialsResearchA, 2005, 74 (4): 511-522.
[12] Kuroda K, Caputo G A, Decrado W F. The Role of Hydrophobicity in the Antimicrobial and Hemolytic Activities of Polymethacrylate Derivatives [J].Chemistry-AEuropeanJournal, 2009, 15 (5):1 123-1 133.
[13] Sovadinova I, Palermo E F, Huang R. Mechanism of Polymer-induced Hemolysis: Nanosized Pore Formation and Osmotic Lysis [J].Biomacromolecules, 2011, 12 (1): 260-268.
[14] Scott K L, Lecak J, Acker J P. Biopreservation of Red Blood Cells: Past, Present and Future [J].TransfusionMedicineReviews, 2005, 19 (2): 127-142.
[15] Kanias T, Acker J P. Biopreservation of Red Blood Cells-the Struggle with Hemoglobin Oxidation [J].FEBSJournal, 2010, 277 (2):343-356.
[16] Shi H, Shi D, Yin J,etal. Preparation of PP-g-PEG by Using Partial Pre-irradiated Polypropylene as Initiator and its Properties [J].PolymerBulletin, 2010, 65 (9): 929-940.
[17] Yang H, Luan S, Yin J,etal. N-vinyl Pyrrolidone-Assisted Free Radical Functionalization of Glycidyl Methacrylate onto Styrene-b-(ethylene-co-butylene)-b-styrene [J].ReactiveandFunctionalPolymers, 2010, 70 (12): 961-966.
[18] Yang H, Luan S, Yin J,etal. Improving Hemocompatibility of Styrene-b-(ethylene-co-butylene)-b-styrene Elastomer via N-vinyl Pyrrolidone-Assisted Grafting of Poly(ethylene glycol) Methacrylate [J].Polymer, 2012, 53 (8): 1 675-1 683.
[19] Jin J, Jiang W, Yin J,etal. Melting Grafting Polypropylene with Hydrophilic Monomers for Improving Hemocompatibility [J].ColloidsandSurfacesA:PhysicochemicalandEngineeringAspects, 2012, 407 (1): 141-149.
[20] Shi Q, Zhao J, Yin J.etal. Biocompatible Polypropylene Prepared by a Combination of Melt Grafting and Surface Restructuring [J].JournalAppliedPolymerScience, 2012,126 (3): 929-938.
[21] Luan S, Shi H, Yin J,etal. Effect of Electron Beam Irradiation Sterilization on the Biomedical Poly (octene-co-ethylene)/Polypropylene Films [J].NuclearInstrumentsandMethodsinPhysicsResearchSectionB, 2010, 268 (9):1 474-1 477.
[22] Wang Ligang (王利刚),Li Xiaojiang (李笑江),Yan Qilong (严启龙),etal. 聚乙二醇共混体系的研究进展 [J].ChemicalPropellants&PolymericMaterials(化学推进剂和高分子材料), 2012, 10 (2): 43-47.
[23] Qian Hao (钱 浩),Zhou Xie (周 勰),Xu Jianrei (许家瑞),etal. 聚乙烯/聚乙二醇共混物中极性组分的表面富集 [J].JournalofFunctionalPolymers(功能高分子学报), 2003, 16 (1): 184-190.
[24] Bonnie O, Leung A, Hitchcock P,etal. An X-ray Spectromicroscopy Study of Protein Adsorption to Polystyrene-Poly(ethylene oxide) Blends [J].Langmuir, 2010, 26 (18):14 759-14 765.
[25] Hasegawa T, Iwasaki Y, Ishihara K. Preparation and Performance of Protein-adsorption-resistant Asymmetric Porous Membrane Composed of Polysulfone/phospholipid Polymer Blend [J].Biomaterials, 2001, 22 (1): 243-251.
[26] Ishihara K, Nishiuchi D, Watanabe J,etal. Polyethylene/Phospholipid Polymer Alloy as an Alternative to Poly(vinylchloride)-based Materials [J].Biomaterials, 2004, 25 (6):1 115-1 122.
[27] Hong Y, Ye S, Nieponice A,etal. A Small Diameter, Fibrous Vascular Conduit Generated from a Poly(ester urethane)urea and Phospholipid Polymer Blend [J].Biomaterials, 2009, 30 (13): 2 457-2 467.
[28] Chen H, Zhang Z, Chen Y,etal. Protein Repellant Silicone Surfaces by Covalent Immobilization of Poly(ethylene oxide) [J].Biomaterials, 2005, 26 (15): 2 391-2 399.
[29] Luan S, Zhao J, Yin J,etal. Surface Modification of Poly(styrene-b-(ethylene-co-butylene)-b-styrene) Elastomer via UV-induced Graft Polymerization of N-vinyl pyrrolidone [J].ColloidsandSurfacesB:Biointerface, 2012, 93 (1):127-134.
[30] Li X, Luan S, Yin J,etal. Surface Modification of Poly(styrene-b-(ethylene-co-butylene)-b-styrene) Elastomer via Photo-initiated Graft Polymerization of Poly(ethylene glycol) [J].AppliedSurfaceScience, 2012, 258 (7): 2 344-2 349.
[31] Li X, Luan S, Yin J,etal. Improved Biocompatibility of Poly (styrene-b-(ethylene-co-butylene)-b-styrene) Elastomer by a Surface Graft Polymerization of Hyaluronic Acid [J].ColloidsandSurfacesB:Biointerface, 2013, 102 (1): 210-217.
[32] Jin J, Jiang W, Yin J,etal. Fabrication of PP-g-PEGMA-g-heparin and its Hemocompatibility: From Protein Adsorption to Anticoagulant Tendency [J].AppliedSurfaceScience, 2012, 258 (15): 5 841-5 849.
[33] You I S, Kang S M, Byun Y R,etal. Enhancement of Blood Compatibility of Poly(urethane) Substrates by Mussel-Inspired Adhesive Heparin Coating [J].BioconjugateChemistry, 2011, 22 (7):1 264-1 269.
[34] Zhang C, Jiang W, Yin J,etal. Functionalized Polypropylene Non-woven Fabric Membrane with Bovine Serum Albumin and its Hemocompatibility Enhancement [J].ColloidSurfaceB,Biointerface, 2013,102 (1): 45-52.
[35] Yuan Jiang (袁 江), Huang Xiaobo (黄小波), Lin Sicong (林思聪),etal. 抗凝血高分子生物材料的表面设计 [J].PolymerBulletin(高分子通报), 2012, 11 (1): 12-16.
[36] Seib F P, Herklotz M, Burke K A,etal. Multifunctional Silk-heparin Biomaterials for Vascular Tissue Engineering Applications [J].Biomaterials, 2014, 35 (1): 83-91.
[37] Fan H L, Chen P P, Jiang L,etal. Greatly Improved Blood Compatibility by Microscopic Multiscale Design of Surface Architectures [J].Small, 2009, 5 (19): 2 144-2 148.
[38] Zhao J, Shi Q, Yin J,etal. Polypropylene Non-woven Fabric Membrane via Surface Modification with Biomimetic Phosphorylcholine in Ce(IV)/HNO3Redox System [J].MaterialScienceEngineeringC-Material, 2012, 32 (7): 1 785-1 789.
[39] Song L, Zhao J, Yin J,etal. Biocompatibility of Polypropylene Non-woven Fabric Membrane via UV-induced Graft Polymerization of 2-acrylamido-2-methylpropane Sulfonic Acid [J].AppliedSurfaceScience, 2011, 258 (1): 425-430.
[40] Zhao J, Shi Q, Yin J,etal. Improved Biocompatibility and Antifouling Property of Polypropylene Non-woven Fabric Membrane by Surface Grafting Zwitterionic Polymer [J].JournalofMembraneScience, 2011, 369 (1-2): 5-12.
[41] Zhao J, Song L, Yin J,etal. Antibacterial and Hemocompatibility Switchable Polypropylene Nonwoven Fabric Membrane Surface [J].ACSAppliedMaterials&Interfaces, 2013, 5 (11): 5 260-5 268.
[42] Satulovsky J, Carignano M A, Szleifer I. Kinetic and Thermodynamic Control of Protein Adsorption [J].PNAS, 2000, 97 (16): 9 037-9 041.
[43] Jin J, Jiang W, Yin J,etal. Plasma Proteins Adsorption Mechanism on Polyethylene-grafted Poly (ethylene glycol) Surface by Quartz Crystal Microbalance with Dissipation [J].Langmuir, 2013, 29 (22): 6 624-6 633.
[44] Lam W A, Chaudhuri O, Crow A,etal. Mechanics and Contraction Dynamics of Single Platelets and Implications for Clot Stiffening [J].NatureMaterials, 2010, 10 (1): 61-66.
[45] Ekblad T, Faxälv L, Andersson O.etal. Patterned Hydrogels for Controlled Platelet Adhesion from Whole Blood and Plasma [J].AdvancedFunctionalMatertials, 2010, 20 (15): 2 396-2 403.
[46] Jen C J, McIntire L V. The Structural Properties and Contractile Force of a Clot [J].CellMotility, 1982, 2 (5): 445-455.
[47] Ye W, Shi Q, Yin J,etal. Patterning Surfaces for Controlled Platelet Adhesion and Detection of Dysfunctional Platelets [J].MacromolecularBioscience, 2013,13 (6): 678-681.
[48] D’Alessandro A, Liumbruno G, Grazzini G. Red Blood Cell Storage: the Story so far [J].BloodTransfusion, 2010,8 (1): 82-88.
[49] Deepa D K V, Kumar V M, Arun P,etal. Increased Lipid Peroxidation of Erythrocytes in Blood Stored in Polyvinyl Chloride Blood Storage Bags Plasticized with Di-[2-ethylhexyl] Phthalate and Effect of Antioxidants[J].VoxSanguinis, 1998, 75 (1): 198-204.
[50] Hou J, Shi Q, Jin J,etal. Aqueous-based Immobilization of Initiator and Surface-initiated ATRP to Construct Hemocompatible Surface of Poly (styrene-b-(ethylene-co-butylene)-b-styrene) Elastomer [J].ColloidsandSurfacesB:Biointerfaces, 2013, 111 (1): 333-341.
