奥施康定治疗慢性癌痛的疗效观察
2014-08-28何世保方国全王义平
何世保,方国全,王义平
疼痛是癌症患者尤其是中晚期患者最常见的症状,疼痛对机体的躯体方面、精神心理方面、社会人际方面均可能产生不同程度的影响,从而全面影响患者的生活质量。新诊断的癌症患者中1/4伴有疼痛,1/3接受抗肿瘤治疗的患者及3/4晚期肿瘤患者均合并疼痛,绝大多数的癌性疼痛可以通过止痛药物得到有效控制,使患者的生活质量改善。奥施康定(盐酸羟考酮控释片)是一种新型的半合成纯阿片受体激动剂,在我国于2004年9月上市,主要用于治疗癌痛[1]。本研究收集我院2010年10月-2013年6月奥施康定治疗中、重度癌痛共64例患者资料,对其疗效、生活质量评分及不良反应进行观察,现将结果报告如下。
1 资料与方法
1.1一般资料 选择2010年10月-2013年6月在我科门诊及住院治疗的慢性癌痛患者64例,其中男34例,女30例。年龄28~72岁,平均年龄50岁。均符合以下标准:(1)有明确病理或细胞学诊断;(2)癌症伴有中、重度疼痛(NRS评分4~10分);(3)无严重心、肺、肝、肾功能障碍;(4)所有患者在给药前4 h均未用过其他镇痛药物,并能排除放、化疗对镇痛作用的影响,患者能合作评价疼痛症状。肿瘤类型:肺癌13例,乳腺癌12例,胃癌11例,大肠癌9例,肝癌7例,胰腺癌4例,前列腺癌、宫颈癌、卵巢癌各2例,多发性骨髓瘤2例。47例未接受过药物止痛,8例用盐酸曲马多缓释片止痛,因疼痛不能控制换用奥施康定止痛;6例用美施康定止痛,因严重恶心、呕吐及头晕,患者自行要求换用奥施康定止痛;3例用布洛芬缓释胶囊止痛。
1.2疼痛程度分级 由患者本人进行疼痛评价,采用NRS评分(数字评估法),将疼痛程度分为0~10分。0分:无疼痛;1~3分:轻度疼痛,虽有疼痛能正常生活,睡眠不受干扰;4~6分:中度疼痛,疼痛明显不能忍受,正常生活及睡眠受干扰,要求服用止痛剂;7~10分:重度疼痛,强烈持续的剧烈疼痛,睡眠严重受干扰,须服用止痛剂。按上述标准,本组病例中,中度疼痛20例(31.2%),重度疼痛44例(68.8%)。根据疼痛性质分为内脏痛、骨痛、软组织浸润痛及神经痛。本组观察的64例患者中,骨痛24例(37.5%),内脏痛21例(32.8%),神经性疼痛10例(15.6%)。软组织浸润痛5例(7.8%),混合性疼痛4例(6.3%)。
1.3治疗方法 对于用过强阿片类止痛药患者,将原来每天用药换算成吗啡用量,将吗啡用量除以2,换算成每天奥施康定用量,等量分成两份,患者的起始滴定剂量中度痛予以10 mg/q12h,重度痛者予以20 mg/q12h。奥施康定必须整片吞服,不得掰开、咀嚼或研磨,并根据疼痛缓解程度调整剂量。服药后为中度痛每次增加剂量在原有剂量的基础上增加25%~50%;服药后为重度痛每次增加剂量在原有剂量的基础上增加50%~100%;出现爆发痛用即释吗啡或吗啡注射液解救。如果每日处理爆发性痛次数超过3次,应考虑增加下次的给药剂量。患者持续治疗时间≥4周。所有患者中所使用的最大剂量为60 mg/d。
1.4疗效评定
1.4.1疼痛缓解 据WHO制定的疼痛缓解效果评价标准为依据,将疗效制定为4级[2]:完全缓解(CR):疼痛消失;部分缓解(PR):服药后疼痛情况明显减轻,基本上不影响患者正常睡眠;轻度缓解(MR):服药后疼痛明显减轻,但对正常睡眠有一定影响;无效( NR):服药后疼痛情况无缓解。疼痛缓解率(%)=[(中度缓解例数+明显缓解例数+完全缓解例数)/总例数]×100%。
1.4.2不良反应 观察服用奥施康定后出现的便秘、恶心呕吐、腹胀、厌食、头晕及排尿困难等不良反应的病例数,计算出不良反应发生率。
1.4.3生活质量评分(quality of life,QOL) 采用孙燕院士等制定的《肿瘤患者的生活质量评分表》[3],用食欲、精神、睡眠、疼痛、日常生活、与人交往等指标来评测治疗前、后的QOL分。每项最低1分,最高5分,统计用药前后生活质量评分,然后比较用药前后上述方面的改善情况有无差异。
1.5统计学方法 本组所有数据均在SPSS 13.0软件包进行统计学分析,2组间的比较采用配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1疼痛缓解情况 服药4周后,中度疼痛组患者疼痛的缓解率为100.0%;重度疼痛组的缓解率为90.9%;总缓解率为93.8%。患者疼痛缓解情况见表1。
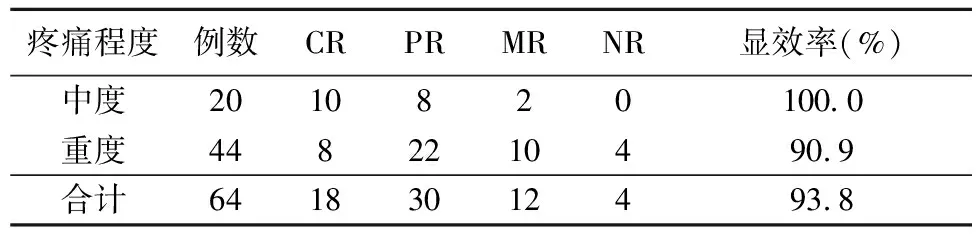
表1 奥施康定用于慢性癌性中、重度疼痛镇痛疗效比较
注:显效率为CR+PR。
2.2不良反应情况 最常见的不良反应为便秘,其他的不良反应如恶心呕吐、腹胀、厌食嗜睡等发生率较低,大多不良反应轻微,对症处理即可。患者不良反应情况,见表2。

表2 奥施康定用于慢性癌性中、重度疼痛不良反应情况
2.3生活质量评分 患者的疼痛、食欲、日常生活、睡眠、精神状态、社交等方面的评分较服药前有明显增加,差异均有统计学意义(P<0.05)。服药前后患者生活质量的对比分析,见表3。
3 讨论
晚期癌症患者慢性疼痛的处理一直是医护人员所面临的难题。1995年,James Campbe 提出将疼痛列为第五大生命体征,在2001年亚太地区疼痛论坛上提出“消除疼痛是患者的基本权利”, 尽管近年各国或区域性学术团体相继制定了很多更具实用性的癌痛指南,但这些指南仍然遵守WHO三阶梯止痛的基本原则。按阶梯给药,轻度疼痛选择对乙酰氨基酚或非甾体类抗炎止痛药,中度疼痛选择弱阿片类药物,重度疼痛选择强阿片类药物,随着癌痛治疗的进展,为使病人尽快止痛,临床多采用NCCN成人癌痛指南的推荐,弱化二阶梯,中度疼痛即开始口服奥施康定为代表的强阿片类药物,如果疼痛进展,可继续用于第三阶段治疗,根据TIME原则调整剂量即可达到较理想的止痛作用。

表3 服药前后患者生活质量的对比分析
奥施康定是羟考酮的最新剂型,具有以下特点:(1)起效快速持久:采用新一代acrocontin控释技术,38%即释、62%缓释,药物吸收呈双相吸收峰,1 h以内快速起效,平稳持续镇痛达12 h[4]。(2)口服生物利用度高达:60%~87%,在常用的阿片类药物中生物利用率最高,个体差异小。(3)镇痛强度强:是口服吗啡的1.5~2倍,本组中度疼痛患者的疼痛缓解率为100.0%,重度疼痛患者的疼痛缓解率为90.9%,全组总的疼痛缓解率为93.8%。(4)安全性好:奥施康定为纯阿片受体激动剂的单一制剂, 无对乙酰氨基酚或非甾体类抗炎止痛药的封顶效应,12 h服药1次, 用药24~36 h血药浓度可达到稳态,在临床应用中易于剂量滴定;其主要产物去甲羟考酮的强度仅为羟考酮的1%,长期应用不会出现代谢产物蓄积现象,安全性较好。
奥施康定最主要的不良反应是便秘,本组便秘发生率21.9%,与文献报道相近[5],但程度较轻,经口服缓泻剂等对症治疗后可缓解。其次出现的不良反应为恶心、呕吐,发生率为12.5 %,本组中出现的其他不良反应有腹胀、厌食,嗜睡、头晕,但发生率均较低,随着用药时间的延长能逐渐缓解,未发生呼吸抑制等严重不良反应。文献认为奥施康定的不良反应是可以预见的[6-7]”, 通过个体化的剂量及避免出现阿片类药物血药浓度大幅度波动,可以最大限度地抑制不良反应的发生率。经常与患者家属、陪伴及医护人员沟通交流,有助于在止痛的同时减少或避免阿片类药的不良反应。奥施康定的不良大多数出现在用药初期,随着时间的延长,机体逐渐耐受,不良反应的发生率逐渐降低或消失。奥施康定在缓解疼痛的同时也改善其生活质量[8],本研究表明,患者口服奥施康定止痛4周后QOL评分明显升高,生活质量显著改善。
综上所述,奥施康定能有效地控制癌症患者的慢性中、重度疼痛,服用方便,不良反应发生少且轻微,还可以明显提高患者的生活质量,是中重度癌痛患者的首先药物之一。
【 参 考 文 献 】
[1] 张广华,李锦成.奥施康定用于慢性癌性中重度疼痛的疗效观察[J].中国肿瘤临床,2008,35(13):733-735.
[2] 黄 雄,张纬建,蔡传书.奥施康定治疗中重度癌痛的临床观察[J].海峡药学,2010,29(1):6.
[3] 孙 燕.内科肿瘤学[M].北京:人民卫生出版社,2001:996.
[4] Biancofiore G.Oxycodone controlled release in cancer pain management[J].Ther Clin Risk Manag,2006,2(3):229-234.
[5] 刘太锋,陈香梅,王艳艳.奥施康定治疗中重度癌痛的临床疗效分析[J].齐齐哈尔医学院学报,2011,32(13):2087-2088.
[6] Watson CP,Moulin D,Watt Watson J,et a1.Controlled-release oxycodone refieves neuropathic pain: arandomized controlled trial in painful diabetic neuropathy[J].Pain,2003,105(1-2 ):71-78.
[7] Ackerrnan SJ,Mordin M,Reblando J,et a1.Patient-reported utilization patterns of fentanyl transderml system and oxycodone hydrochloride controlled-release among patients with chronic nonmalignant pain[J].J Manag Care Pharm,2003,9(3):223-231.
[8] 柴 枫, 潘宏铬.盐酸羟考酮控释片治疗中重度癌痛72例的临床观察[J].中国肿瘤临床, 2009,36(21):1213-1215.
