大岩桐GAI同源基因的克隆及功能研究
2014-08-25庞基良
费 元,钟 丹 ,韩 雪 ,庞基良
(1.杭州师范大学生命与环境科学学院, 浙江 杭州 310036;2.浙江省绍兴市鲁迅中学分校, 浙江 绍兴 312000)
赤霉素(GA)是一种重要的植物激素,它调节许多植物的生长和发育过程,如种子萌发、叶的生长、根茎的伸长、花的发育以及果实的膨大等[1].赤霉素的信号转导由正向作用因子和反向作用因子调节,GAI基因是GA信号转导途径中的反向作用因子之一,它编码的蛋白属于GRAS家族的DELLA蛋白,DELLA蛋白在GA信号转导途径中发挥着重要作用,赤霉素通过泛素化降解途径促使DELLA蛋白降解,从而引起赤霉素反应基因的表达[2].目前已从拟南芥(Arabidopsisthaliana)、豌豆(Pisumsativum)、杨树(Populusalba)苹果(Maluspumila)、葡萄(Vitisvinifera)[3-7]等多个物种中克隆到GAI的同源基因.GAI的功能缺失会产生拟南芥突变体ga1-3 迟开花的表型,说明GAI起抑制花转变的作用[8].拟南芥的GAI基因在水稻中过表达会引起植株的矮化,而这可能会产生一系列的水稻高产品种[9].葡萄的VvGAI突变会引起在原本形成卷须的部位产生花序[10].VvGAI还与葡萄的育性、串重、果实品质相关[11].以上研究表明GAI基因与株高、花芽分化以及果实发育密切相关.
我们通过在培养基中添加赤霉素和细胞分裂素,建立了离体培养大岩桐花被切块高频率直接再生花芽的实验体系[12-13].GAI基因既是GA信号转导的反向作用因子,又在花发育中起作用,本研究克隆了大岩桐的GAI同源基因,并通过农杆菌介导法转化烟草,初步研究了大岩桐GAI同源基因的功能.
1 材料与方法
1.1 供试材料
本实验所用的大岩桐(Sinningiaspeciosa),种植于杭州师范大学玻璃温室.取新鲜花蕾分装,于液氮中保存备用.
1.2 方 法
1.2.1 总RNA的提取与cDNA合成
采用异硫氰酸胍法(GT)提取花蕾(直径约5 mm)组织的总RNA,取2 μg RNA,使用RevertAidTMFirst Strand cDNA Synthesis Kit(ToYoBo,Code:FSK-100)合成cDNA.
1.2.2 GAI基因保守区克隆
通过对已经在GenBank上发布的拟南芥等植物GAI同源基因序列的比对,在其保守区域设计一对引物,Della 004:5’-CAC GCC ACC ACG TTGCAG AT-3’ ,Della 005:5’ -GCACTT CTA CGA GAC CTG CC -3’ ,以反转录后的大岩桐cDNA为模板进行PCR,PCR的条件是94 ℃ 3 min,94 ℃45 s,55 ℃45 s,72 ℃1.5 min,72 ℃10 min ,30个循环.将该PCR扩增产物经1.2%琼脂糖电泳后,利用DNA 胶回收试剂盒回收,连接到pMD18-T 测序载体,送上海生工公司测序.
1.2.3 3’端的克隆
根据测序得到的GAI保守区序列,在序列内部设计两个5’端巢式引物与试剂盒所带引物形成嵌套,以第一链cDNA为模版进行3’RACE.两个5’端的引物Della 007(Outer): 5’ -TTT GGT ATG AAA CAG GGA ATG C -3’;Della 008(Inner): 5’- CAA GCA TTG GCG TTG AGG C -3’.试剂盒所带引物:3RACE(Outer):5’ - TAC CGT CGT TCC ACT AGT GAT TT -3’;3RACE(Inner):5’- CGC GGA TCC TCC ACT AGT GAT TTC ACT ATA GG -3’.
1.2.4 5’端的克隆
根据已知的中间序列,设计两个3’端巢式引物与试剂盒所带引物形成嵌套.以第一链cDNA 为模板按照试剂盒方法进行5’RACE,将PCR 扩增产物回收后,连接到pMD18-T测序载体后,送上海生工公司测序.两个3’端巢式引物是Della 012(Outer):5’ -TCC AAT GAA ACG AAA AGG GTC -3’;Della 010(Inner):5’ -CCA CCG TCT CAC CTT CCC TAA -3’.试剂盒所带引物5RACE(Outer):5’ -CAT GGC TAC ATG CTG ACA GCC TA -3’;5RACE(Inner):5’ -CGC GGA TCC ACA GCC TAC TGA TGA TCA GTC GAT G -3’.
1.2.5 GAI基因全长的克隆
用DNAstar 软件拼接所得的3 段序列(中间序列、3’端序列和5’端序列),根据拼接结果,在两端设计基因的特异性引物,全长引物是SsGAI001:5’ -CGG GAT CCT TTC AAG AAA ATG AAG AGA GAC CAC -3’; SsGAI002:5’ -CGA GCT CCA AAC CAG ACC GGG TTT CAC TC-3’,进行全长PCR 扩增,将PCR 扩增产物回收后,连接到pMD18-T 测序载体后,送上海生工公司测序.
1.2.6 生物信息学分析
将测序结果通过NCBI 网站进行核苷酸序列比对(Blastn)和氨基酸序列比对(Blastp);用DNAman 4.0 进行氨基酸序列比对分析;根据同源比对结果,用MEGA 4.1 进行进化树分析.
1.2.7 SsGAI器官特异性表达分析
由图6可知,当传输距离为1 km时,随着能见度的增加,三种辐射波在平流雾和辐射雾中的透过率均逐渐增加,且在相同的辐射波和能见度下,平流雾的衰减均大于辐射雾的衰减.相同能见度下三种辐射波衰减程度由小到大排序,在平流雾中依次是10.6 μm、1.064 μm和3.8 μm,在辐射雾中依次是10.6 μm、3.8 μm和1.064 μm.
分别提取大岩桐的根、茎、叶、花萼和直径5mm花芽的总RNA,反转录后得到不同组织的cDNA,以肌动蛋白(Actin)作为内标对cDNA模板进行半定量,通过对不同的cDNA模板进行RT-PCR,确定SsGAI在不同组织中的表达量.PCR 反应程序为:94℃预变性5 min;94℃变性45 s,60℃退火45 s,72℃延伸60 s,扩增30 个循环;72℃延伸10 min.Actin 的引物为ActinF:5’-GGAGAAGATCTGGCATCACA-3’,ActinR:5’-CCTCCAATAAAGACACTGTA-3’.
1.2.8 SsGAI的载体构建和烟草转化
以pBI121为基础,CaMV 35S为启动子,构建SsGAI同源基因全长ORF序列的超表达载体.用BamHI和SacI对克隆载体pMD18-T Simple进行双酶切,所得ORF连接到用相同内切酶进行双酶切的pBI121载体上,取代GUS基因,获得pBI121-SsGAI表达载体.将重组质粒转化大肠杆菌XL1-Blue.构建过程中质粒DNA 小量提取、酶切、片段回收均参照试剂盒(上海生工公司产品)说明书进行.
使用冻融法(参考分子克隆实验指南第2版)将pBIN19-35S-SsGAI表达载体导入根癌农杆菌GV3101 中,用叶盘法转化烟草(品种为“黄苗鱼”),在含80 μg · mL-1卡那霉素的MS 培养基上筛选幼苗,转基因阳性苗经过炼苗后,移栽至花盆中,栽培基质为泥炭∶珍珠岩=3∶1,培养在人工气候室,24 ℃,12 h/18 ℃,12 h.
转基因烟草苗(T0 代)移栽30 d 后,对9株转基因烟草的叶片进行了SsGAI的RT-PCR 分析.并于转基因烟草苗移栽75 d 后,仔细观察各种花器官的形态变化.
2 结果与分析
2.1 SsGAI 基因的序列
根据GAI保守序列设计引物,以大岩桐花蕾cDNA为模板,经PCR扩增获得一条608bp的特异片段,用RACE法分别获得3’端1150bp和5’端1256bp的目的片段.将已得到的三段序列通过DNAman软件进行拼接,根据拼接序列在ORF两端设计引物进行PCR扩增,获得SsGAI的全长ORF序列,长度为1689 bp.
2.2 SsGAI 全长序列生物信息学分析
通过序列拼接得到SsGAI的全长序列.SsGAI的cDNA全长为2147 bp,该序列包含一个完整的开放阅读框(ORF),长度为1689 bp,编码562个氨基酸,起始密码子为ATG,在序列的5’端17-18核苷酸处可能有一段信号肽剪切位点,含有加尾信号AATAA1-3序列和poly(A)11序列(图1).该序列的GenBank登录号为FJ594773.Blastp分析发现,SsGAI与葡萄的VvGAI及陆地棉的GhGAI相似性分别为68%、64%.


图1 大岩桐SsGAI基因全长序列和推测的氨基酸序列
2.3 SsGAI 氨基酸序列的系统进化分析
在软件MEGA 4.1平台上构建系统进化树,对SsGAI基因编码的氨基酸与GenBank记载的13种GAI蛋白之间构建系统进化树,进行聚类分析.图3结果显示:SsGAI与葡萄的VvGAI及陆地棉的GhGAI相似性分别为68%、64%.大岩桐SsGAI归属于GRAS家族中的双子叶家族的分类群,而与单子叶植物亲缘关系较远.
2.4 SsGAI基因的器官特异性表达分析
如图4所示,以大岩桐Actin为内参,SsGAI在叶、花萼、直径5 mm的花芽、根中都有表达,且在花萼中表达量较高,但是在茎中表达沉默.
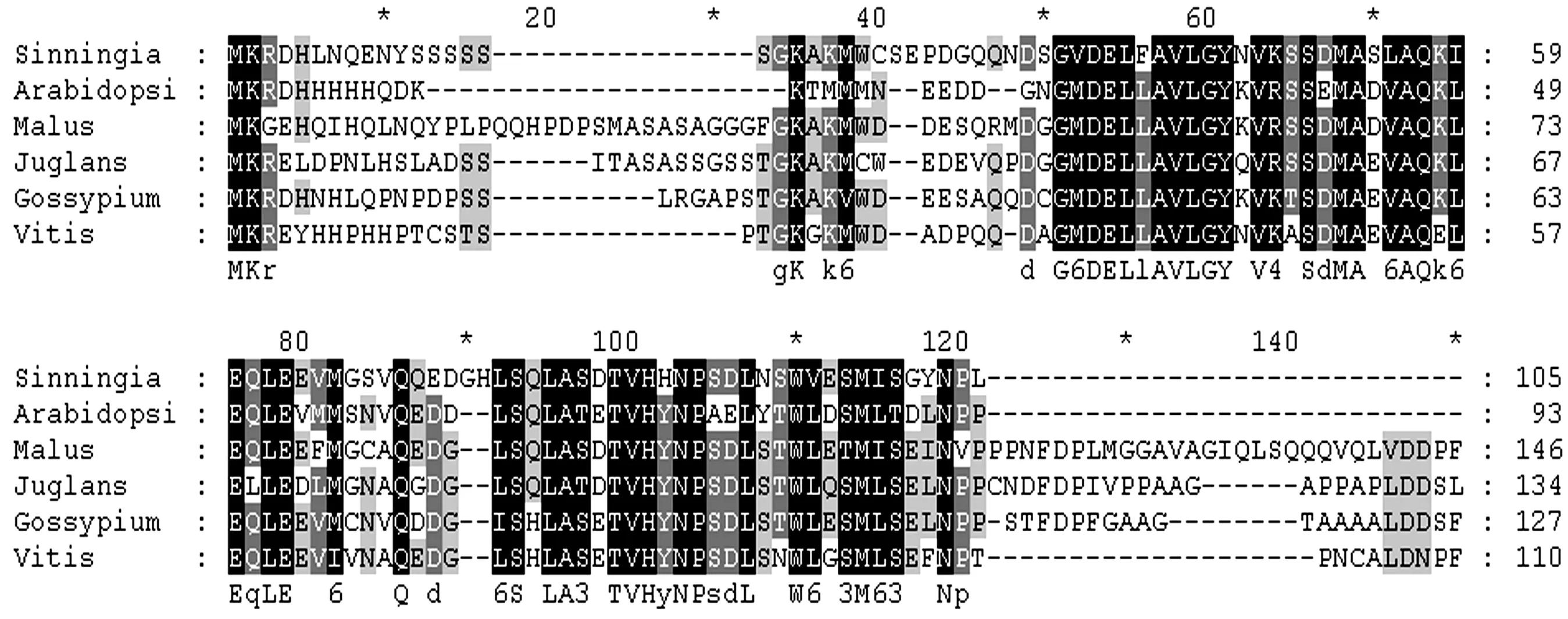

图2 大岩桐及其他植物GAI氨基酸序列同源性比对
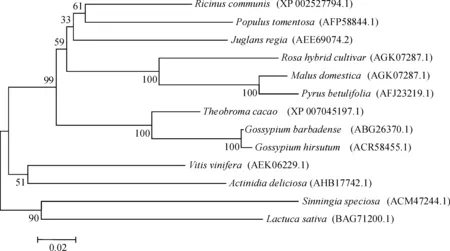
注:系统发育树分析及多序列比对所涉及到的有关基因序列如下:大岩桐的SsGAI(ACM47244.1);杜梨的pbGAI(AFJ23219.1); 苹果的mdGAI(ADW85805.1);玫瑰的RoGAI(AGK07287.1);陆地棉的GhGAI(ACR58455.1);毛白杨的PtGAI(AFP58844.1); 海岛棉的GbGAI(ABG26370.1);胡桃的JrGAI(AEE69074.2);莴苣的LsGAI(BAG71200.1);蓖麻的RcGAI(XP_002527794.1); 猕猴桃的AdGAI(AHB17742.1);可可的TcGAI(XP_007045197.1);葡萄的VvGAI(AEK06229.1)
2.5 转SsGAI烟草的表型分析
利用农杆菌介导法将SsGAI基因转化烟草,在转基因苗移栽30 d后,对转基因烟草叶片进行了SsGAI表达的RT-PCR检测分析.结果显示,在转基因烟草中检测到了SsGAI的表达,野生型中未检测到SsGAI的表达(见图5),说明SsGAI已整合进烟草基因组,并成功表达.

注:L:叶;S:花萼;F:直径5mm花芽;R:根;ST:茎
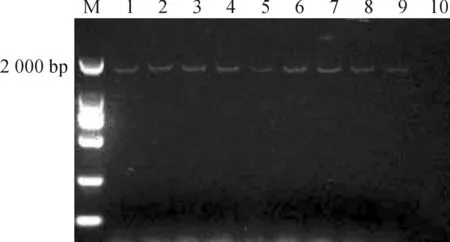
注: M: MarkerⅢ; 1-9:转化植物;10:野生型植株
转基因烟草移栽75d后开始观察并记录其表型变化,野生型烟草的花有5个花瓣,转SsGAI烟草的花表现出了两种新的表型:1)6瓣花,出现频率为18.06%;2) 8瓣花,出现频率为30.56%(表1).且转基因烟草的植株高度显著下降,花期延迟(见图6).

表1 移栽后转基因烟草的花型及株形变化
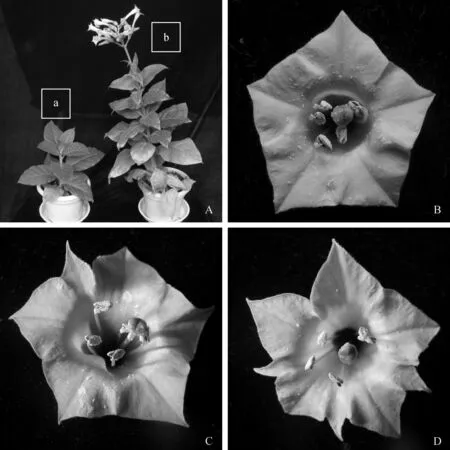
A.转化SsGAI和野生型的烟草植株,a为转化SsGAI的植株;b为野生型植株;B.野生型的开放花,花瓣5枚;C. 转SsGAI 的开放花,花瓣6枚;D. 转SsGAI 的开放花,花瓣8枚.
3 结 语
DELLA蛋白作为GA信号转导的主要反向作用因子,起着调节植物生长和发育过程的作用. 本研究克隆了大岩桐SsGAI基因,并利用生物信息学对SsGAI进行了系统分析.SsGAI基因推导的蛋白序列与其他植物有一定差异,但均含有保守的DELLA结构域,且N端都含有酶活性中心区域TVHYNP,表明在进化中基因功能结构域的稳定性.大岩桐SsGAI编码的多肽链无信号肽酶切位点,表明SsGAI在细胞中合成后,不进行蛋白转运,其在细胞内的准确定位还有待研究.
SsGAI在根、叶、花萼、花芽中都有表达,但是在茎中表达沉默,推测该基因可能在各个器官中发挥着不同的调节作用.
SsGAI转化烟草植株株型矮化,花瓣数量增加,这表现为GA缺失的表型,这可能是DELLA蛋白的过量表达使其抑制功能进一步加强,抑制了赤霉素的作用,使植株矮化、节间变短和花发育发生异常等.Hani等[14]将一个拟南芥GAI基因转化烟草,结果发现转基因植株也表现花瓣数增加,此外还有雄蕊花瓣化现象发生.Llewelyn等[15]将35S:GAI转入烟草,转基因植株矮化,花和果荚发育异常.在番茄中过量表达苹果Mhgai1,会表现出花器官变小和单性结实的性状[16].
综上所述,本研究克隆得到了大岩桐SsGAI基因的全长cDNA,并对该基因序列,其编码的氨基酸序列、功能结构域及在器官中的表达区域等进行了初步分析,并将其置于烟草中异位表达,进一步研究了它对植物生长发育的影响.
参考文献:
[1]Cheng H, Qin L J, Lee S,etal. Gibberellin regulatesArabidopsisfloral development via suppression of DELLA protein function[J]. Development,2004,131:1055-1064.
[2]Davière J M, Achard P. Gibberellin signaling in plants[J]. Development,2013,140(6):1147-1151.
[3]Theologis A, Ecker J R, Palm C J,etal. Sequence and analysis of chromosome 1 of the plant Arabidopsis thaliana[J]. Nature,2000,408(6814):816-820.
[4]Lester D R, Ross J J, Smith J J,etal. Gibberellin 2-oxidation and the SLN gene ofPisumsativum[J]. Plant J,1999,19(1):65-73.
[5]Busov V, Meilan R, Pearce D W,etal. Transgenic modification ofgaiorrgl1 causes dwarfing and alters gibberellins, root growth, and metabolite profiles inPopulus[J]. Planta,2006,224(2):288-299.
[6]Foster T, Kirk C, Jones W T,etal. Characterisation of the DELLA subfamily in apple (MalusxdomesticaBorkh.)[J]. Tree Genet Genomes,2007,3(3):187-197.
[7]Vargas A M, Cunff L L, This P,etal.VvGAI1 polymorphisms associate with variation for berry traits in grapevine[J]. Euphytica,2013,191(1):85-98.
[8]Dill A, Sun T P. Synergistic derepression of gibberellin signaling by removingRGAandGAIfunction inArabidopsisthaliana[J]. Genetics,2001,159(2):777-785.
[9]Fu X D, Sudhakar D, Peng J R,etal. Expression ofArabidopsisGAIin Transgenic Rice Represses Multiple Gibberellin Responses[J]. The Plant cell,2001,13(8):1791-1802.
[10]Boss P K, Thomas M R. Association of dwarfism and floral induction with a grape ‘green revolution’ mutation[J]. Nature,2002,416:847-850.
[11]L Hamama A, Naouar R, Gala L,etal. Overexpression ofRoDELLAimpacts the height, branching, and flowering behaviour ofPelargonium×domesticumtransgenic plants[J]. Plant Cell Rep,2012, 31(11):2015-2029.
[12]Pang J L, Wang L L, Hu JQ,etal. Synergistic promotion of gibberellin and cytokinin on direct regeneration of floral buds from in vitro cultures of sepal segments insinningiaspeciosahiern[J]. In vitro Cellular&Development Biology Plant,2006,42(5):450-454.
[13]Pang J L, Wang L L, Xiang TH,etal. High-frequency Floral Bud Regeneration from Petal Segment Cultures ofSinningiaspeciosaHiern[J]. Chinese Journal of Cell Biology,2012,34(3):279-285.
[14]AI-Ahmad H, Gressel T. Transgene containment using cytokinin-reversible male sterility in constitutive, gibberellic acid-insensitive (Δgai) transgenic tobacco[J]. Journal of plant growth regulation,2005,24(1):19-27.
[15]Hynes L W, Peng J R, Richards D E,etal. Transgenic expression of theArabidopsisDELLA proteins GAI and gai confers altered gibberellin response in tobacco[J]. Transgenic Research,2003,12(6):707-714.
[16]Wang S S, Liu Z Z, Sun C,etal. Functional characterization of the appleMhGAI1 gene through ectopic expression and grafting experiments in tomatoes[J]. Journal of Plant Physiology,2012,169(3):303-310.
