pcDNA-DEST47-miR-29b重组质粒的构建及其对VEGF表达的靶向调控作用
2014-08-25,,,,*
, ,,,*
(1.吉林大学公共卫生学院 卫生部放射生物学重点实验室,长春 130021;2.延边大学医学院,吉林 延吉 133000)
·现代医学研究·
pcDNA-DEST47-miR-29b重组质粒的构建及其对VEGF表达的靶向调控作用
单鸿阁1,2,高辉1,张海芹1,董娟聪1,金顺子1*
(1.吉林大学公共卫生学院 卫生部放射生物学重点实验室,长春 130021;2.延边大学医学院,吉林 延吉 133000)
目的 构建has-miR-29b重组表达载体,并探讨其对VEGF表达的靶向调控作用。方法 利用生物信息学方法预测has-miR-29b与VEGF-3′UTR的结合位点;将PCR扩增的miR-29b前体序列和pcDNA-DEST47载体经酶切后连接,构建pcDNA-DEST47-miR-29b表达载体;采用荧光素酶检测法和Western blot法证实miR-29b对VEGF蛋白表达的抑制作用。结果 psiCHECK2-VEGF荧光素酶报告质粒和pcDNA-DEST47-miR-29b两种质粒共转染组的荧光素酶活性明显低于单独转染的空载体组和Lu-VEGF组(P<0.01),同时发现其他种类miRNA(Let-7g)不能抑制VEGF荧光素酶活性,而miR-29b明显抑制VEGF荧光素酶活性;转染pcDNA-DEST47-miR-29b质粒后在Jurkat细胞中VEGF蛋白的表达明显受抑制。结论 本研究成功构建pcDNA-DEST47-miR-29b重组质粒;miR-29b与VEGF具有靶向关系,且miR-29b参与其调控作用。
miR-29b;VEGF;肿瘤;调控
miRNA是一种具有21~25核苷酸长度的单链小分子RNA,属于非编码RNA,成熟的miRNA 5′端的磷酸基团和3′端的羟基则是它与相同长度的功能RNA降解片段的区分标志。miRNA存在于多种生物基因组内,主要在转录后水平发挥调控作用,抑制约40%~50%的蛋白质编码基因,从而构成了一个庞大的转录后调控网络,发挥其重要作用[1-2]。现已证明[3],miRNA与机体的胚胎发育、细胞增殖和凋亡以及肿瘤发生密切相关,特别是在肿瘤发生、发展过程中可起到癌基因或抑癌基因作用。miR-29b是一种非常重要的miRNA,其在生物体中扮演着抑癌基因的角色,对避免生物体细胞的癌变起到非常重要的作用。在多种肿瘤细胞中,miR-29b通过对不同靶基因表达的调控作用,解除对一系列导致靶基因的表达失调,从而调节细胞的正常生物学功能[4-5]。本实验首先利用生物信息学方法预测has-miR-29b与VEGF-3′UTR的结合位点,拟构建miR-29b的重组质粒和VEGF-3′UTR的荧光素酶报告质粒,并证实miR-29b与VEGF具有靶向关系,并且具有调控作用,为进一步探讨miR-29b在肿瘤细胞中的作用机制及功能提供实验依据。
1 材料与方法
1.1 细胞培养与转染 Jurkat细胞由本实验室保存,RPMI-1640培养液中加入含10%胎牛血清,置37 ℃,5%CO2的培养箱中培养。用500 μL灭菌水稀释4 μg重组质粒并加入10 μL脂质体,室温放置20 min制成DNA-脂质体溶液。将DNA-脂质体溶液加入已换成无血清培养基的Jurkat细胞中,继续培养6 h后更换完全培养基。
1.2 重组真核表达载体的构建和鉴定 1)生物信息学预测miR-29b与VEGF-3′UTR结合位点采用常见的靶标基因预测软件Targetscan及RNAhybrid预测miR-29b与VEGF的3′UTR结合位点。在线预测网站分别为http://www.microrna.org和http://microrna.sanger.ac.uk。

Has⁃mIR⁃29bUUGUGACUAAAGUUUACCACGAU |·||:|·||||··|·||||||||VEGF⁃3′UTRATCATTTATTT--ATTGGTGCTA
2)psiCHECK2-VEGF-3′UTR荧光素酶报告质粒(以下简称为Lu-VEGF)的构建:用psiCHECK-2载体(美国,Promega公司)设计VEGF-3′UTR片段序列,通过PCR从基因组DNA钓出VEGF-3′UTR,连到T-easy载体(美国,Promega公司),测序确认,最后用NotⅠ酶切,插入psiCHECK-2载体中,测序后确认克隆成功。VEGF-3′UTR引物序列如下:上游5′-TCTACCTCCACCATGCCAAGT-3′;下游3′-TTCCTCCTCCCGTCTTAGTAG-5′。3)pcDNADEST47-miR-29b质粒(以下简称为miR-29b)的构建:以VEGF为模板,设计miR-29b引物序列。将PCR片段插入到pCR8/GW/TOPO TA载体(美国,Invitrogen公司)后测序,再将其片段克隆到pcDNA DEST47载体(美国,Invitrogen公司)中,测序后确认克隆成功。hsa-miR-29b引物序列如下:上游5′-TGTGCCCTTGCCTCTAAATG-3′;下游3′-GGGAGTTCC-TATGGTTCCCT-5′。
1.3 荧光素酶检测 采用Lipofectamine-2000将miR-29b质粒和Lu-VEGF质粒共转染至Jurkat细胞中,48 h后收集细胞,采用Dual-Luciferase Reporter Assay System(美国,Promega公司)试剂盒,用Lumino meterinstrument(infinite M200,TECAN)仪器测定其荧光素酶表达量。
1.4 Western blot法 将提取的总蛋白加热变性,经10%SDS-PAGE后转移至PVDF膜上,用含5%BSA的TBST缓冲液封闭1 h,加入抗VEGF单克隆抗体(1∶100稀释),4 ℃过夜;用含吐温-20的TBST缓冲液洗膜3次,10 min/次,加入HRP标记的兔抗鼠IgG(1∶1 000稀释),室温孵育1 h;用含吐温-20的TBST缓冲液洗膜3次,10 min/次,ECL化学发光法检测条带。以β-肌动蛋白作为内参,采用Super Signal West Dura(美国,Thermo公司)试剂盒,用LAS mini4000 chemiluminoscent signal detectioninstrument(日本,Fujifilm公司) 仪器曝光,然后用Multi Gauge V 3.1软件分析数据,操作重复3次。
2 结果
2.1 成功构建重组质粒pcDNA DEST47-miR-29b和Lu-VEGF荧光素酶报告质粒 将扩增的miR-29b PCR片段插入到pCR8/GW/TOPO TA载体后测序,再将其片段克隆到pcDNA DEST47载体中,测序后确认克隆成功。目的片段has-miR-29b的大小为786 bp(图1B),与测序结果相符(图1C)。设计VEGF-3′UTR片段序列,通过PCR从基因组DNA钓出VEGF-3′UTR,连到T-easy载体,测序确认后用NotⅠ酶切,插入psiCHECK-2载体中,测序后确认克隆成功。目的片段VEGF-3′UTR的大小为201 bp(图1A),与测序结果相符(图1D)。
2.2 miR-29b对VEGF-3′UTR的靶向调控作用 采用荧光素酶检测法和Western blot法证实miR-29b对VEGF-3′UTR靶向调控。从图2A看出,miR-29b和Lu-VEGF质粒共转染组的荧光素酶活性明显低于单独转染的空载体组和Lu-VEGF质粒组(P<0.01);同时将Let-7g作为对照组检测荧光素酶活性,结果发现miR-29b明显抑制VEGF荧光素酶活性,而Let-7g不能抑制VEGF。从图2B和C可看出,转染pcDNA-DEST-mir-29b质粒后,可以诱导其靶分子VEGF蛋白表达的抑制,约降低至42%(重复3次,结果基本一致)。
3 讨论
近年来,有大量文献[6-7]报道关于miRNA作为肿瘤治疗靶点的可能性。可以说, 通过调控miRNA进行体内肿瘤治疗的手段是目前miRNA在肿瘤中作用的最大热点之一,并取得了一些理论上及技术体系上的新突破[8]。目前应用miRNA体内治疗肿瘤方面的成功范例还仅仅局限于小鼠某些的特定肿瘤模型,因此,还有大量的未知领域值得进一步探讨。为进一步探索miR-29b的生物学功能,本实验人工合成miR-29b重组质粒和VEGF-3′UTR的荧光素酶报告质粒,探讨has-miR-29b对VEGF的靶向调控作用。
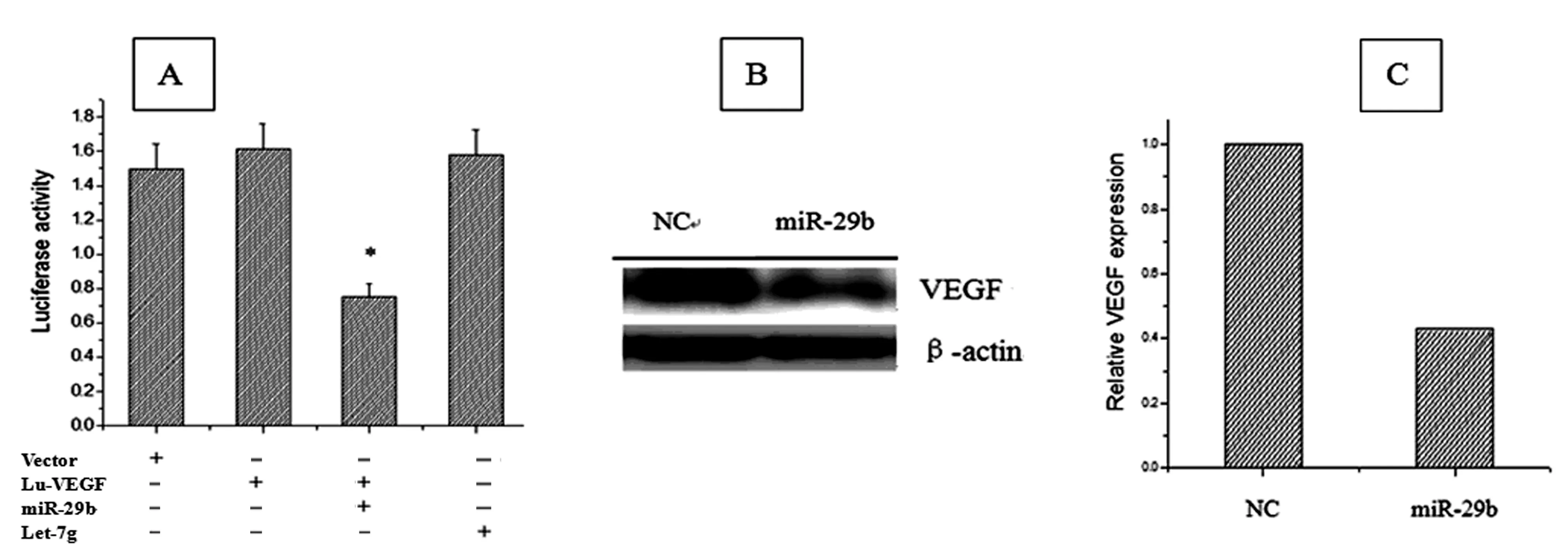
A为miR-29b对VEGF荧光素酶活性的影响,B为miR-29b靶向调控VEGF蛋白的电泳图,C为电泳带的灰度值分析图(n=3,#P<0.01)。
在本实验中,首先两种质粒共转染组的荧光素酶表达明显低于单独转染的空载体和Lu-VEGF组(P<0.01),另外用其他miRNA(Let-7g)做对比观察发现,miR-29b与VEGF-3′UTR特异结合,而其他miRNA不能结合,说明miR-29b与VEGF可能是靶向关系。其次,采用Western blot方法,观察转染pcDNA-DEST-miR-29b质粒后,Jurkat细胞表达VEGF蛋白的情况,发现miR-29b与VEGF-3′UTR结合,降低蛋白的表达,可以认为miR-29b对VEGF有靶向调控作用。VEGF因其促凋亡活性和引起免疫反应的能力可阻止肿瘤的发生,但随着肿瘤的形成和免疫防御的丧失,VEGF又能促进与肿瘤浸润和转移有关基因的表达,使患者的预后恶化[9]。研究[10]发现,miR-29b能够抑制胃癌细胞迁移和增殖,可见VEGF及其靶向关系的miR-29b有可能成为诊断及治疗肿瘤的新靶标。通过对miR-29b与VEGF以及肿瘤关系的研究,可以从非编码RNA水平揭示肿瘤发生、发展的内在机制,并为寻找治疗肿瘤有效的新靶标提供理论依据。
[1]Corbin R,Olsson-Carter K,Slack F.The role of microRNAs in synaptic development and function[J].BMB Rep,2009,42(3):131-135.
[2]Cordes K R,Srivastava D.MicroRNA regulation of cardiovascular development[J].Circ Res,2009,104(6):724-732.
[3]Chua J H,Armugam A,Jeyaseelan K.MicroRNAs:biogenesis,function and applications[J].Curr Opin Mol Ther,2009,11(2):189-199.
[4]Amodio N,Bellizzi D,Leotta M,et al.miR-29b induces SOCS-1 expression by promoter demethylation and negatively regulates migration of multiple myeloma and endothelial cells[J].Cell Cycle,2013,12(23):3650-3662.
[5]Li P,Guo W,Du L,et al.microRNA-29b contributes to pre-eclampsia through its effects on apoptosis,invasion and angiogenesis of trophoblast cells[J].Clin Sci (Lond),2013,124(1):27-40.
[6]Tavazoie S F,Alarcón C,Oskarsson T,et al.Endogenous human microRNAs that suppress breast cancer metastasis[J].Nature,2008,451(7175):147-152.
[7]Davis M E,Zuckerman J E,Choi CH,et al.Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles[J].Nature,2010,464(7291):1067-1070.
[8]Hafner M,Landthaler M,Burger L,et al.Transcriptome-wide identification of RNA-binding protein and microRNA target sites by PAR-CLIP[J].Cell,2010,141(1):129-141.
[9]Forrest A R,Kanamori-Katayama M,Tomaru Y,et al.Induction of microRNAs,mir-155,mir-222,mir-424 and mir-503,promotes monocytic differentiation through combinatorial regulation[J].Leukemia,2010,24(2):460-466.
[10]Lang N,Liu M,Tang Q L,et al.Effects of microRNA-29 family members on proliferation and invasion of gastric cancer cell lines[J].Chin J Cancer,2010,29(6):603-610.
ConstructionofpcDNA-DEST47-miR-29banditsregulatoryeffectsonexpressionofVEGF
SHAN Hongge1,2,GAO Hui1,ZHANG Haiqin1,DONG Juancong1,JIN Shunzi1*
(1.Key Laboratory of Radiobiology,Ministry of Health,School of Public Health,Jilin University,Changchun,130021,China;2.Medical College of Yanbian University,Yanji 13300,Jilin province,China)
ObjectiveTo construct the recombinant expression vector of has-miR-29b and to explore its effect on expression of VEGF.MethodsBioinformatics was used to analyze the potential binding sites of has-miR-29b and VEGF-3′UTR.The precursor of miR-29b was amplified by PCR and the PCR products were cloned into digestion pcDNA-DEST47 vector to construct pcDNA- DEST47-miR-29b expression vector.The effect of miR-29b interaction with the 3’-UTR of VEGF on luciferase activity was detected with a dual 1uciferase assay system and the expression level of VEGF protein affected by miR-29b was detected by Western blotting.ResultsThe luciferase activity was significantly lower in cells co-transfected with psiCHECK2-VEGF luciferase reporter plasmid and pcDNA-DEST47-miR-29b compared with empty vector group and Lu-VEGF group (P<0.01).The luciferase activity was not inhibited in the other types of miRNA (Let-7g),whereas miR-29b could negatively regulate the luciferase activity by interacting with the 3’-UTR of VEGF.VEGF protein expression was significantly inhibited in Jurkat cells transfected with pcDNA-DEST47-miR-29b plasmid.ConclusionpcDNA- DEST47-miR-29b plasmid were successfully constructed;miR-29b targetedly regulates the expression of VEGF.
miR-29b;VEGF;tumors;regulation
10.13463/j.cnki.cczyy.2014.04.062
国家自然科学基金项目(30870584,81371890);教育部高等学校博士学科点专项科研基金项目(20120061110063)。
单鸿阁(1991-),男,大学本科。研究方向:肿瘤表观遗传学。
] 金顺子,电话:0431-85619443,电子信箱:jinsz@jlu.edu.cn。
R332
:A
:2095-6258(2014)04-0722-04
2014-03-29)
*[
