RAPD技术筛选麦冬分子鉴定标记的研究
2014-08-25,,
,,
(浙江工业大学 药学院,浙江 杭州 310014)
中药麦冬为百合科多年生草本植物麦冬(Ophiopogonisjaponicus)的干燥块根,具有养阴生津,润肺清心的功效,在临床上应用广泛.我国药典规定药用麦冬主要品种包括湖北麦冬、川麦冬和浙麦冬.其中,浙麦冬和川麦冬同属于百合科沿阶草属,湖北麦冬则属于百合科山麦冬属.湖北麦冬主产于湖北襄樊,由于生长周期短,产量高,成为了麦冬的主流品种.川麦冬主产于绵阳三台,与湖北麦冬并列为国家地理标志性产品.浙麦冬又称杭麦冬、笕麦冬,属“浙八味”之一,是著名的道地药材.由于湖北麦冬、川麦冬和浙麦冬的外观性状及理化性质都极为相似,很难用性状鉴定,显微鉴定和理化检测等传统鉴定方法将三者区分开来.
近年来,分子生物学技术已经被广泛运用于中药鉴定,随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD)是在1990年Williams[1]和Welsh[2-3]领导的两个小组几乎同时发展起来的一项新的DNA分子标记技术.它是建立在PCR基础之上,可直接分析药用植物DNA的多态性,并能筛选特有的DNA标记.RAPD技术具有操作简便,耗时短等优点,在中药材的分子鉴定研究领域中得到了广泛的运用[4-6].采用RAPD技术对湖北麦冬、川麦冬及浙麦冬三种药用麦冬的基因组DNA进行多态性分析,从而筛选出三种麦冬的特异性分子鉴定标记,为建立一套高效、准确的麦冬鉴定方法奠定基础,对实现中药材麦冬的分子鉴定具有重要意义.
1 材料与方法
1.1 材 料
1.1.1 药 材
中药湖北麦冬植株购自湖北襄樊市欧庙镇;中药川麦冬植株购自著名麦冬生产基地四川省绵阳市三台县;中药浙麦冬植株采自浙江宁波余姚和慈溪天元镇.以上样品按照文献[7-8]所述方法经鉴定均为正品.
1.1.2 实验试剂与仪器
植物基因组DNA快速抽提试剂盒和PCR相关试剂购自生工®生物工程(上海)有限公司.RAPD引物由生工®生物工程(上海)有限公司合成.实验使用的PCR扩增仪MyCycle® Thermal Cycler,电泳仪Power PacTMBasic,凝胶成像系统Molecular Imager® Gel DocTMXR+Imaging System,均为Bio-Rad公司产品.
1.2 实验方法
1.2.1 麦冬基因组DNA的提取
称取100 mg麦冬植株的新鲜嫩叶,剪碎放入研钵中,倒入液氮快速研磨成粉末,将粉末移入1.5 mL离心管中依次加入400 μL Buffer PCL Solution,8 μL β-巯基乙醇,震荡混匀.65 ℃水浴45 min至细胞完全裂解,加入20 μL RNase A放置5 min,然后加入200 μL Buffer PP Solution,充分颠倒混匀后-20 ℃静置5 min,室温10 000 r/min离心5 min,将上清液移到新的1.5 mL离心管中;加入等体积的异丙醇(-20 ℃预冷),颠倒混匀置于4 ℃过夜,10 000 r/min离心5 min,弃上清;加入1 mL 75%乙醇漂洗,10 000 r/min离心2 min,弃上清,重复此步骤一次;开盖倒置10 min至残留的乙醇完全挥发.提取获得的基因组DNA用80 μL TE Buffer溶解,于-20 ℃储存备用.
1.2.2 麦冬基因组DNA的质量检测
电泳法检测麦冬基因组DNA的质量:制备1%的琼脂糖凝胶,样品与上样液混合后加入加样孔中,在电压75 V的条件下电泳50 min,胶板经0.5 μg/mL溴化乙锭溶液染色后,移至凝胶成像系统,在紫外环境下观察,检测结果拍照留存.分光光度法检测麦冬基因组DNA的质量:将湖北麦冬、川麦冬和浙麦冬基因组DNA进行适量稀释,以TE溶液为空白对照,测定各麦冬样品的OD260值和OD280值,计算OD260/OD280值以评估基因组DNA的纯度.根据公式DNA质量浓度=OD260×稀释倍数×50,可计算出各样品的DNA质量浓度.
1.2.3 RAPD引物的合成
根据引物中GC百分比(%)较高,无发卡结构的原则,从RAPD引物库中选取了40条引物,均由10个碱基组成,送至上海生工生物工程有限公司合成.RAPD引物序列见表1.

表1 RAPD引物序列
1.2.4 RAPD反应体系的优化
RAPD反应的初始体系为:2 μL 10×PCR buffer(without MgCl2),1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.5 μL Taq DNA polymerase(5 U/μL),1 μL RAPD引物(20 μmol/L),1 μL麦冬基因组DNA模板,补 ddH2O至反应液总体积为20 μL.初始RAPD扩增条件为:94 ℃预变性3 min,然后每个循环:94 ℃变性15 s,36 ℃复性30 s,72 ℃延伸1 min,45个循环,最后72 ℃延伸7 min.
根据本实验室对RAPD扩增的研究经验[9],模板DNA浓度、引物浓度、Taq DNA聚合酶以及退火温度对RAPD扩增起到关键性作用.为了获得RAPD扩增的最佳效果,本实验依次对模板DNA浓度、引物浓度、Taq DNA聚合酶以及退火温度进行了优化,优化参数见表2.在优化过程中,每次只调节一个单因素的量,其他因素维持在初始体系的浓度,在确立了最佳模板DNA浓度、引物浓度和Taq DNA聚合酶后再对退火温度进行优化,完善扩增程序,得出最佳的RAPD反应体系,从而确保RAPD扩增的稳定性.
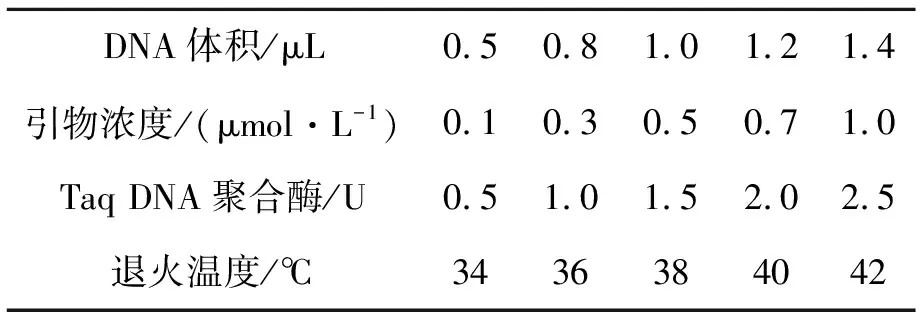
表2 RAPD反应体系优化实验的影响因素
1.2.5 麦冬分子鉴定标记的筛选
以湖北麦冬、川麦冬和浙麦冬基因组DNA为模板,逐一以40条随机引物为扩增引物,根据优化后的RAPD最佳反应条件进行扩增.RAPD扩增产物用1.2%琼脂糖凝胶电泳分离,胶板经溴化乙锭染色后在凝胶成像系统中观察结果,并照相留存.
2 结果与分析
2.1 麦冬基因组DNA的提取和质量分析
三种麦冬基因组DNA的提取结果(图1)显示各麦冬基因组DNA大小在23 kb左右,DNA条带清晰明亮,无弥散现象,点样孔内无残留,说明提取到的三种麦冬基因组DNA完整无降解,蛋白质及多糖类杂质较少,质量较好,浓度较高.根据图1中条带的亮度,确定三种麦冬基因组DNA紫外分光光度法检测的稀释倍数.稀释的样品在紫外分光光度计上检测后的结果见表3,三种麦冬基因组DNA的OD260/OD280比值在1.804~1.907之间,DNA浓度介于351~736 μg/mL.紫外分光光度计检测的数据亦表明三种麦冬基因组DNA的纯度和浓度均较高,蛋白质杂质较少.
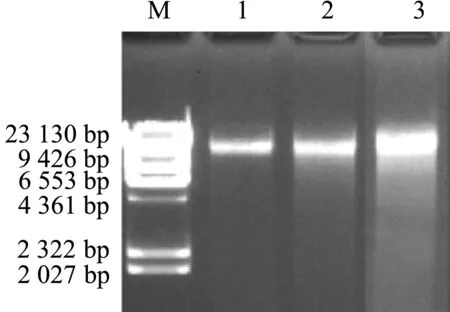
M—DNA分子量Marker;1—湖北麦冬新鲜嫩叶DNA提取物;2—川麦冬新鲜嫩叶DNA提取物;3—浙麦冬新鲜嫩叶DNA提取物
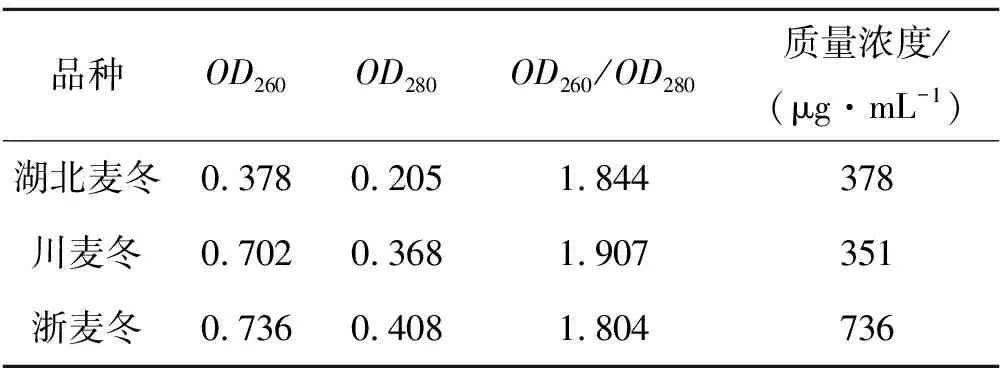
表3 麦冬基因组DNA的紫外检测结果
高质量的基因组DNA作为RAPD反应的模板,是筛选分子鉴定标记的关键.其中DNA的来源组织很重要,从新鲜嫩叶中提取DNA可以充分保证DNA的质量.由于嫩叶组织中的细胞生长旺盛,DNA分裂快,DNA含量就高;并且由于是新生组织,次级代谢产物如蛋白质和多糖等杂质的含量都会是最低的.本实验以新鲜嫩叶为提取组织,提取到了高质量的DNA,以保证后续实验的顺利进行.
2.2 RAPD最佳反应体系的建立
本实验室在预实验中发现以浙麦冬基因组DNA为模板,S430为引物的RAPD图谱条带较丰富且清晰,因此以此反应为研究对象进行RAPD优化实验.优化实验结果见图2,3,根据图示结果选择最佳的反应条件.图2(a)结果显示:当模板DNA浓度低于1.0 μL时,无扩增条带出现;高于1.0 μL时,扩增条带出现弥散现象,因此设定1.0 μL为最佳DNA模板量.图2(b)结果显示:当引物浓度高于0.7 μmol/L时,扩增条带出现弥散现象;当引物浓度低于0.3 μmol/L时,无扩增条带或者条带不清晰,因此设定0.5 μmol/L为最佳引物浓度.图3(a)结果显示:当Taq DNA聚合酶低于1.0 U时,无扩增条带出现;高于2.0 U时,扩增条带出现弥散现象,因此设定1.5 U为最佳Taq DNA聚合酶.图3(b)结果显示:退火温度为40 ℃时,扩增条带数目多且清晰,因此设定用40 ℃为最佳退火温度.
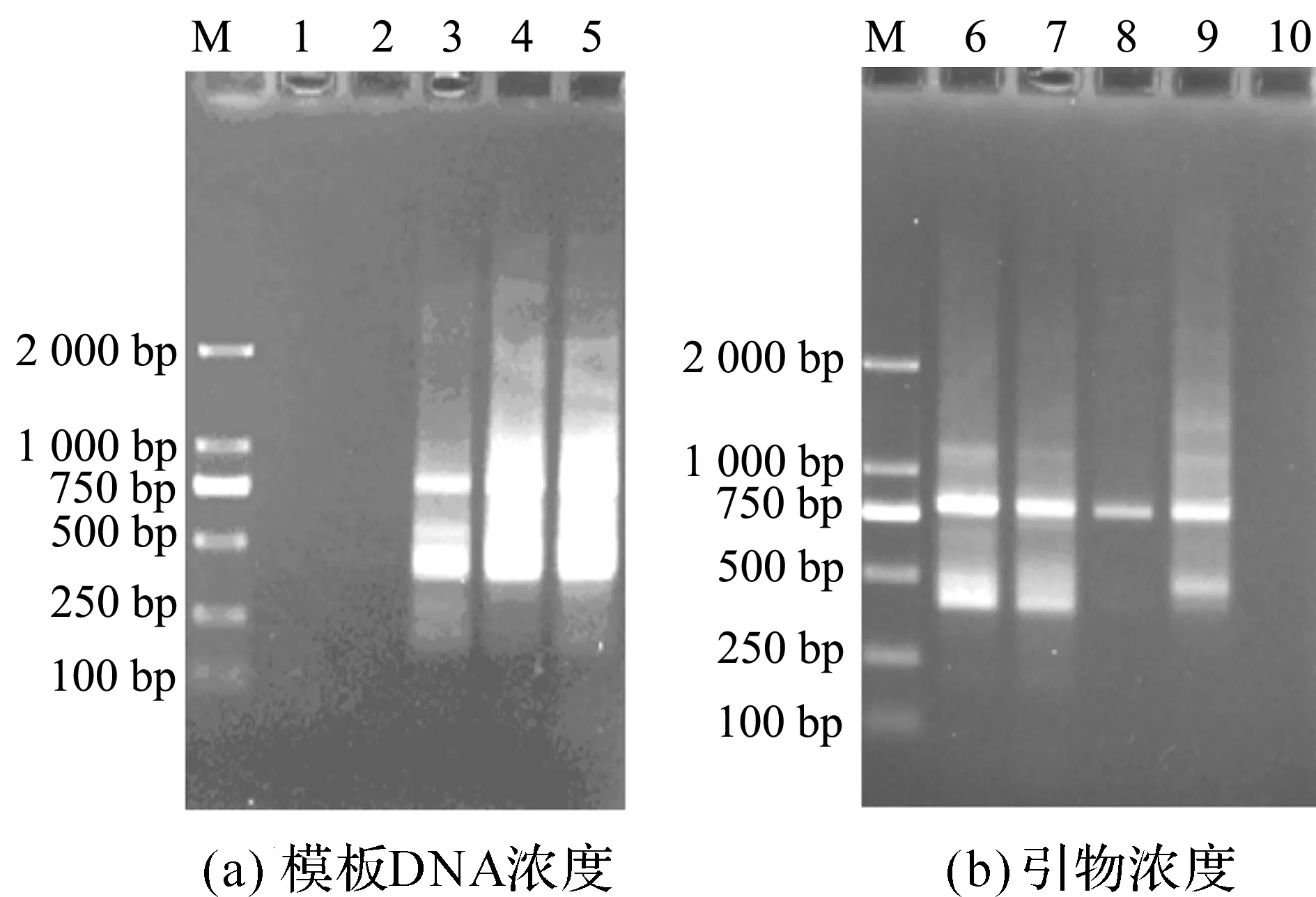
M—DNA分子量Marker;1—5模板DNA体积0.5,0.8,1.0,1.2,1.4 μL;6—10引物浓度1.0,0.7,0.5,0.3,0.1 μmol/L

M—DNA分子量Marker;1—5 Taq DNA聚合酶 0.5,1.0,1.5,2.0,2.5 U;6—10退火温度34,36,38,40,42 ℃
通过对影响RAPD扩增反应的关键因素进行优化,确定最佳的RAPD反应体系为:2 μL 10×PCR buffer(without MgCl2),1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.3 μL Taq DNA polymerase(5 U/μL),0.5 μL RAPD引物(20 μmol/L),1 μL麦冬基因组DNA模板,补ddH2O至反应液总体积为20 μL.最佳的RAPD扩增程序为:94 ℃预变性3 min,然后每个循环:94 ℃变性15 s,40 ℃复性30 s,72 ℃延伸1 min,45个循环,最后72 ℃延伸7 min.
RAPD具有耗时短、操作方便等优点,但也存在局限性,体现在使用随机引物,以及退火温度低引起的实验结果重复性差.通过对RAPD条件进行优化,能够使RAPD在本实验室的操作环境下保持最高程度的稳定性,以利于麦冬分子鉴定标记的筛选和回收.
2.3 麦冬分子鉴定标记的筛选
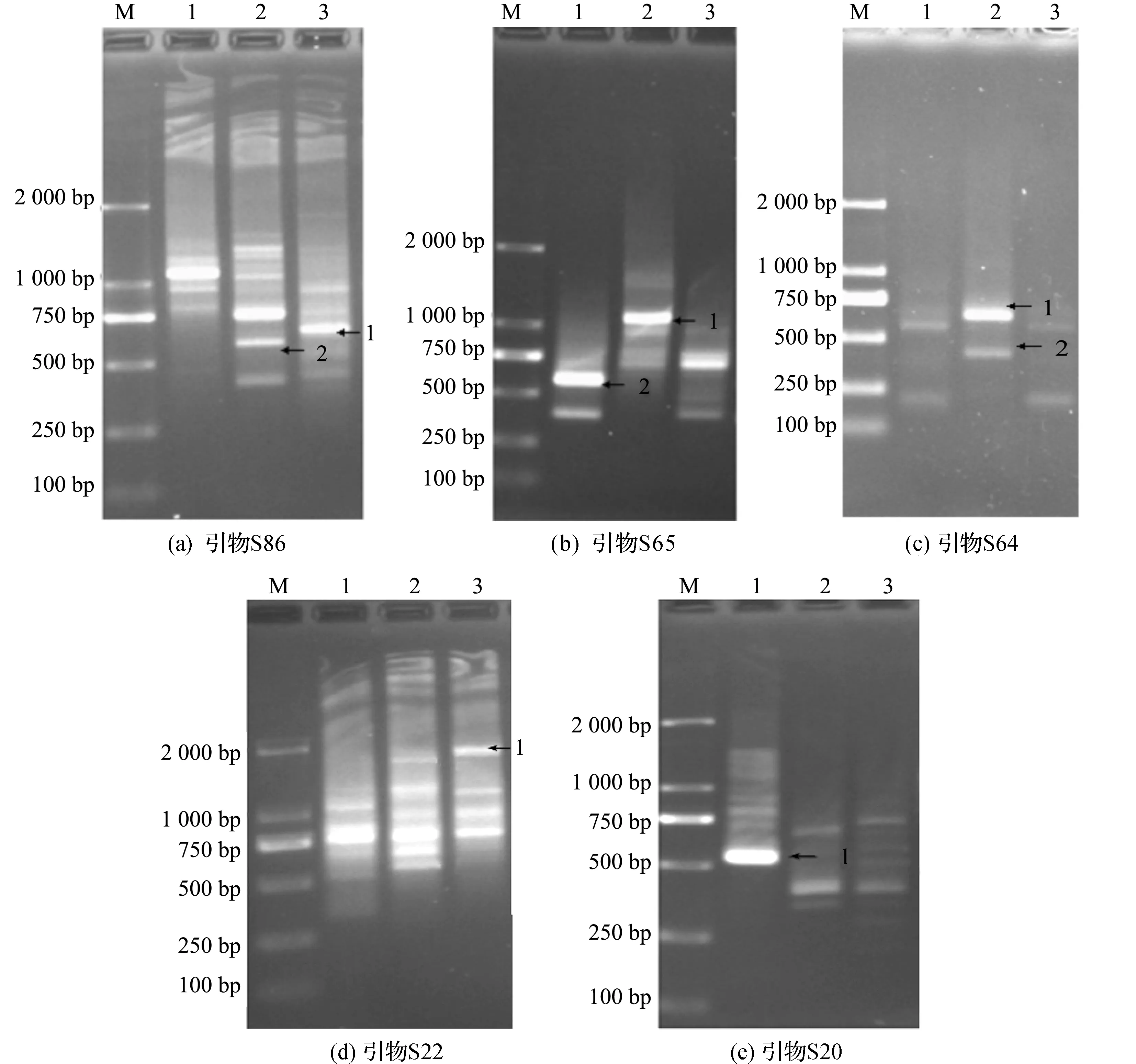
以湖北麦冬、川麦冬和浙麦冬基因组DNA为模板,逐一使用40条随机引物进行RAPD扩增,进行三种麦冬分子鉴定标记的筛选.通过对40条引物结合下的40份RAPD扩增图谱的分析,共筛选到了6条分子鉴定标记(图4).这8条分子鉴定标记分子量大小适宜,均在500~2 000碱基之间,条带明亮清晰,利于回收.图4(a)是引物S86结合下的RAPD结果,箭头1所指的条带是浙麦冬分子鉴定标记;箭头2所指的条带是湖北麦冬分子鉴定标记.图4(b)是引物S65结合下的RAPD结果,箭头1所指的条带是湖北麦冬分子鉴定标记;箭头2所指的条带是川麦冬分子鉴定标记.图4(c)是引物S64结合下的RAPD结果,箭头1和2所指的条带均为湖北麦冬分子鉴定标记.图4(d)是引物S22结合下的RAPD结果,箭头1所指的条带为浙麦冬分子鉴定标记.图4(e)是引物S20结合下的RAPD结果,箭头1所指的条带为川麦冬分子鉴定标记.4条湖北麦冬标记代表不同的基因序列,由于回收分子标记过程中DNA会损失,分子标记的回收和克隆是否成功存在一定的不可预计性,因此,收获的分子鉴定标记越多越好.从图4可以看出:每个分子鉴定标记只在一种麦冬中出现,而其他品种都不会出现,回收这些分子鉴定标记,并进行测序就可以获得分子鉴定标记的序列,这些序列具有特异性,可以根据序列设计特异性引物,进而实现三种麦冬的特异性PCR鉴定.
对3种麦冬分子鉴定标记的筛选发现湖北麦冬分子鉴定标记数目较多,收获的8条分子鉴定标记中湖北麦冬占到了4条,浙麦冬和川麦冬各占2条.这说明湖北麦冬的基因组成与川麦冬和浙麦冬的差异显著,川麦冬和浙麦冬的基因构成则较为相似.从物种亲缘性分析,浙麦冬和川麦冬是同属于沿阶草属的,而湖北麦冬则属于山麦冬属.所以,分子鉴定标记筛选的实验结果也间接体现了3个麦冬品种亲缘性的远近.目前,筛选获得的8条分子鉴定标记的回收、克隆、测序工作正在进行中.
3 结 论
RAPD技术具有操作简便的优点,已经成为一种常用的中药分子鉴定技术,但由于该技术稳定性和重复性差,应用受到了很大的制约.本实验从麦冬嫩芽组织中提取到了高质量的基因组DNA,并对RAPD反应条件进行了优化,最大程度确保了RAPD扩增的稳定性.通过对湖北麦冬、川麦冬和浙麦冬3个品种麦冬基因组DNA的RAPD分析,筛选获得了8条麦冬分子鉴定标记,其中川麦冬和浙麦冬各2条,湖北麦冬4条.将这些标志着麦冬特异性序列的分子标记进行回收、克隆和测序,可以根据测序结果设计引物,实现三种麦冬的特异性PCR鉴定,这种鉴定方法准确,灵敏,重复性好,适用性广,具有良好的应用前景.
M—DNA分子量Marker;1—川麦冬基因组DNA模板;2—湖北麦冬基因组DNA模板;3—浙麦冬基因组DNA模板
参考文献:
[1] WILIAMS JCK, KUBELIK AR, LIVAK KJ, et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucl Acids Res,1990,18(22):6531-6535.
[2] WELSH J, MCCLELLAND M. Finger printing genomes using PCR with arbitrary primers[J]. Nucl Acids Res,1990,18(24):7213-7218.
[3] WELSH J, PETERSEN C, MCCLELLAND M. Polymorphisms generated by arbitrarily primed PCR in the mouse:application to strain identification and genetic mapping[J]. Nucl Acids Res,1991,19(24) 303-306.
[4] 钱敏,曾纬,张德利.冬虫夏草RAPD多态性分析[J].时珍国医国药,2011,22(7):1738-1739.
[5] 郭建林,葛燕芬,孙小芹,等.基于RAPD标记的南苍术居群遗传多样性分析[J].植物资源与环境学报,2012,21(4):35-40.
[6] 王慧中,卢江杰,施农农.利用RAPD分析13种石斛属植物的遗传多样性和亲缘关系[J].中草药,2006,37(4):588-592.
[7] 马屏南.麦冬常用品种鉴别[J].中医中药,2006,3(15):141.
[8] 魏从师,郑虹.麦冬与山麦冬的鉴定使用[J].北方药学,2011,8(3):80.
[9] 李敏,赵欣.三种南方贝母RAPD的分析[J].浙江工业大学学报,2012,40(6):634-639.
